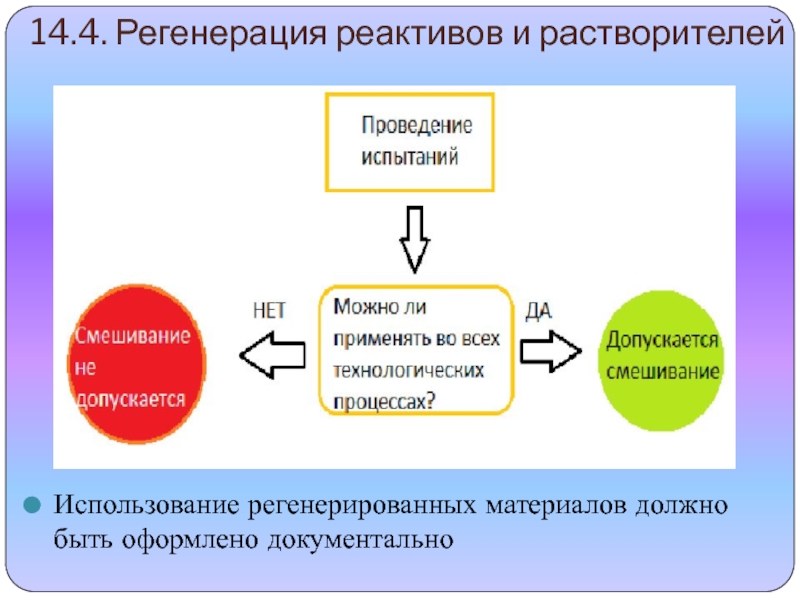
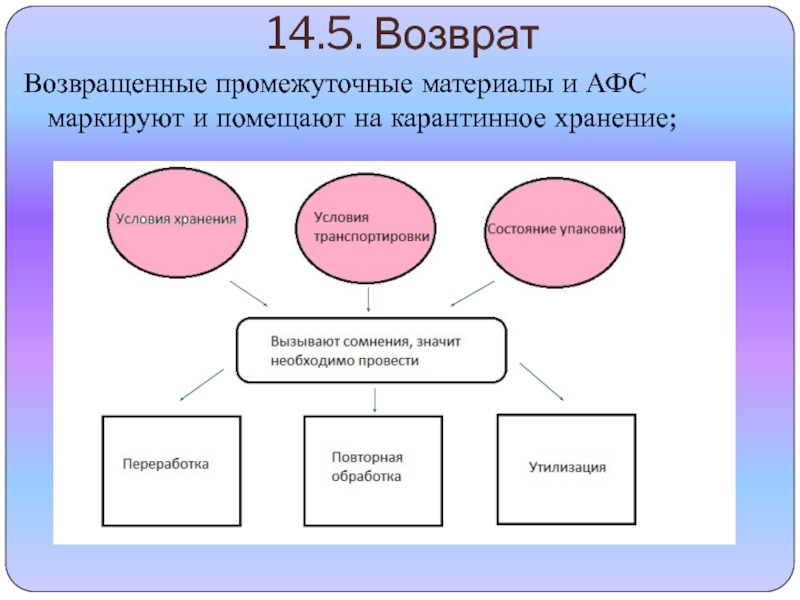
профессионально образования
"Уральский федеральный университет имени первого президента России Б.Н.Ельцина"
Кафедра “Технология
органического синтеза”Презентация
на тему: “Отклонение и переработка материалов”
по дисциплине: “Методы стандартизации и сертификации биотехнологических производств”
Студент(ка) _________ Бобок Е.Д.
Группа:Х-350007
Преподаватель Селезнева И.С.
Екатеринбург
2017