Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
МОНОСАХАРИДЫ. ДИ- и ПОЛИСАХАРИДЫ
Содержание
- 1. МОНОСАХАРИДЫ. ДИ- и ПОЛИСАХАРИДЫ
- 2. Углеводы – это многоатомные альдегидо- или кетоспирты
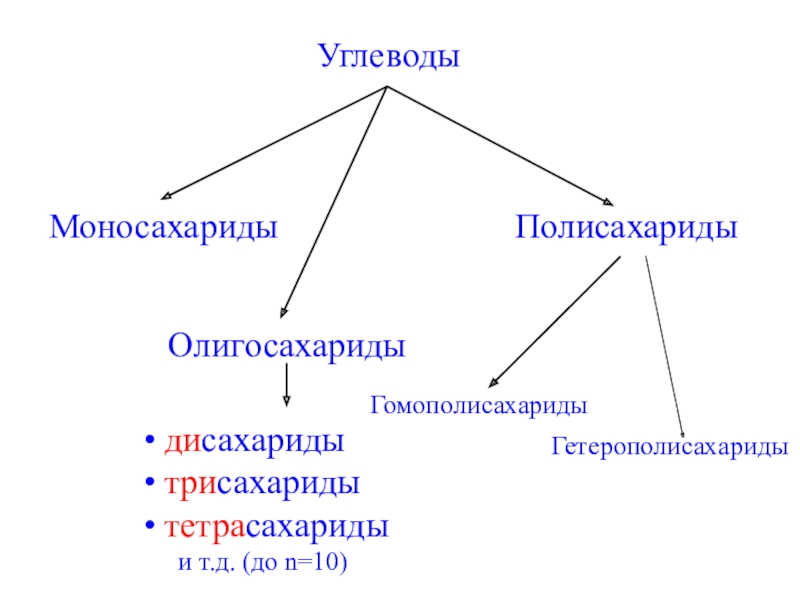
- 3. УглеводыМоносахаридыПолисахаридыОлигосахаридыГомополисахариды дисахариды трисахариды тетрасахариды и т.д. (до n=10)Гетерополисахариды
- 4. Моносахариды – это простые углеводы, которые в
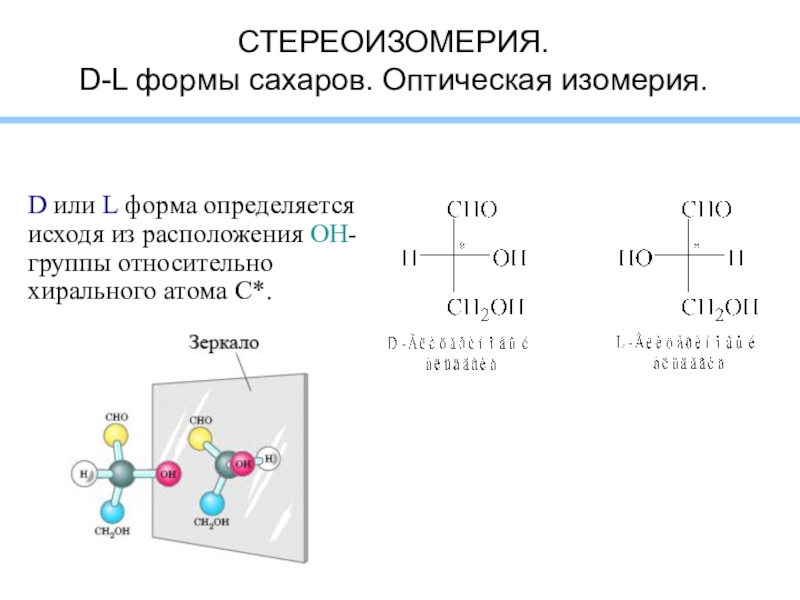
- 5. СТЕРЕОИЗОМЕРИЯ. D-L формы сахаров. Оптическая изомерия.D или
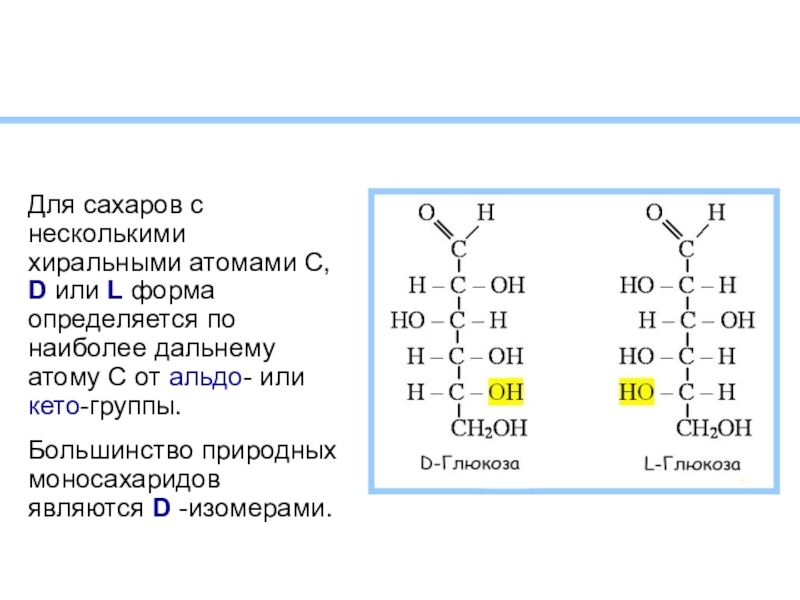
- 6. Для сахаров с несколькими хиральными атомами С,
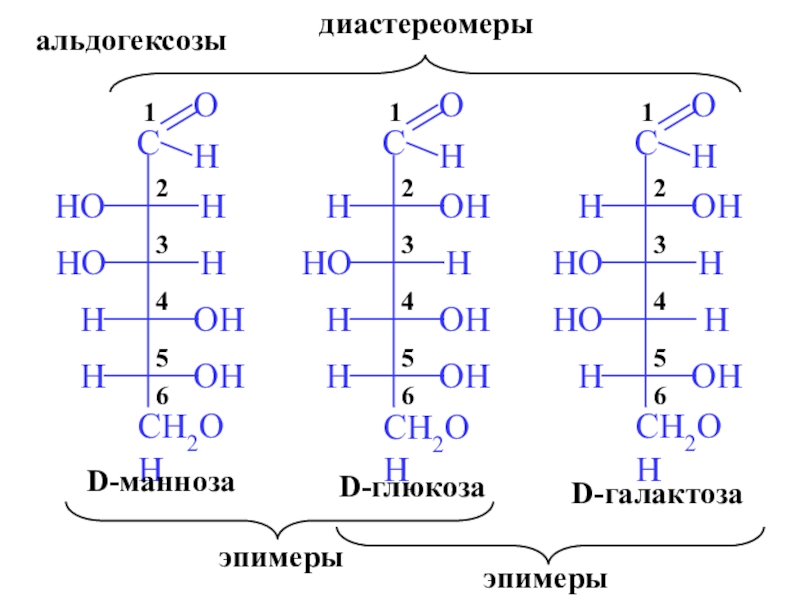
- 7. D-глюкозаD-галактозаD-маннозаэпимерыэпимерыдиастереомерыальдогексозы
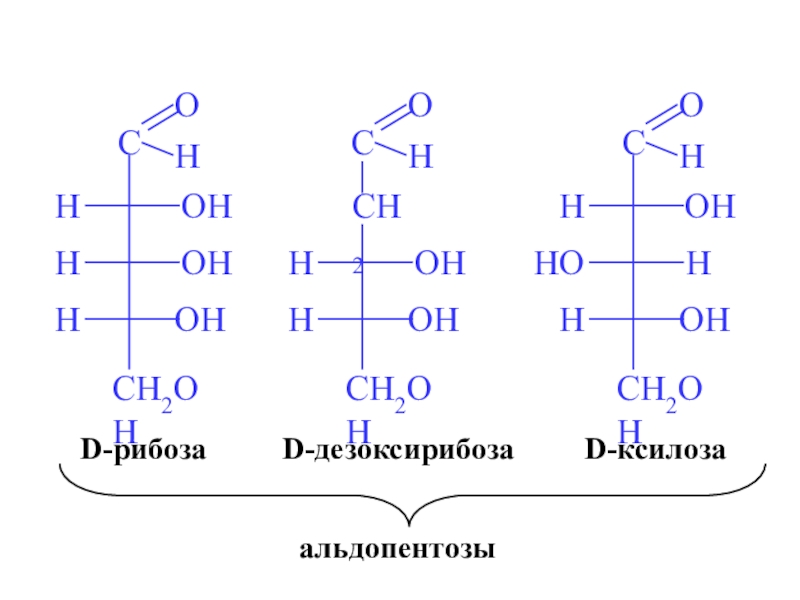
- 8. D-рибозаD-ксилозаD-дезоксирибозаальдопентозы
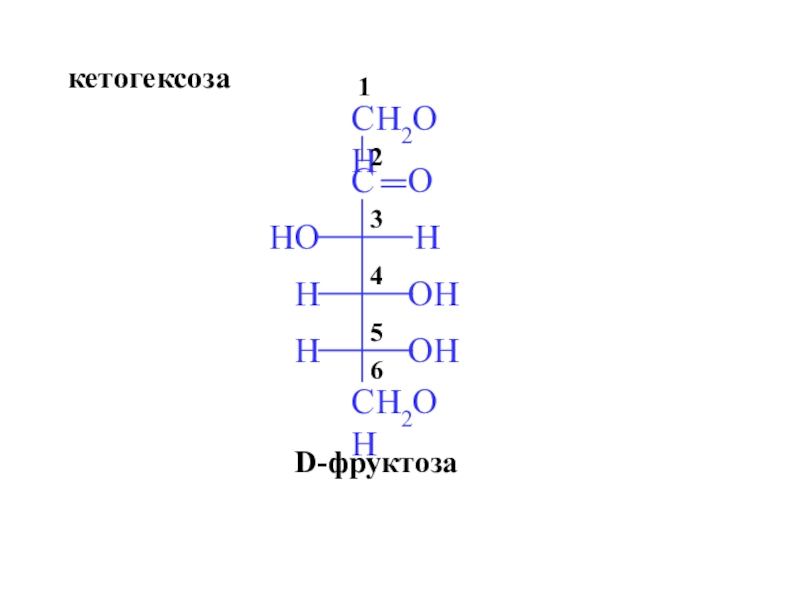
- 9. D-фруктозакетогексоза
- 10. Цикло-оксо-таутомерия моносахаридов
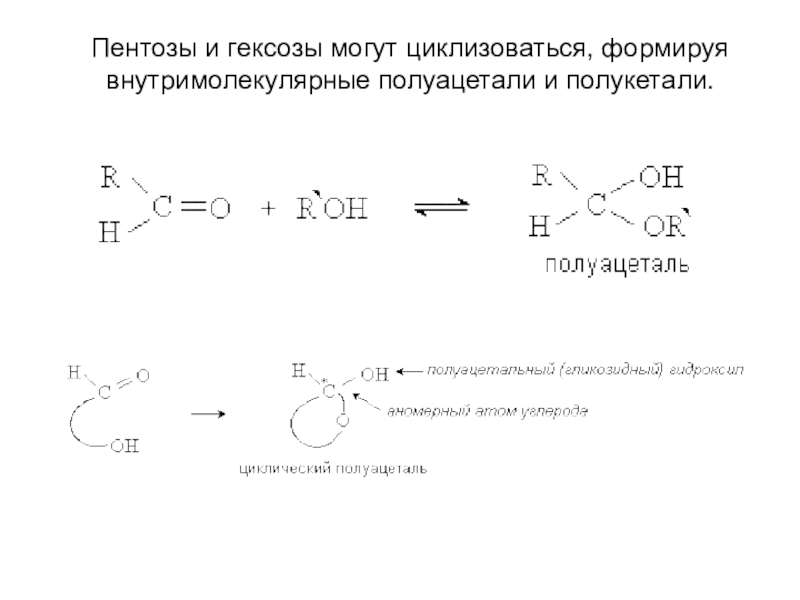
- 11. Пентозы и гексозы могут циклизоваться, формируя внутримолекулярные полуацетали и полукетали.
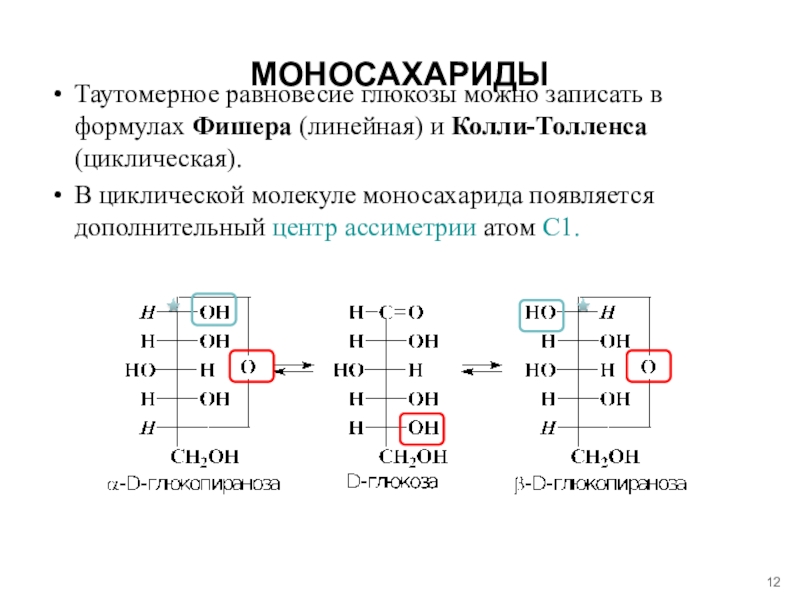
- 12. МОНОСАХАРИДЫТаутомерное равновесие глюкозы можно записать в формулах
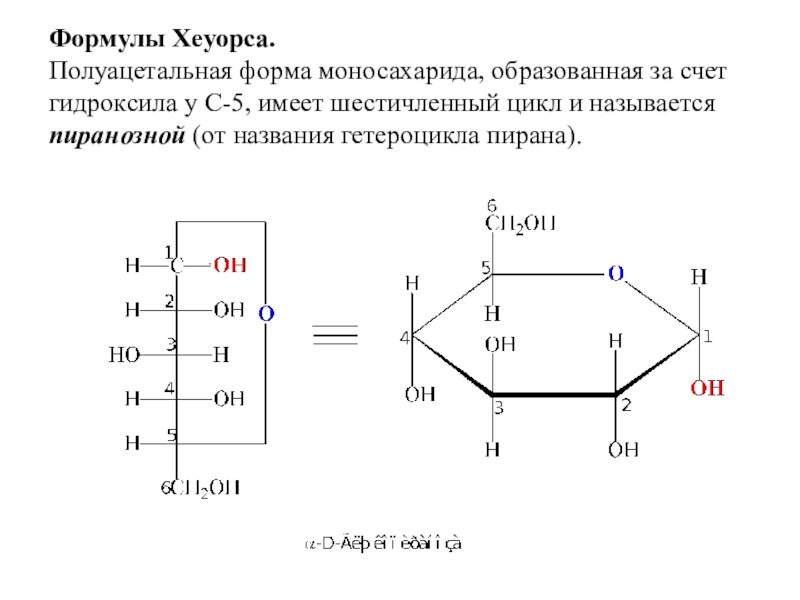
- 13. Формулы Хеуорса. Полуацетальная форма моносахарида, образованная за
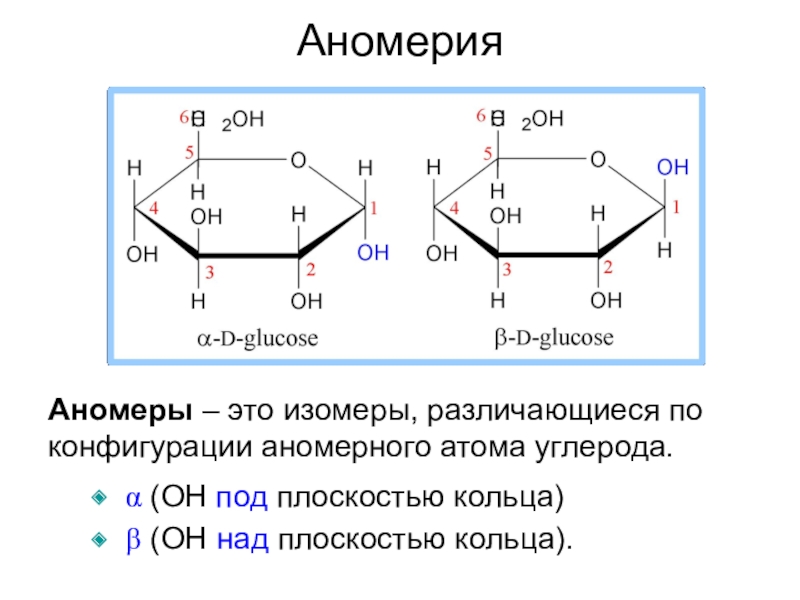
- 14. Аномеры – это изомеры, различающиеся по конфигурации
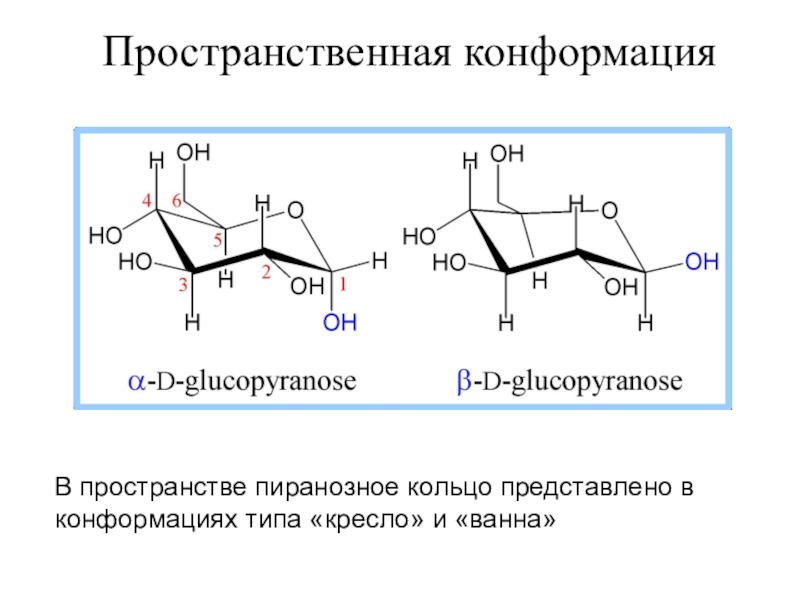
- 15. В пространстве пиранозное кольцо представлено в конформациях типа «кресло» и «ванна»Пространственная конформация
- 16. МОНОСАХАРИДЫ. Химические свойстваОсновные типы реакционной способности моносахаридов определяются наличием в их таутомерных формах:
- 17. Реакции по карбонильной группе Восстановление моносахаридов[H]D-глюкозаглюцит (сорбит)
- 18. Окисление моносахаридовСлабыми окислителями в нейтральной и слабокислой средеD-глюкозаBr2, H2O(HOBr)D-глюконовая кислота
- 19. Окисление моносахаридовСильными окислителями в сильнокислой средеHNO3D-глюкаровая кислотаD-глюкозаразбавл.
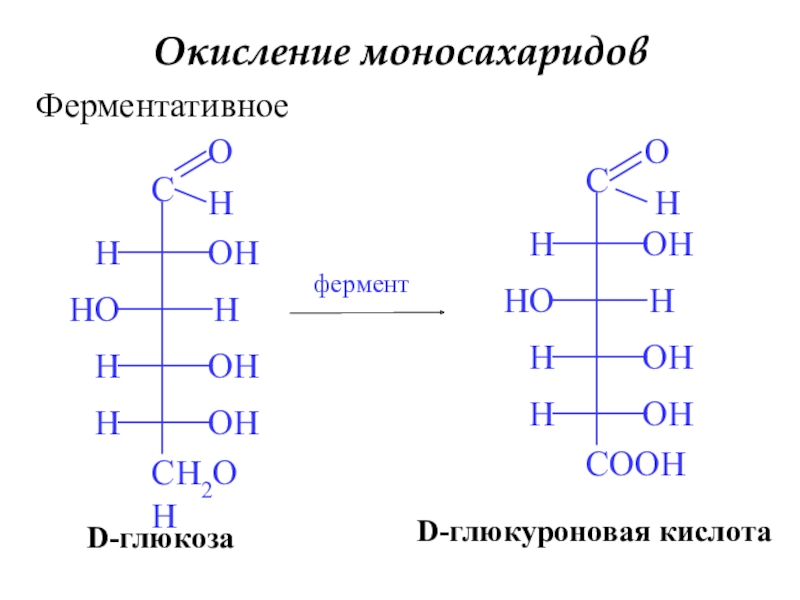
- 20. Окисление моносахаридовФерментативноеферментD-глюкуроновая кислотаD-глюкозаH
- 21. Реакции по полуацетальному гидроксилу Образование O-гликозидовβ-D-глюкопиранозаCH3OHHCl газ+O-метил-β-D-глюкопиранозидH2O
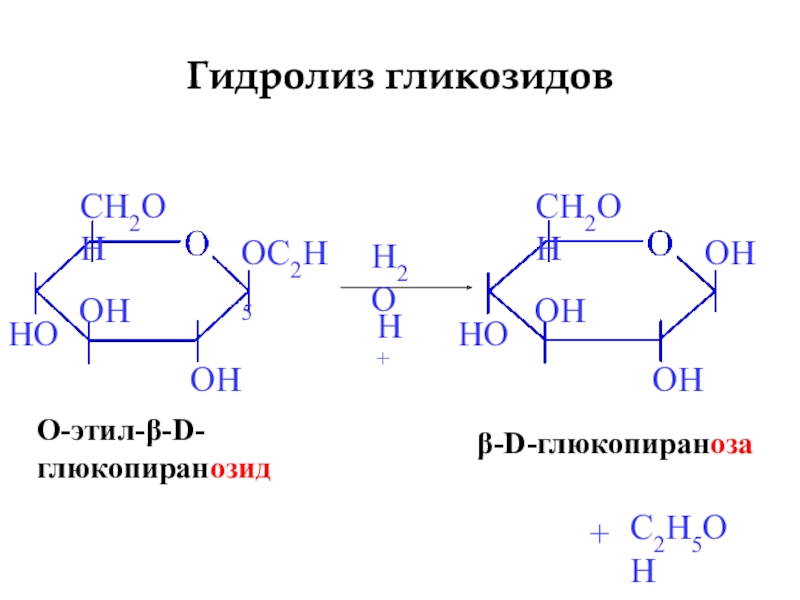
- 22. Гидролиз гликозидовβ-D-глюкопиранозаH2OH++O-этил-β-D-глюкопиранозидC2H5OH
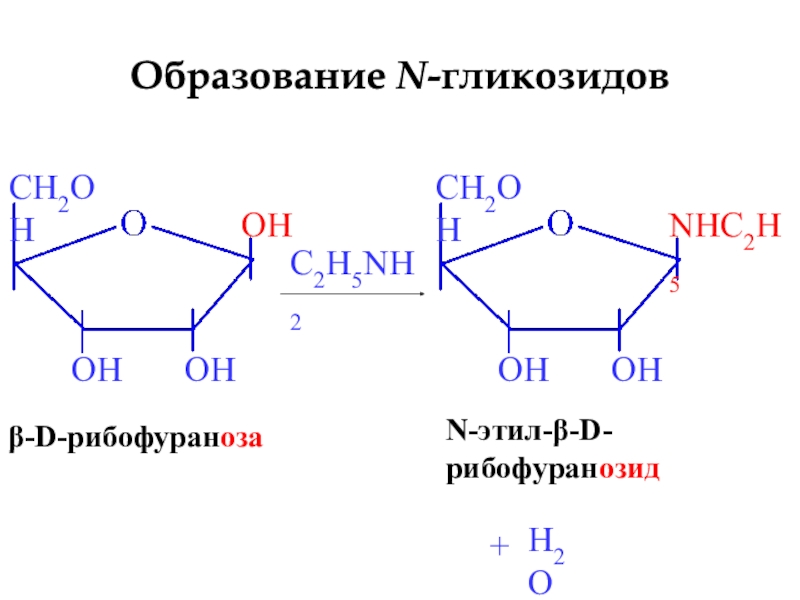
- 23. β-D-рибофуранозаC2H5NH2N-этил-β-D-рибофуранозид+H2OОбразование N-гликозидов
- 24. Реакции по спиртовым гидроксиламАцилирование обычно проводится ангидридами
- 25. Реакции по спиртовым гидроксиламАлкилирование углеводов проводят алкилгалогенидами или диалкилсульфатами:2,3,4,6-тетра-О-метил-β-D-глюкопираноза Метил-2,3,4,6-тетра-О-метил-β-D-глюкопиранозид
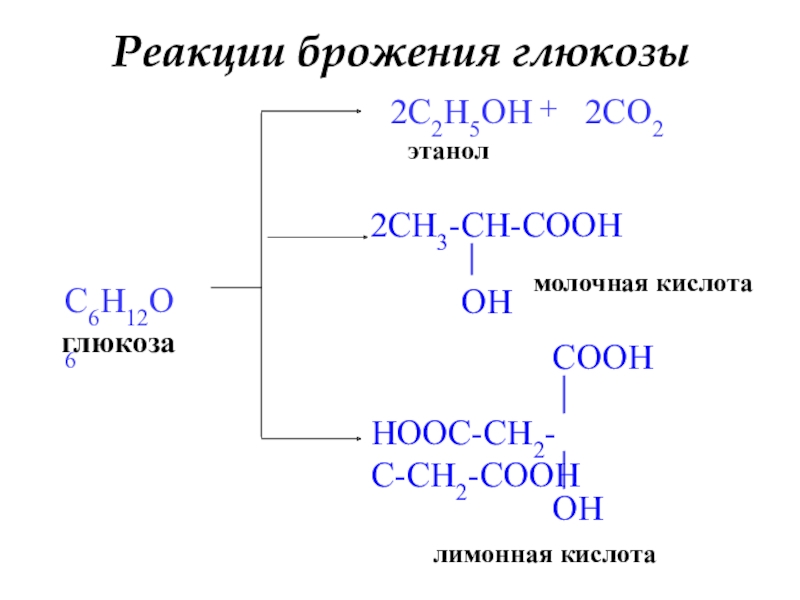
- 26. Реакции брожения глюкозыглюкозаC6H12O62C2H5OHэтанол+2CO2молочная кислоталимонная кислота
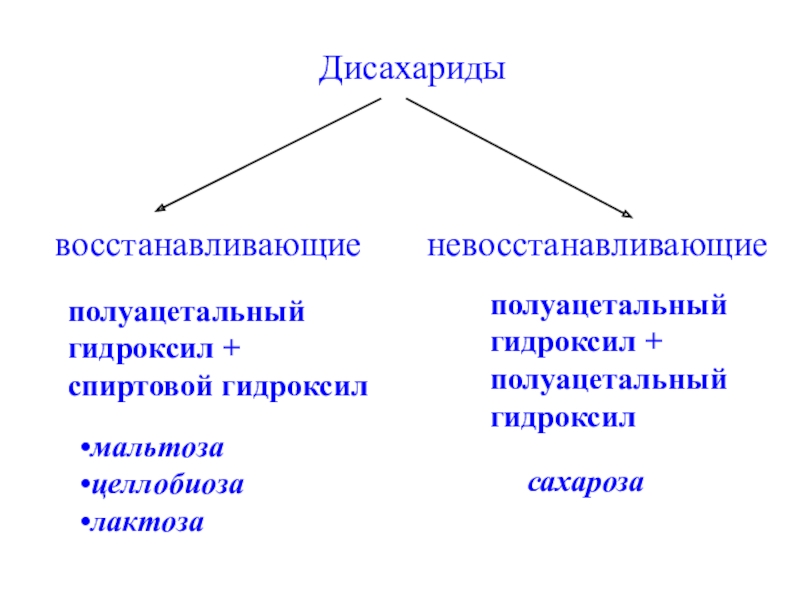
- 27. Дисахаридывосстанавливающиеневосстанавливающиеполуацетальный гидроксил +спиртовой гидроксилполуацетальный гидроксил +полуацетальныйгидроксилмальтозацеллобиозалактозасахароза
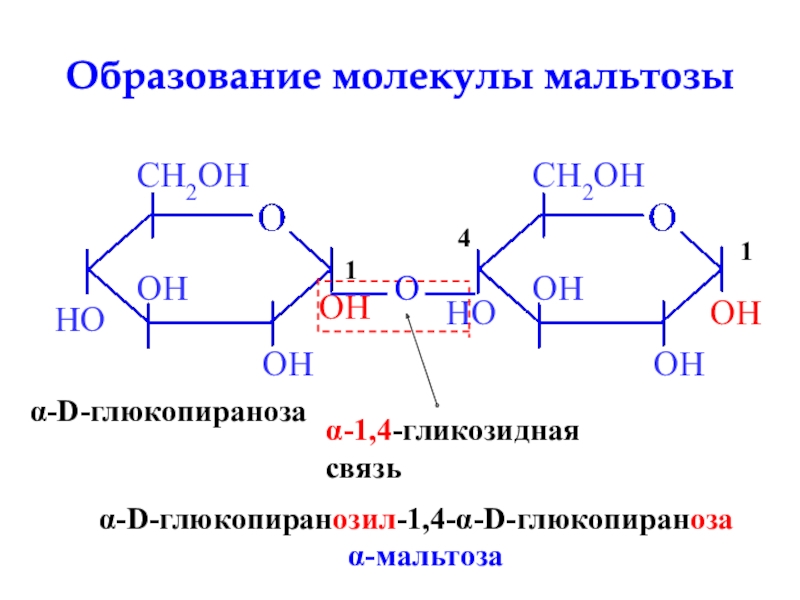
- 28. Образование молекулы мальтозыOHα-D-глюкопиранозаHOOHOα-1,4-гликозиднаясвязьα-D-глюкопиранозил-1,4-α-D-глюкопираноза
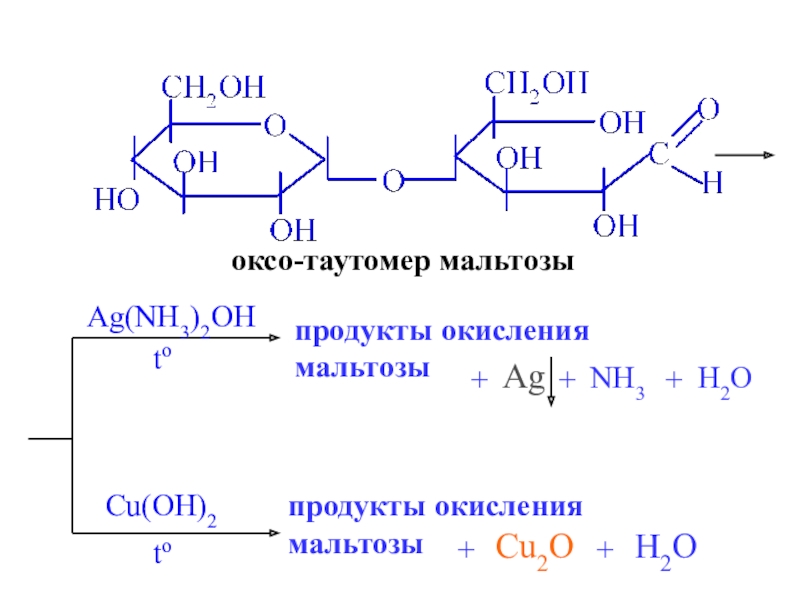
- 29. оксо-таутомер мальтозыAg(NH3)2OHпродукты окислениямальтозыAg+NH3+H2Oto+Cu(OH)2toпродукты окислениямальтозы+Cu2O+H2O
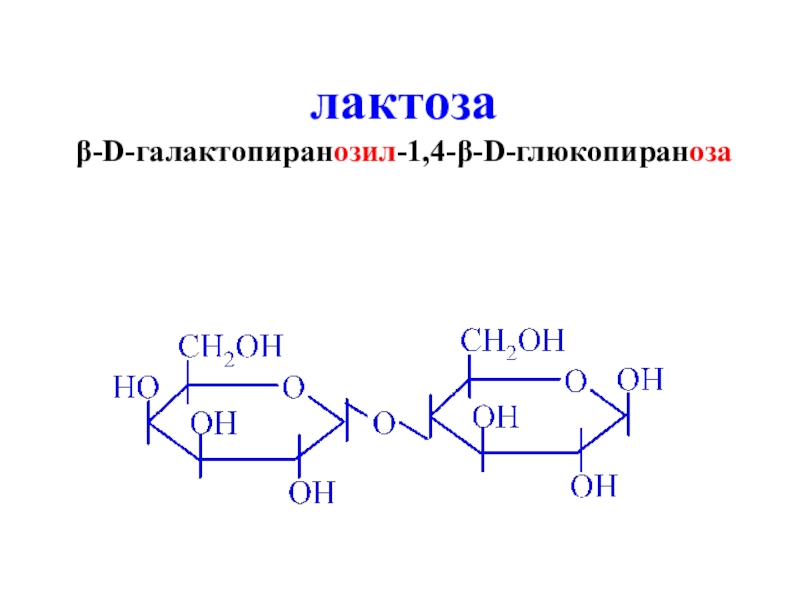
- 30. лактозаβ-D-галактопиранозил-1,4-β-D-глюкопираноза
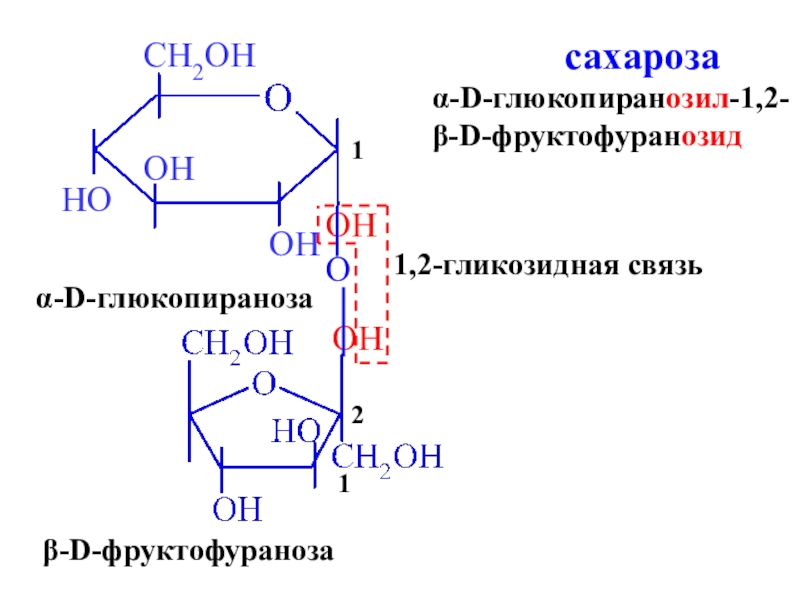
- 31. OHOHα-D-глюкопираноза β-D-фруктофураноза 12O1,2-гликозидная связь сахарозаα-D-глюкопиранозил-1,2-β-D-фруктофуранозид
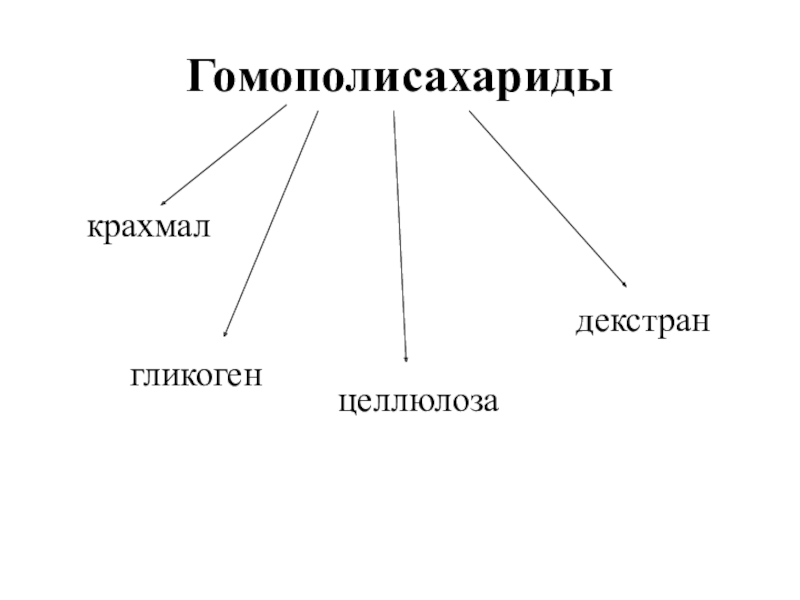
- 32. Гомополисахаридыкрахмалцеллюлозагликогендекстран
- 33. Крахмал – гомополимер α-D-глюкозы. Находится в злаках,
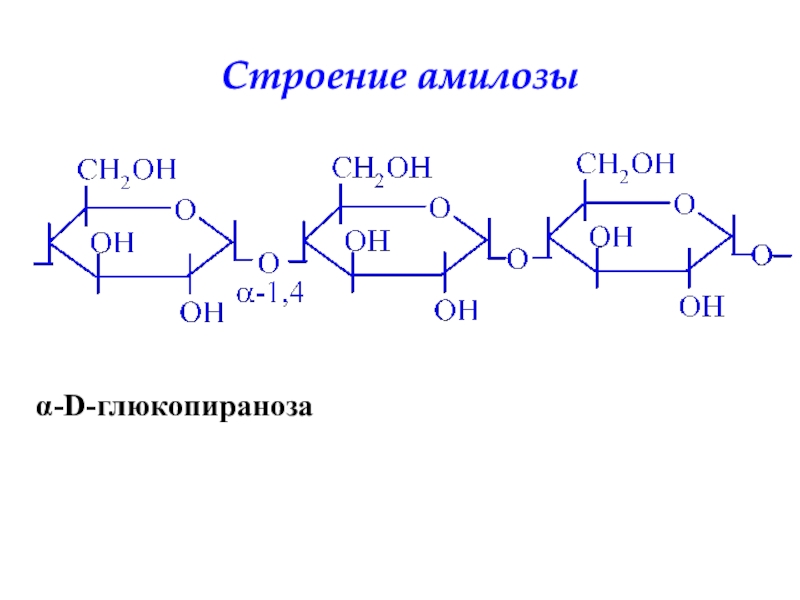
- 34. Строение амилозыα-D-глюкопираноза
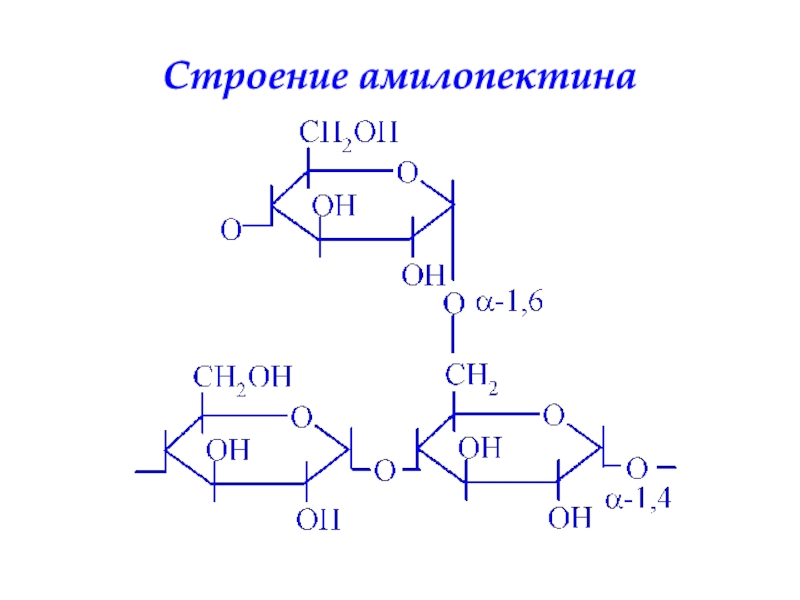
- 35. Строение амилопектина
- 36. Гликоген – резервный полисахарид животных тканей, в
- 37. Целлюлоза является наиболее распространенным органическим соединением биосферы.
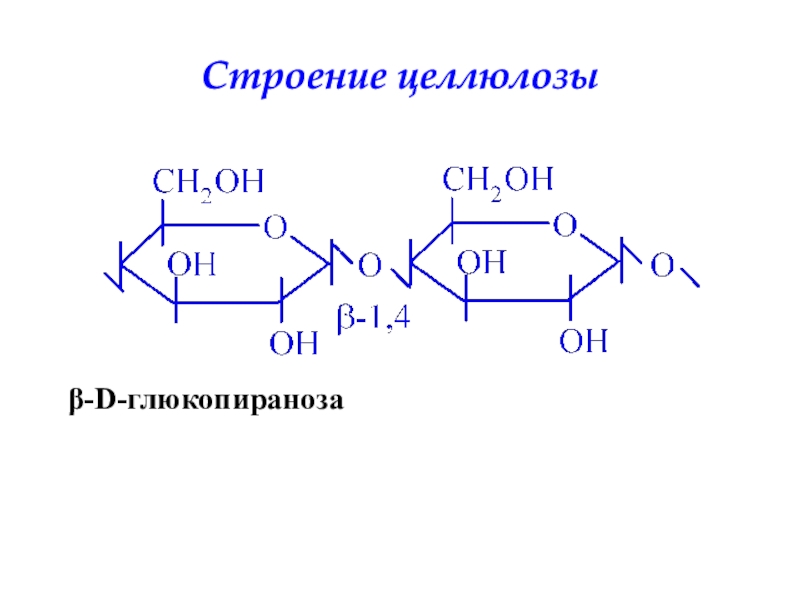
- 38. Строение целлюлозыβ-D-глюкопираноза
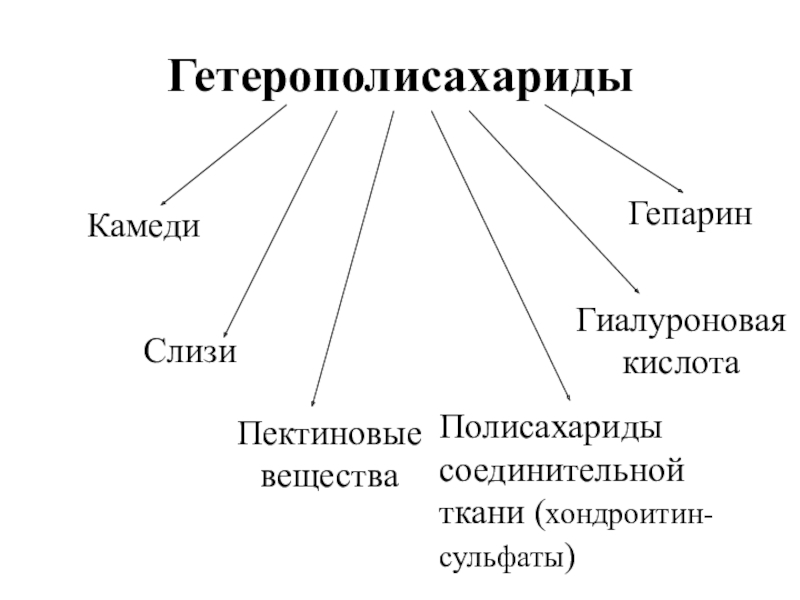
- 39. ГетерополисахаридыКамедиСлизиПектиновые веществаПолисахариды соединительной ткани (хондроитин-сульфаты)Гиалуроновая кислотаГепарин
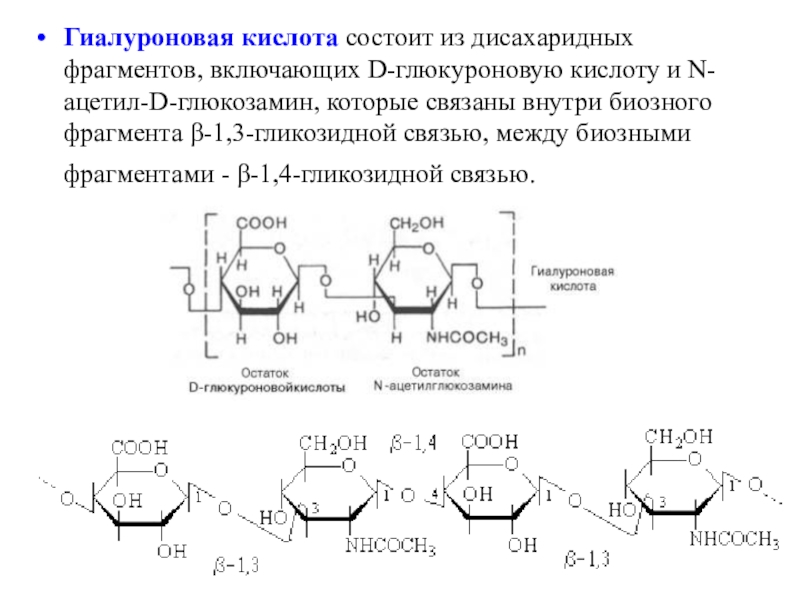
- 40. Гиалуроновая кислота состоит из дисахаридных фрагментов, включающих
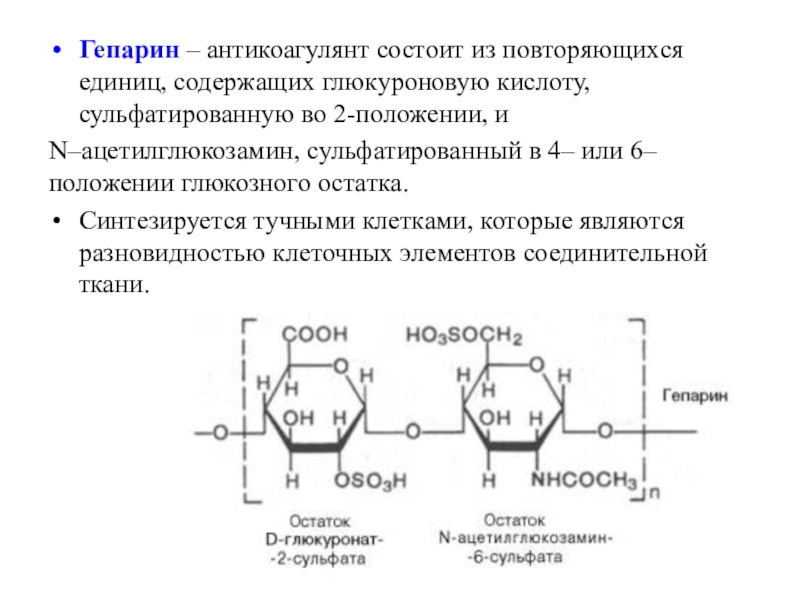
- 41. Гепарин – антикоагулянт состоит из повторяющихся единиц,
- 42. Скачать презентанцию
Углеводы – это многоатомные альдегидо- или кетоспирты (полиоксикарбонильные соединения) и их производные с общей формулой Сn(H2O)m.Биологическая роль: 1 - энергетический материал для жизнедеятельности человека; составляют 55-65% пищи; 2 - структурная функция
Слайды и текст этой презентации
Слайд 1МОНОСАХАРИДЫ.
ДИ- и ПОЛИСАХАРИДЫ.
Лекция № 6
Федеральное государственное бюджетное образовательное
учреждение высшего
образования
химии Слайд 2 Углеводы – это многоатомные альдегидо- или кетоспирты (полиоксикарбонильные соединения) и
их производные с общей формулой Сn(H2O)m.
Биологическая роль:
1 - энергетический
материал для жизнедеятельности человека; составляют 55-65% пищи; 2 - структурная функция – входят в состав гликопротеинов, нуклеиновых кислот, являются компонентами биомембран клетки;
3 - запасная, резервная функция: гликоген – запасной углевод организма; при необходимости способен превращаться в жиры и откладываться;
4 - иммунологические свойства - входят в состав антител (γ-глобулинов крови);
5 - некоторые проявляют биологическую активность: гепарин (антикоагулянт крови), сердечные гликозиды (лечебные препараты), мукополисахариды (связывают воду и ионы).
Слайд 3Углеводы
Моносахариды
Полисахариды
Олигосахариды
Гомополисахариды
дисахариды
трисахариды
тетрасахариды
и т.д. (до n=10)
Гетерополисахариды
Слайд 4Моносахариды – это простые углеводы, которые в растворе не гидролизируют.
Классификация.
1.
По количеству атомов С на:
а) триозы (С3)
б) тетрозы (С4)
в) пентозы (С5) (рибоза, дезоксирибоза, ксилоза)
г) гексозы (С6) (глюкоза, галактоза, манноза, фруктоза)
2. По главной функциональной группе:
а) альдозы (глюкоза, галактоза, манноза, рибоза, ксилоза)
б) кетозы (фруктоза)
Слайд 5СТЕРЕОИЗОМЕРИЯ.
D-L формы сахаров. Оптическая изомерия.
D или L форма определяется исходя
из расположения OH-группы относительно хирального атома С*.
Слайд 6Для сахаров с несколькими хиральными атомами С, D
или L форма определяется по наиболее дальнему атому С от
альдо- или кето-группы.Большинство природных моносахаридов являются D -изомерами.
Слайд 11Пентозы и гексозы могут циклизоваться, формируя внутримолекулярные полуацетали и полукетали.
Слайд 12МОНОСАХАРИДЫ
Таутомерное равновесие глюкозы можно записать в формулах Фишера (линейная) и
Колли-Толленса (циклическая).
В циклической молекуле моносахарида появляется дополнительный центр ассиметрии атом
C1.Слайд 13Формулы Хеуорса. Полуацетальная форма моносахарида, образованная за счет гидроксила у С-5,
имеет шестичленный цикл и называется пиранозной (от названия гетероцикла пирана).
Слайд 14Аномеры – это изомеры, различающиеся по конфигурации аномерного атома углерода.
a (OH под плоскостью кольца)
b (OH над плоскостью
кольца).Аномерия
Слайд 15
В пространстве пиранозное кольцо представлено в конформациях типа «кресло» и
«ванна»
Пространственная конформация
Слайд 16МОНОСАХАРИДЫ. Химические свойства
Основные типы реакционной способности моносахаридов определяются наличием в
их таутомерных формах:
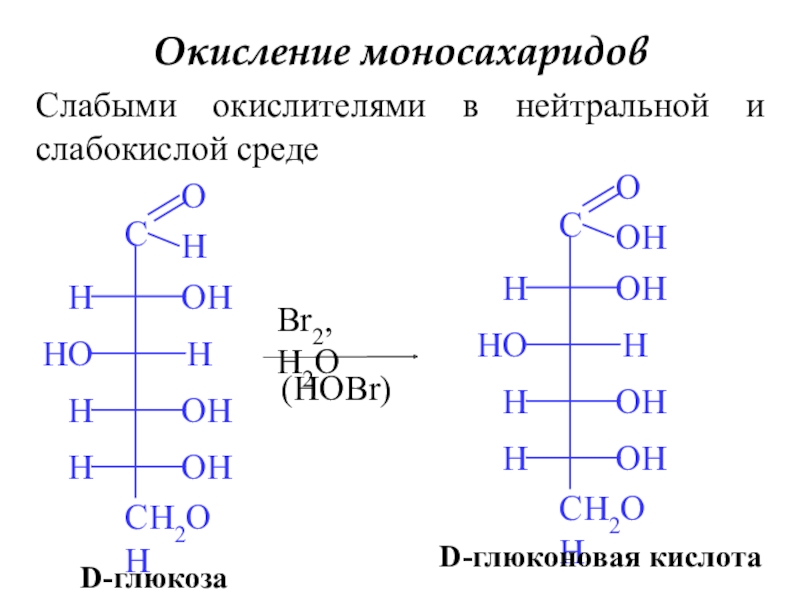
Слайд 18Окисление моносахаридов
Слабыми окислителями в нейтральной и слабокислой среде
D-глюкоза
Br2, H2O
(HOBr)
D-глюконовая кислота
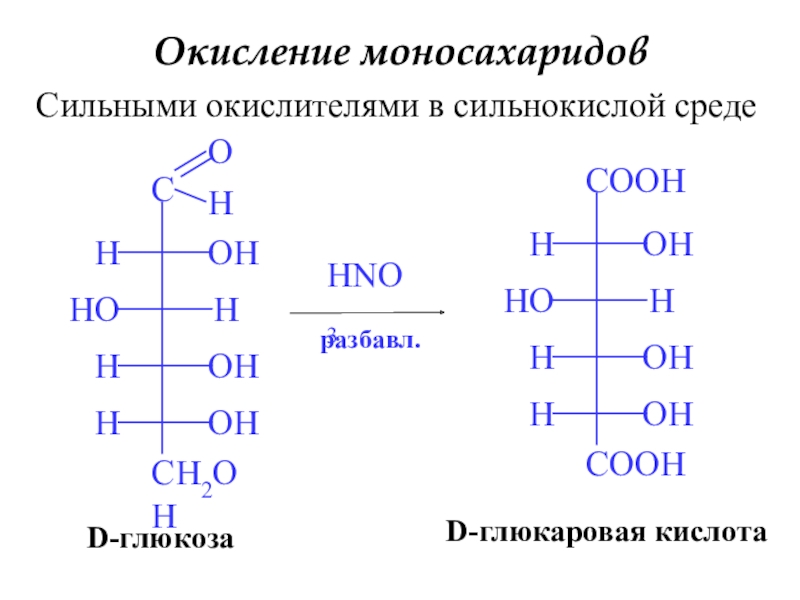
Слайд 19Окисление моносахаридов
Сильными окислителями в сильнокислой среде
HNO3
D-глюкаровая кислота
D-глюкоза
разбавл.
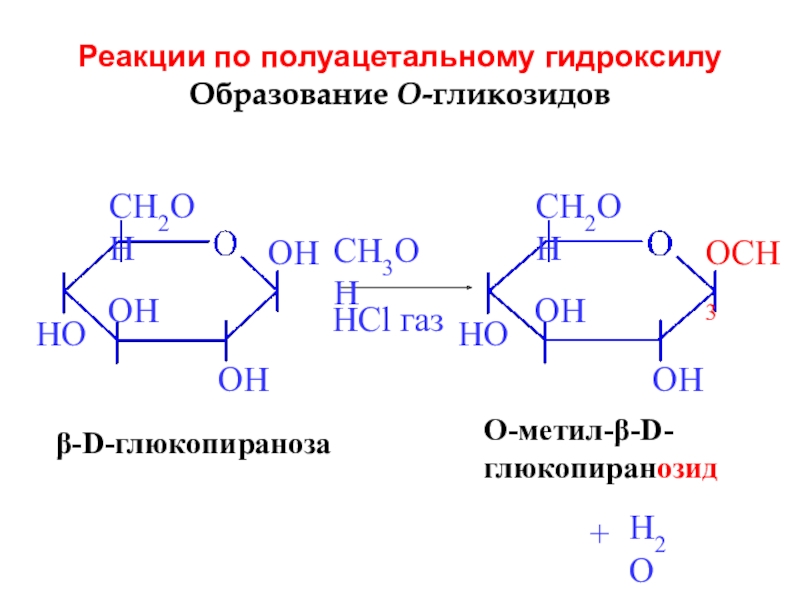
Слайд 21Реакции по полуацетальному гидроксилу
Образование O-гликозидов
β-D-глюкопираноза
CH3OH
HCl газ
+
O-метил-β-D-
глюкопиранозид
H2O
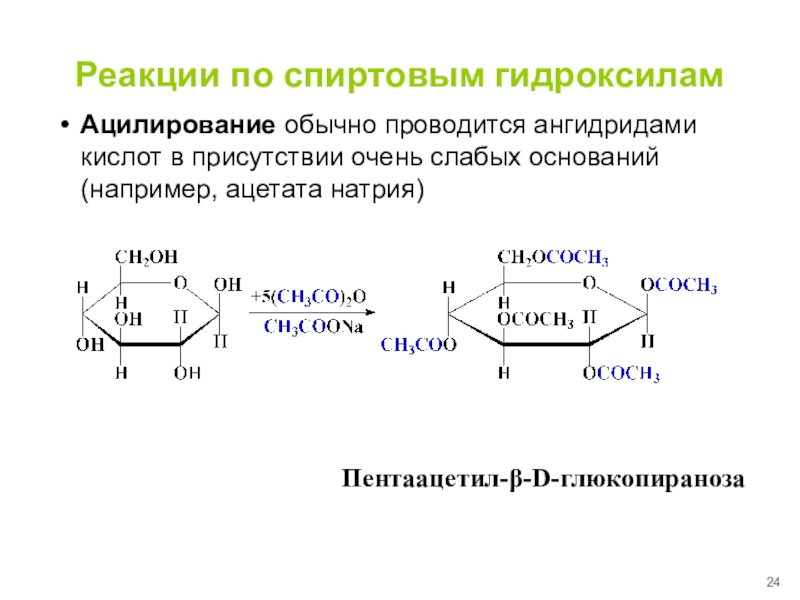
Слайд 24Реакции по спиртовым гидроксилам
Ацилирование обычно проводится ангидридами кислот в присутствии
очень слабых оснований (например, ацетата натрия)
Пентаацетил-β-D-глюкопираноза
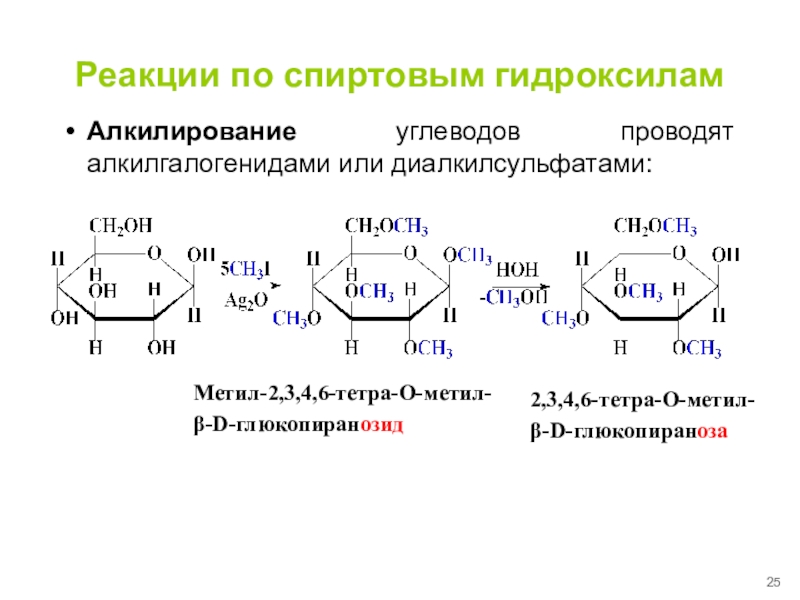
Слайд 25Реакции по спиртовым гидроксилам
Алкилирование углеводов проводят алкилгалогенидами или диалкилсульфатами:
2,3,4,6-тетра-О-метил-
β-D-глюкопираноза
Метил-2,3,4,6-тетра-О-метил-
β-D-глюкопиранозид
Слайд 27Дисахариды
восстанавливающие
невосстанавливающие
полуацетальный
гидроксил +
спиртовой гидроксил
полуацетальный
гидроксил +
полуацетальный
гидроксил
мальтоза
целлобиоза
лактоза
сахароза
Слайд 28Образование молекулы мальтозы
OH
α-D-глюкопираноза
HO
OH
O
α-1,4-гликозидная
связь
α-D-глюкопиранозил-1,4-α-D-глюкопираноза
α-мальтоза
Слайд 29оксо-таутомер мальтозы
Ag(NH3)2OH
продукты окисления
мальтозы
Ag
+
NH3
+
H2O
to
+
Cu(OH)2
to
продукты окисления
мальтозы
+
Cu2O
+
H2O
Слайд 31OH
OH
α-D-глюкопираноза
β-D-фруктофураноза
1
2
O
1,2-гликозидная связь
сахароза
α-D-глюкопиранозил-1,2-
β-D-фруктофуранозид
Слайд 33Крахмал – гомополимер α-D-глюкозы.
Находится в злаках, бобовых, картофеле
и
некоторых других овощах.
Синтезировать крахмал способны почти все растения.
Фракции крахмала:
амилоза
(15-20%)амилопектин (80-85%)
(C6H10O5)n
Слайд 36Гликоген – резервный полисахарид животных тканей, в наибольшей мере содержится
в печени и мышцах. Структурно он схож с амилопектином, но
длина цепочек меньше – 11-18 остатков глюкозы, во-вторых, более разветвлен – через каждые 8-10 остатков. За счет этих особенностей гликоген более компактно уложен, что немаловажно для животной клетки.Слайд 37Целлюлоза является наиболее распространенным органическим соединением биосферы. Около половины всего
углерода Земли находится в ее составе. В отличие от предыдущих
полисахаридов она является внеклеточной молекулой, имеет волокнистую структуру и абсолютно нерастворима в воде. Единственной связью в ней является β-1,4-гликозидная связь.Слайд 39Гетерополисахариды
Камеди
Слизи
Пектиновые
вещества
Полисахариды
соединительной
ткани (хондроитин-
сульфаты)
Гиалуроновая
кислота
Гепарин
Слайд 40Гиалуроновая кислота состоит из дисахаридных фрагментов, включающих D-глюкуроновую кислоту и
N-ацетил-D-глюкозамин, которые связаны внутри биозного фрагмента β-1,3-гликозидной связью, между биозными
фрагментами - β-1,4-гликозидной связью.Слайд 41Гепарин – антикоагулянт состоит из повторяющихся единиц, содержащих глюкуроновую кислоту,
сульфатированную во 2-положении, и
N–ацетилглюкозамин, сульфатированный в 4– или 6–
положении глюкозного остатка.Синтезируется тучными клетками, которые являются разновидностью клеточных элементов соединительной ткани.





![МОНОСАХАРИДЫ. ДИ- и ПОЛИСАХАРИДЫ Реакции по карбонильной группе Восстановление моносахаридов[H]D-глюкозаглюцит (сорбит) Реакции по карбонильной группе Восстановление моносахаридов[H]D-глюкозаглюцит (сорбит)](/img/tmb/6/593099/0115f94baa7bb2768e882219009a3ec7-800x.jpg)