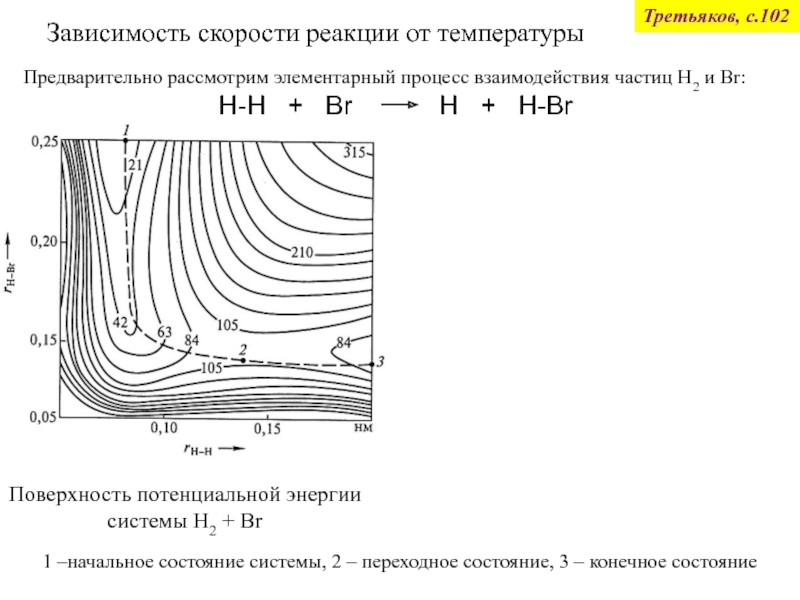
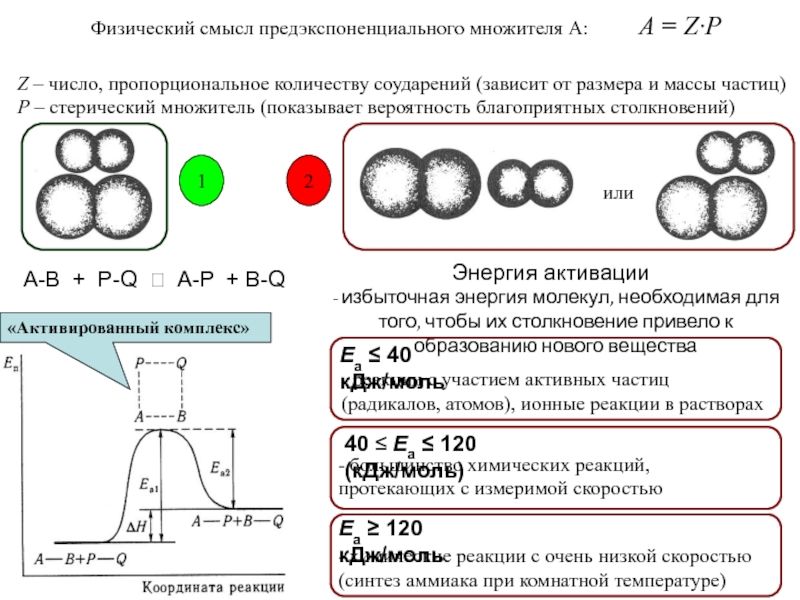
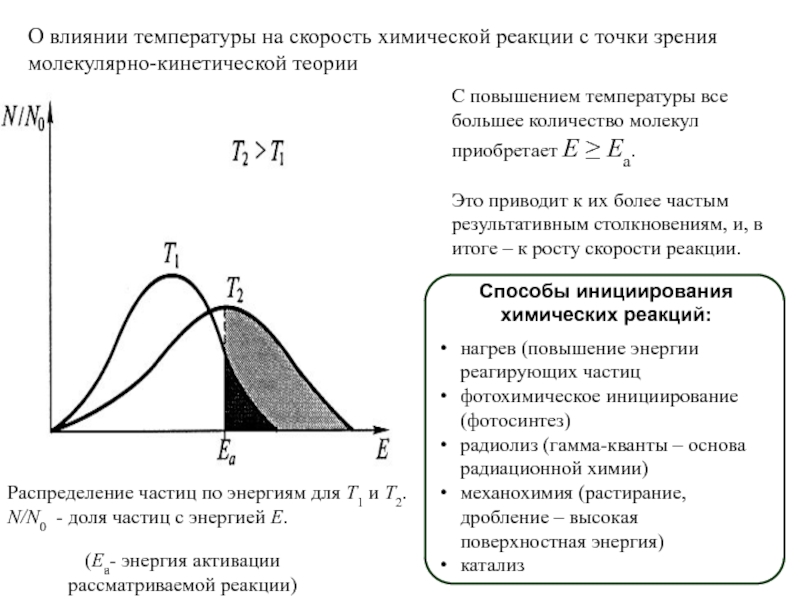
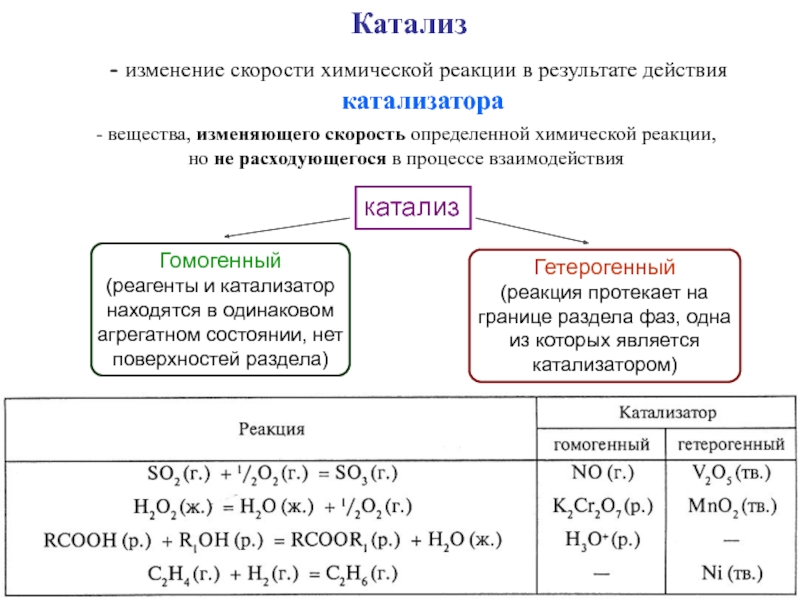
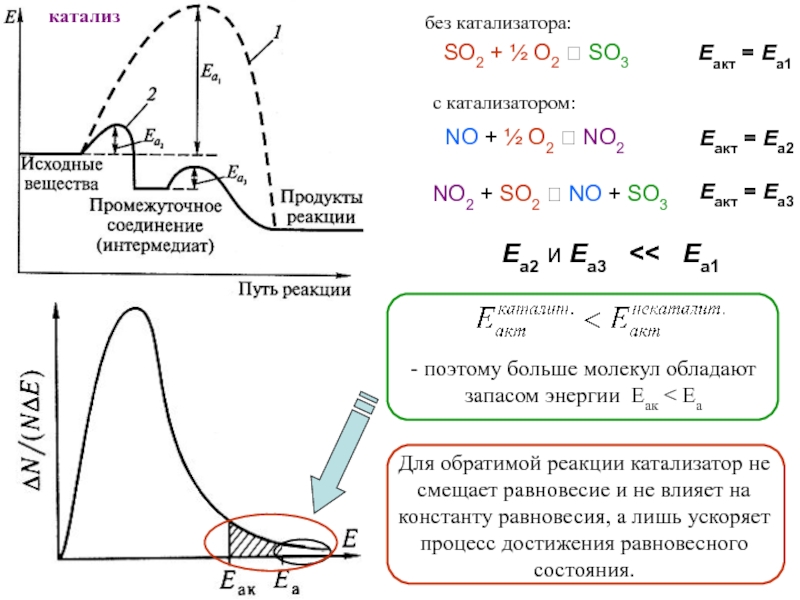
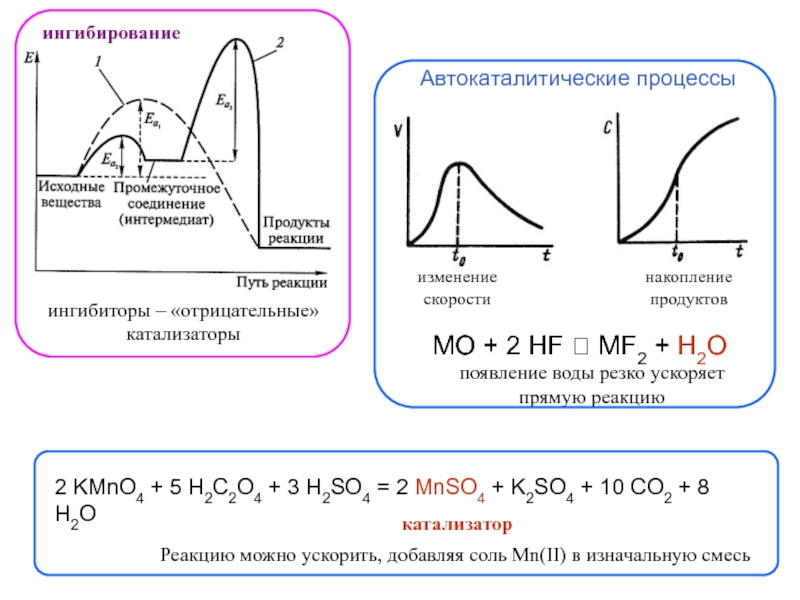
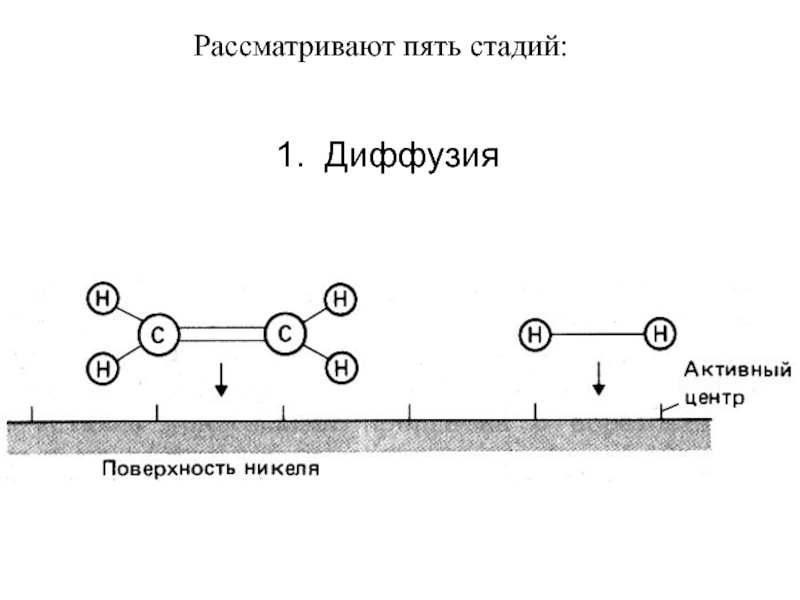
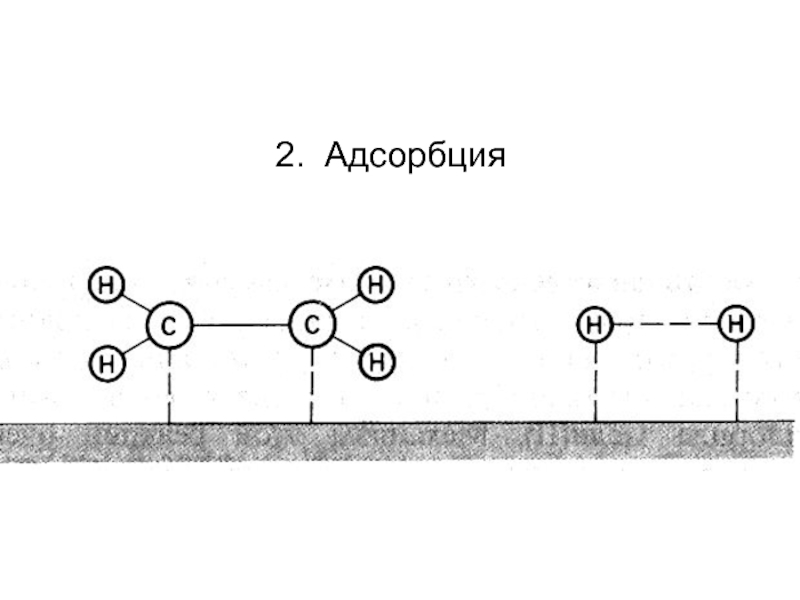
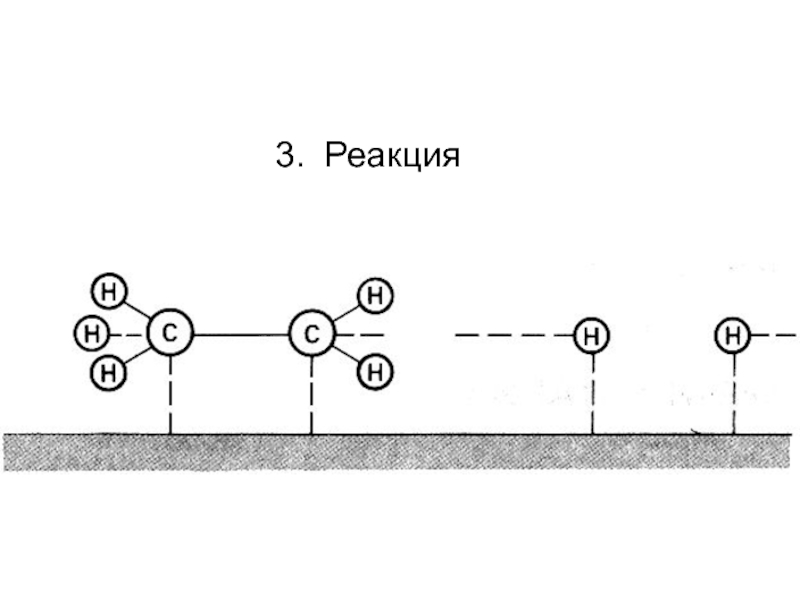
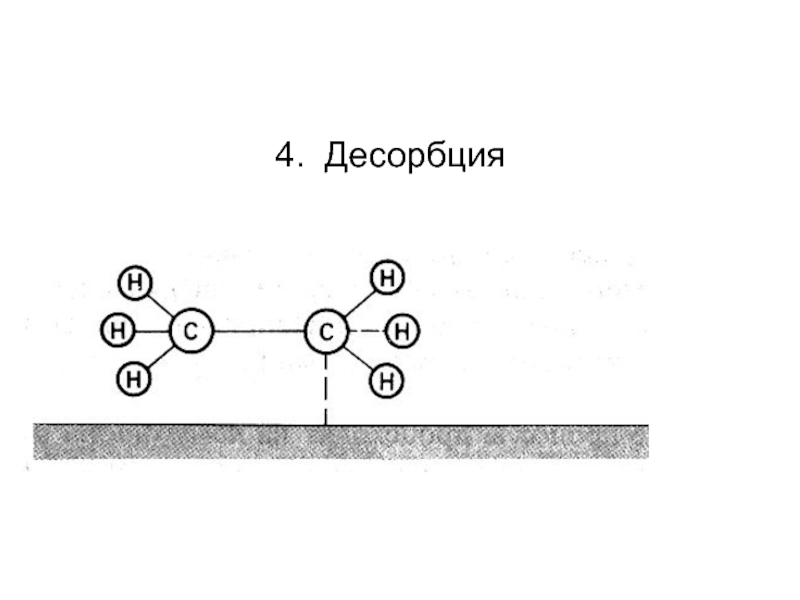
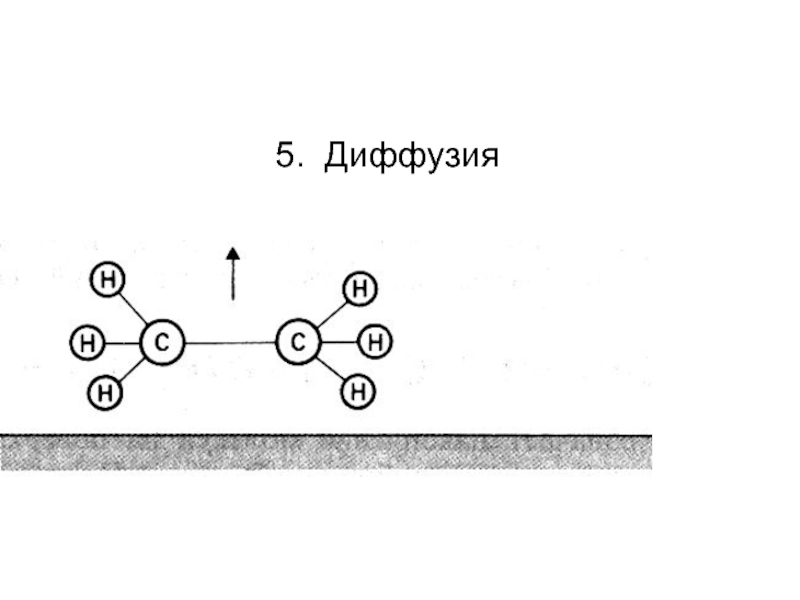
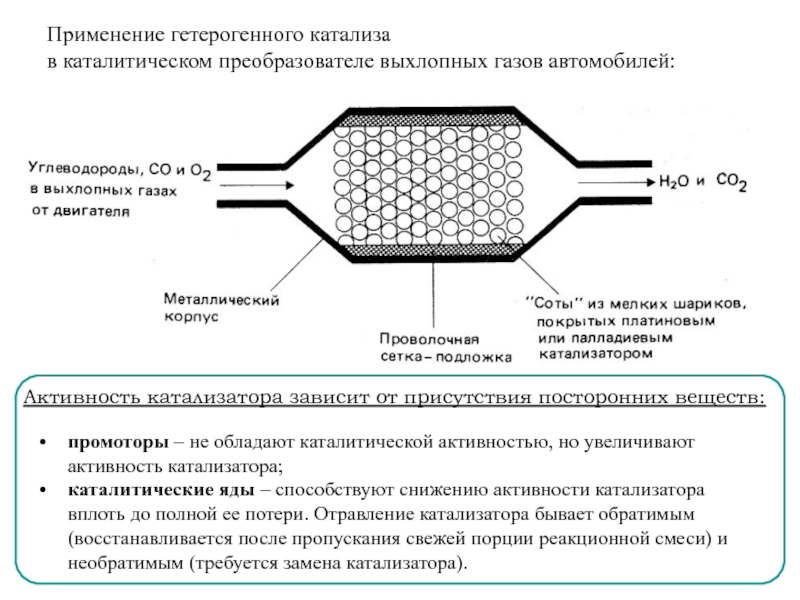
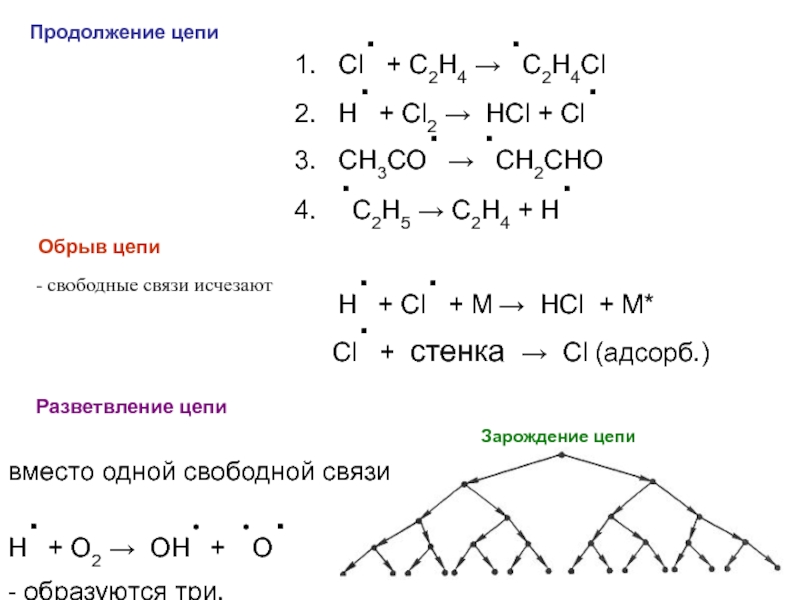
фазовых превращений,
направление протекания процессов в физико-химических системах,
химические и
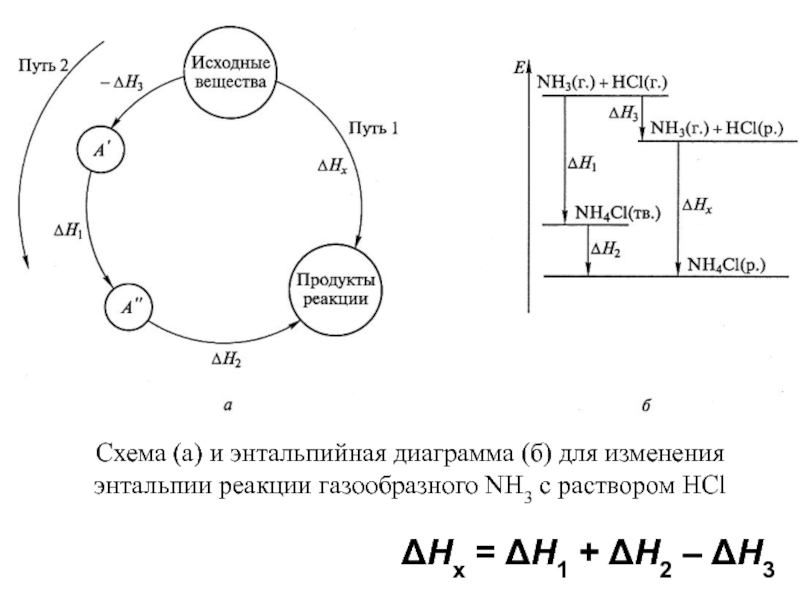
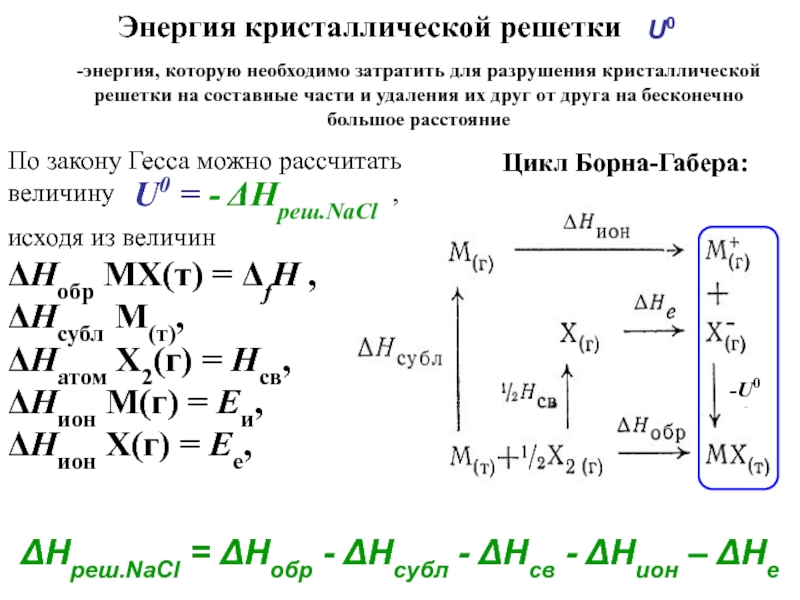
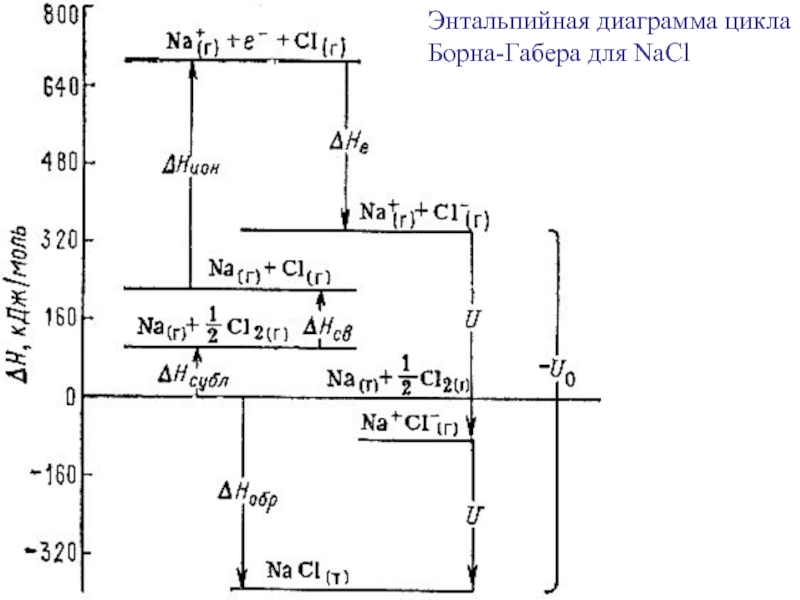
фазовые равновесияВозможность протекания процесса – термодинамика
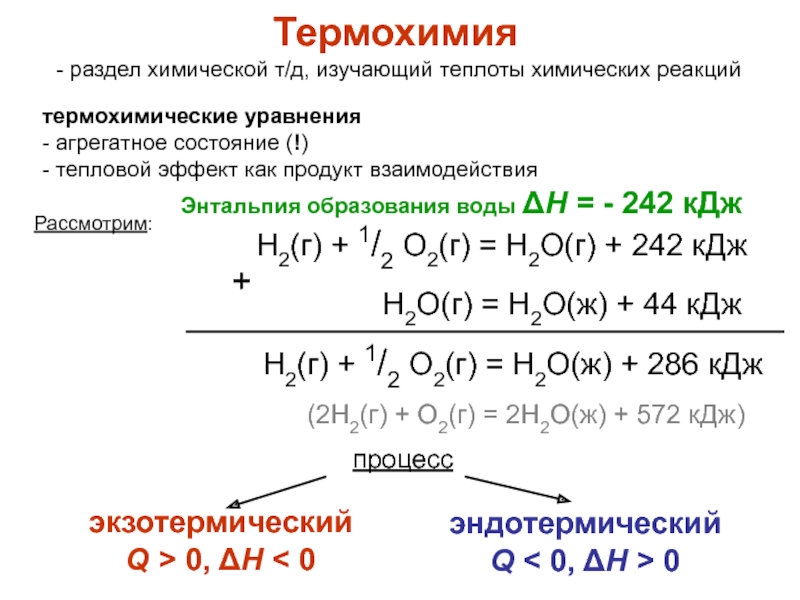
2Н2 + О2 = 2Н2О
По т/д расчетам – возможна при любых Т (ниже 5000К) и давлении, близком к атмосферному
В реальности смесь газов не взаимодействует, пока нет Кт (Pt)
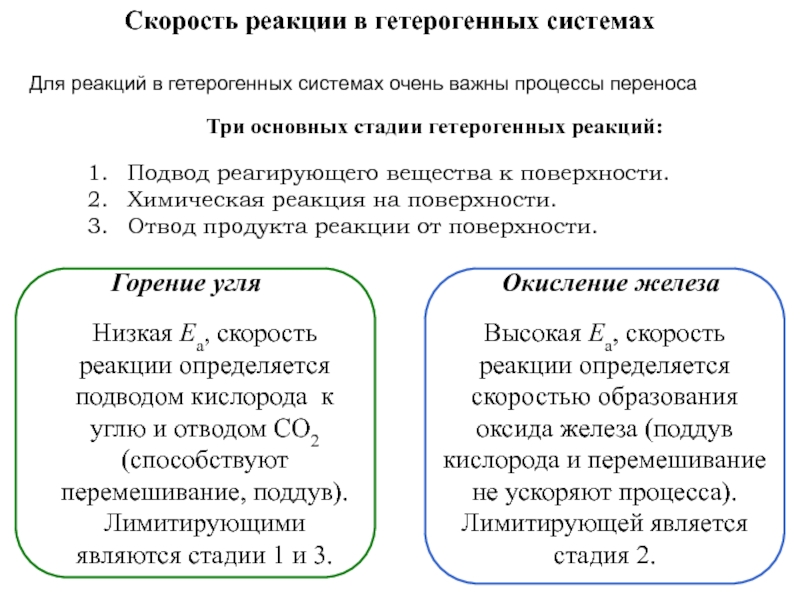
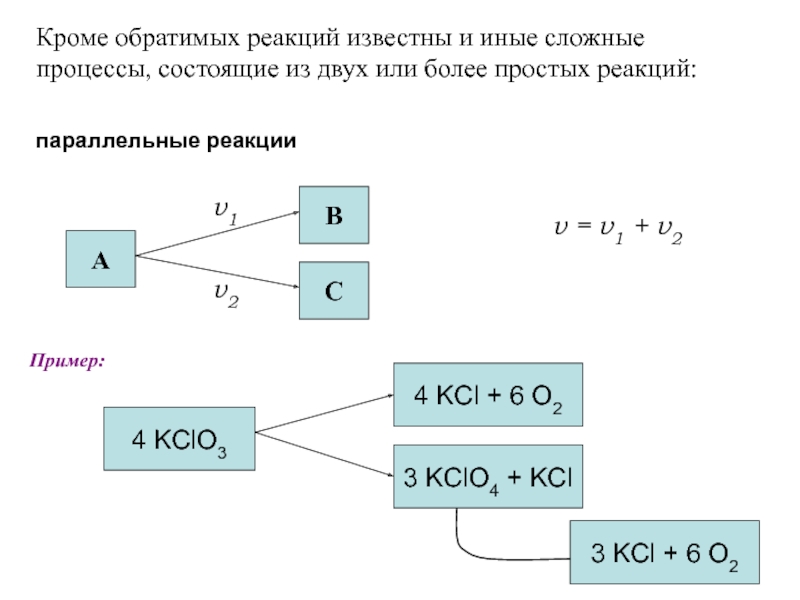
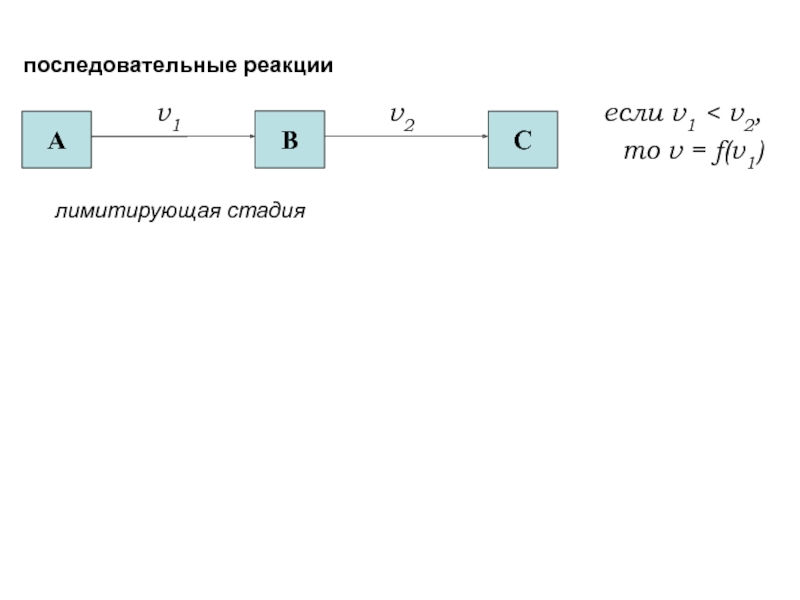
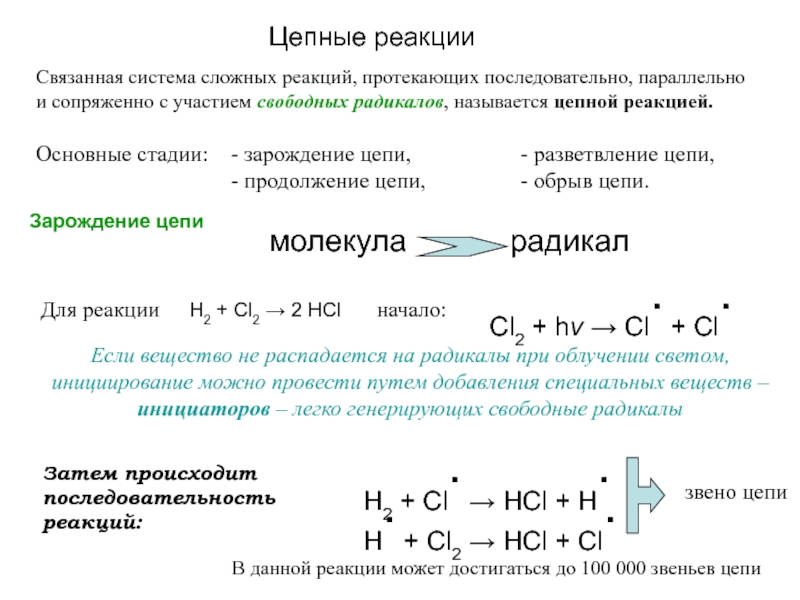
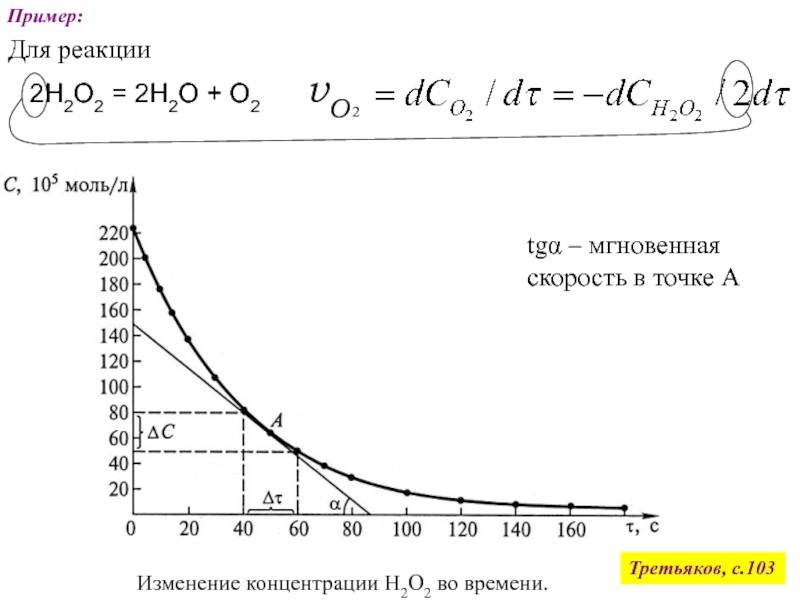
Скорость протекания процесса - кинетика

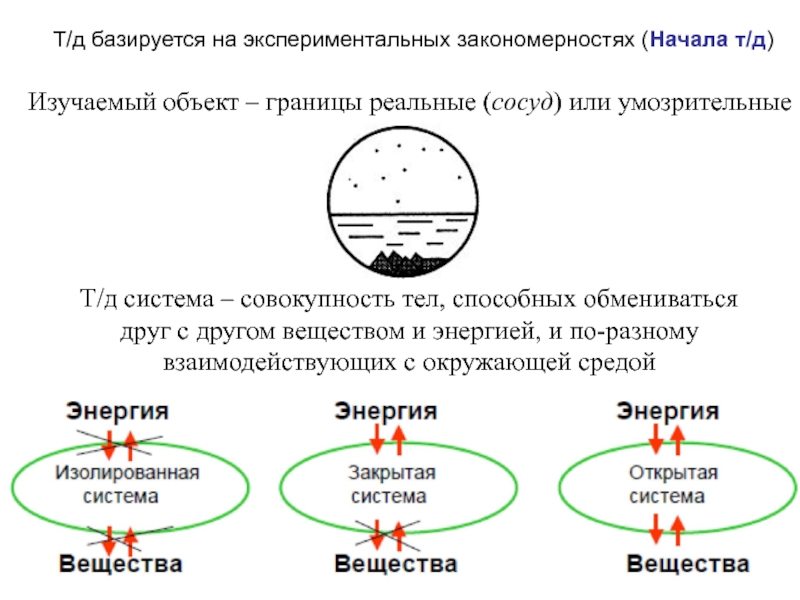
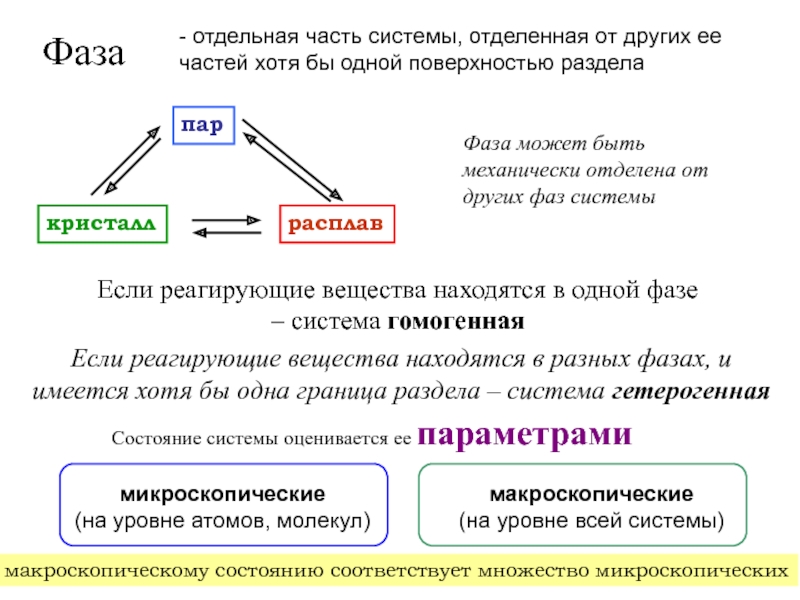
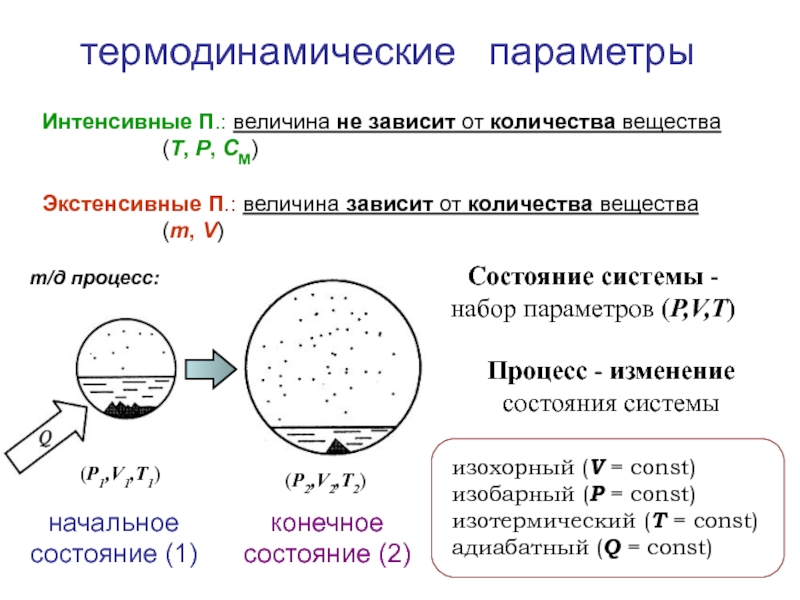
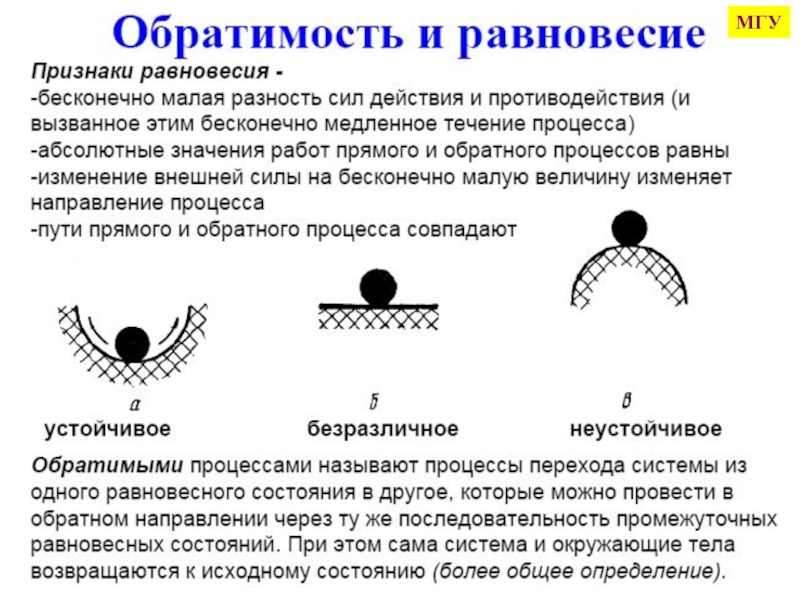


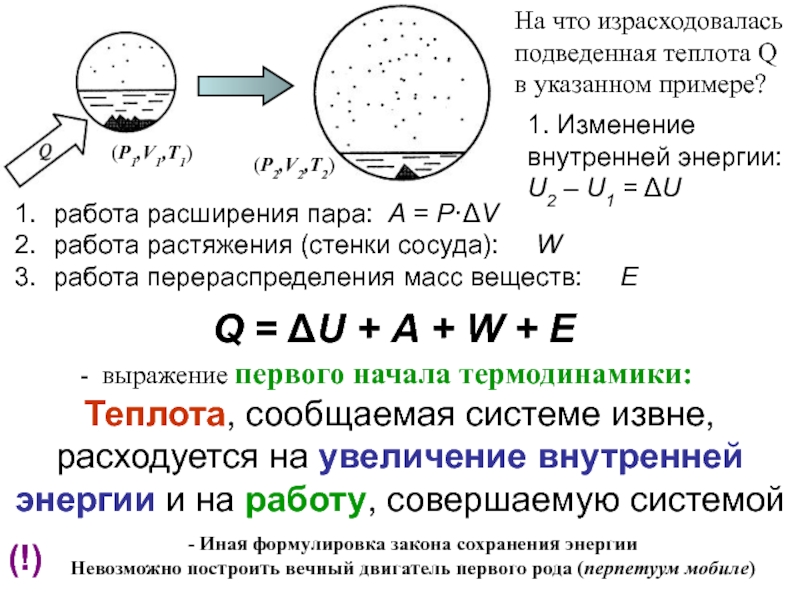
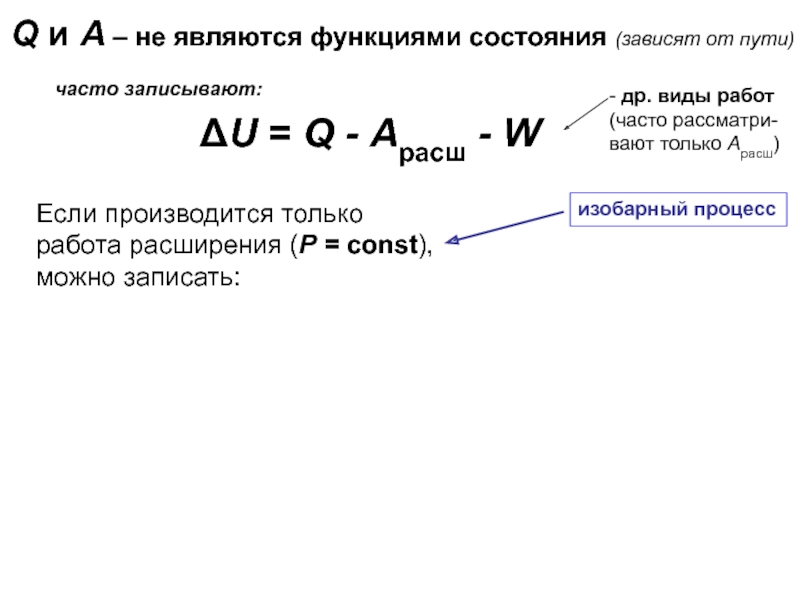






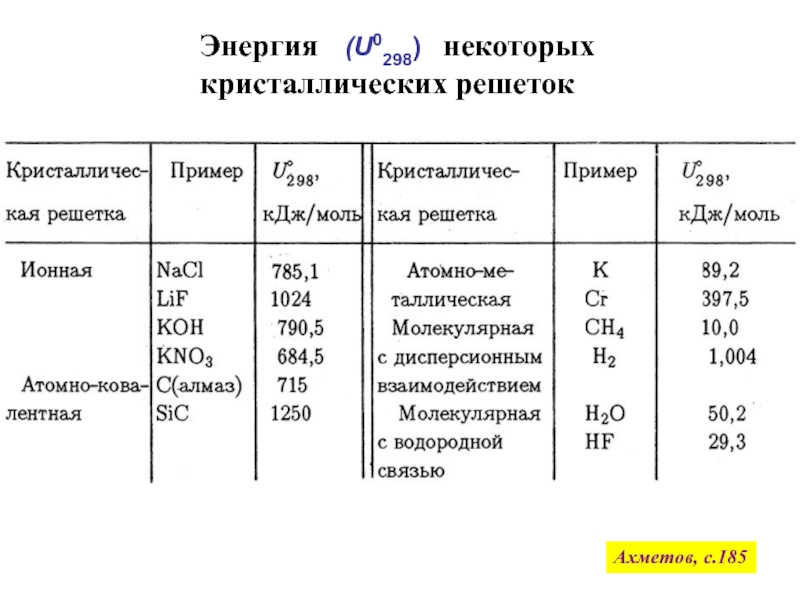








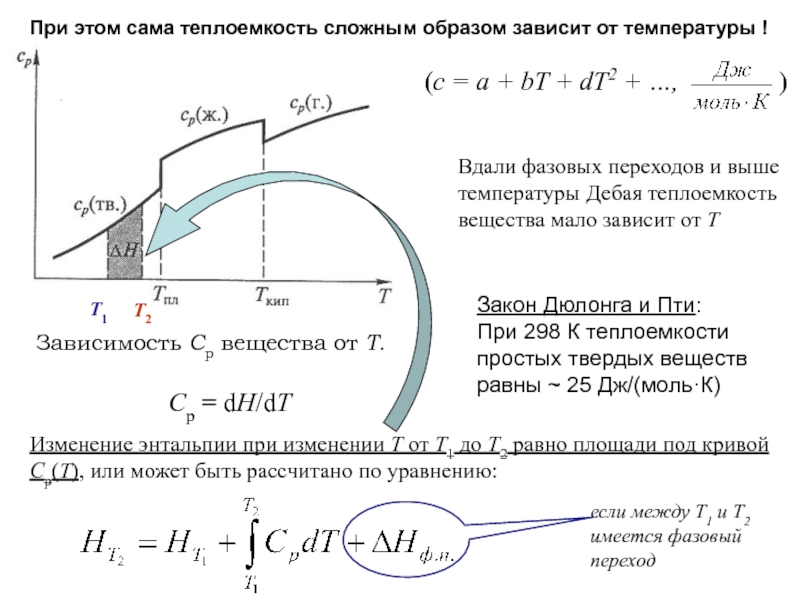
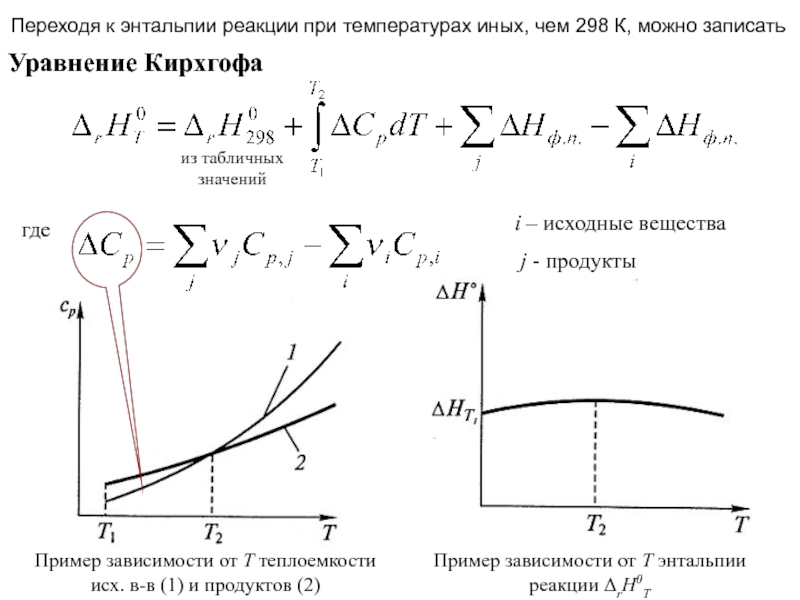




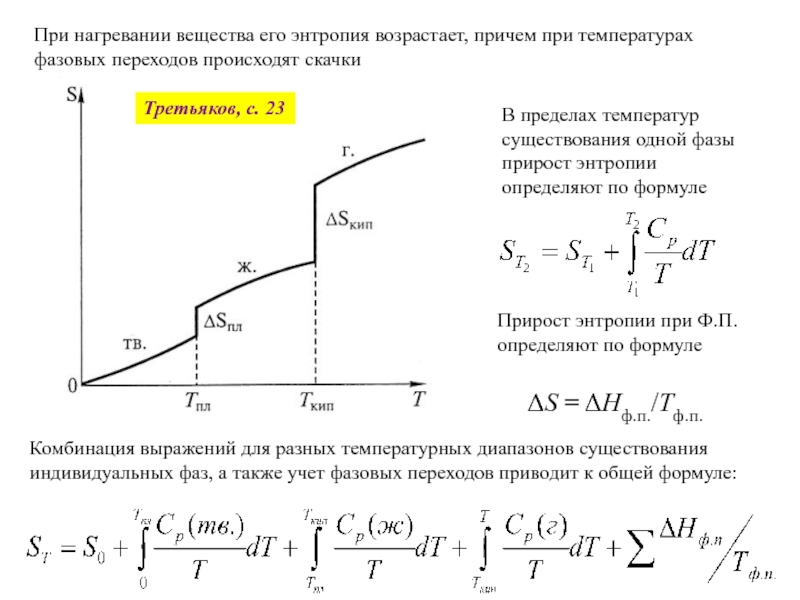






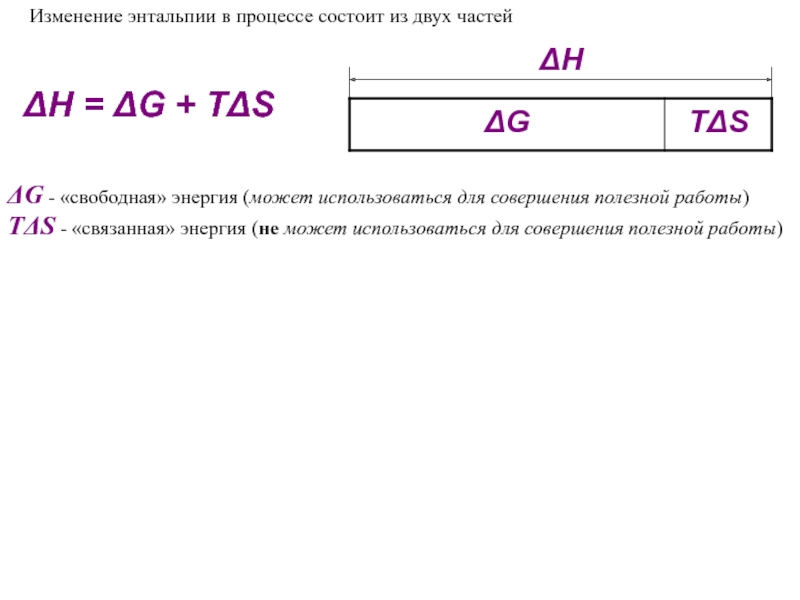





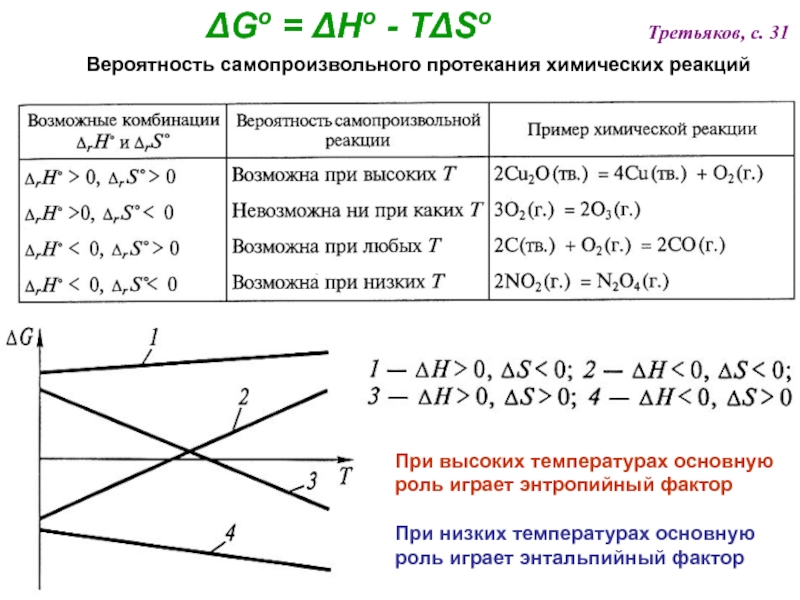




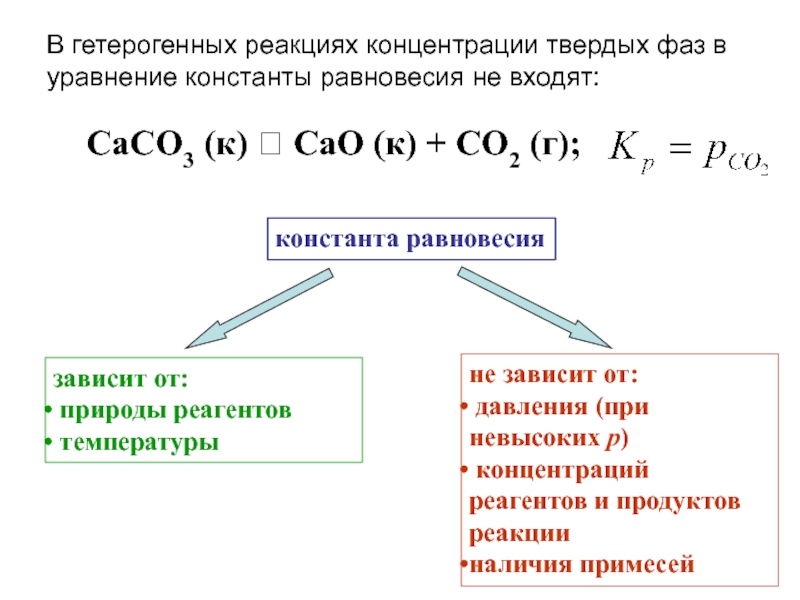
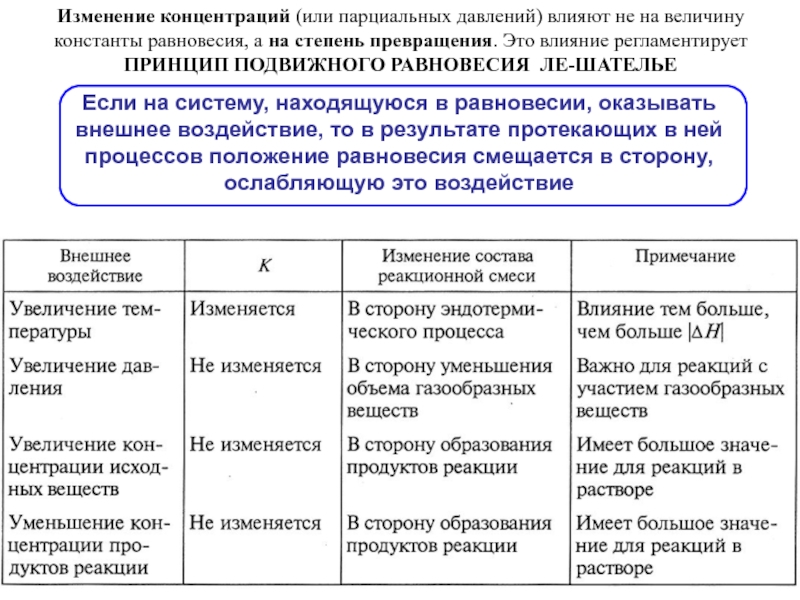
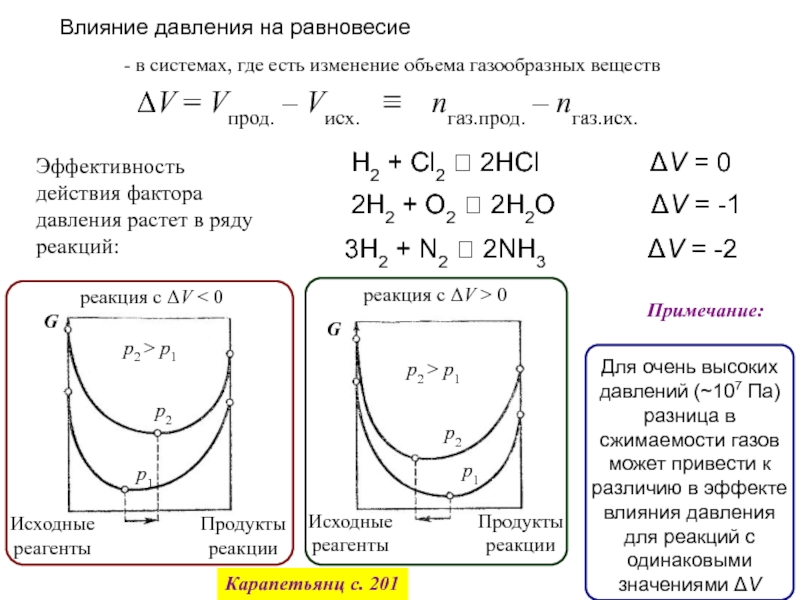


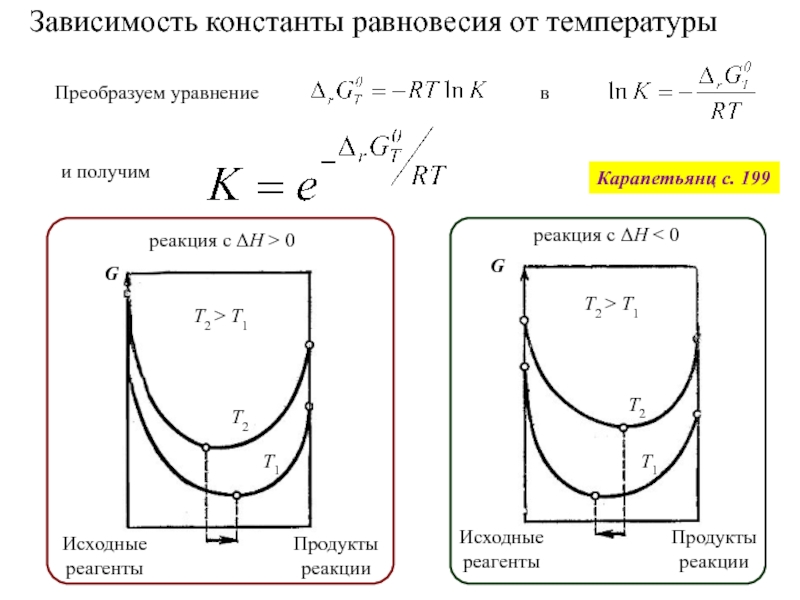
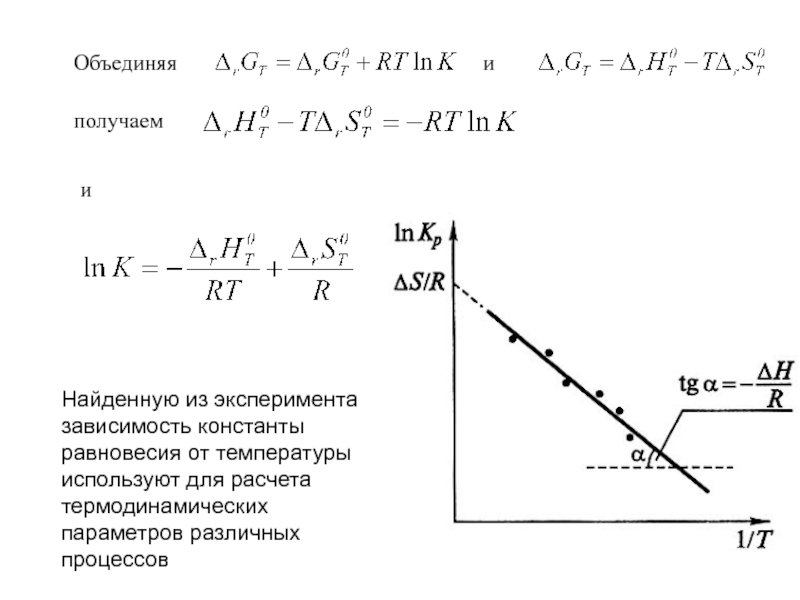

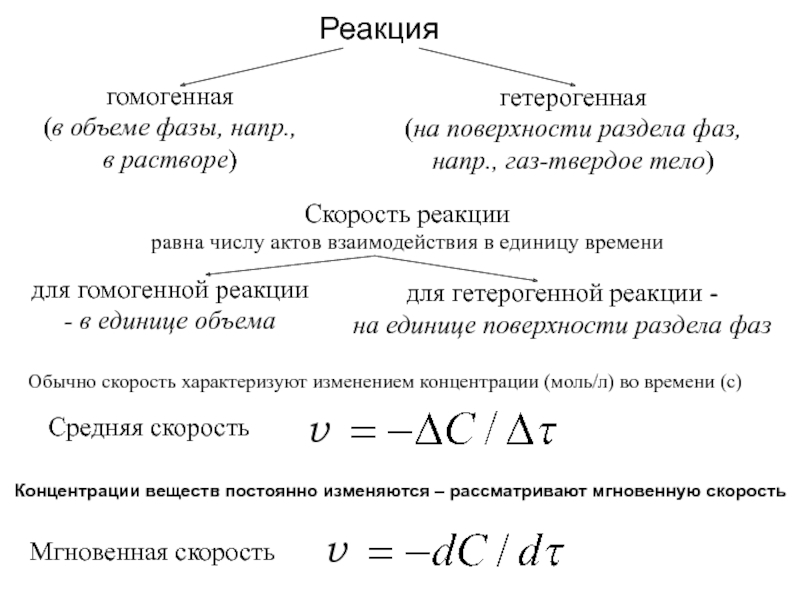


![Начала химической термодинамики
Х.Т. – раздел химии, изучающий
энергетику Для реакции разложения Н2О2:v = k[Н2О2]1Кинетические уравнения для реакций с различным Для реакции разложения Н2О2:v = k[Н2О2]1Кинетические уравнения для реакций с различным порядком2Н2О2 = 2Н2О + О2и убедились,](/img/thumbs/59493acb0217b1164c35ed0cd2aaead4-800x.jpg)

![Начала химической термодинамики
Х.Т. – раздел химии, изучающий
энергетику Физический смысл величины k:константа скорости реакции численно равна скорости реакции при Физический смысл величины k:константа скорости реакции численно равна скорости реакции при единичных концентрациях реагентовv = k[C]m[AB]n](/img/thumbs/a70d757d8351772b81a02bb7e0c32452-800x.jpg)


![Начала химической термодинамики
Х.Т. – раздел химии, изучающий
энергетику «Кинетический» вывод константы равновесияДля обратимой одностадийной реакции А + В «Кинетический» вывод константы равновесияДля обратимой одностадийной реакции А + В АВvпр = k[А][B]можно записать выражениезатем проявится](/img/tmb/3/261711/cb972b300114cde7f8d2d45398157e0c-800x.jpg)