Слайд 1Использование наноразмерных материалов и композитов в биологии и медицине.
Несмотря на имеющиеся реальные и вымышленные успехи нанотехнологий в
технике начнем с того, что имеет к нам всем самое непосредственное отношение. Это биология, медицина и здоровье человека.
Наиболее важными для жизнедеятельности любого человека являются наномедицина и нанобиология, поскольку их развитие сулит не только существенное продление человеческой жизни и избавление от многих болезней, в том числе и генетических, но и возможный переход человечества на качественно новую ступень развития (Ага, щас!).
Не исключено, что заложенная в нанонауке возможность конвергенции органического и неорганического мира таит в себе такие перспективы, которые мы даже сейчас не можем представить и осмыслить.
За последние десять лет число публикаций по проблемам наномедицины в мире выросло более, чем в десять раз, что свидетельствует о некотором интересе к этим вопросам и явном увеличении финансирования, что еще более важно.
Слайд 2 Нанобиотехнологии в недалеком будущем могут стать одним из
наиболее перспективных направлений научно-технического прогресса. При этом необходимо определиться заранее
с терминологией, т.к. относительно этого направления " высказываются самые разные мнения.
С одной стороны, существует точка зрения, что любые технологии, использующие биологические объекты, априори являются нанотехнологиями, т.к. все живые системы являются сложными молекулярными комплексами, в которых большинство молекул являются наноструктурами. Тем более это касается " генной инженерии.
С другой стороны, существует точка зрения, согласно которой к нанобиотехнологиям относятся только те, конечным продуктом которых являются наноразмерные электромеханические устройства, такие, как нанороботы или нанопереключатели на основе белков или нуклеиновых кислот.
Скорее всего, истина лежит между ними, но гораздо ближе к первой точке зрения, т.к. вторая попахивает идиотизмом.
Слайд 3 Естественно, что все биотехнологии не могут рассматриваться как
нанотехнологии, т.к. конечным продуктом большинства биотехнологических процессов, как правило, являются
организмы (бактерии, растения, животные), чьи размеры относятся в лучшем случае к микроуровню.
Если же в результате технологического процесса получается наноразмерная конструкция (белок, олигонуклеотид, липосома), то важно, чтобы она не просто была выделена из организма-продуцента, но именно была сконструирована, что подразумевает понимание структуры, механизма действия и технологии самого процесса сборки или модификации.
Очевидно, что к нанобиотехнологиям можно отнести и работы по изучению на модельных биологических системах действия химических наноструктур (фуллеренов, магнитных наносорбентов, нанотрубок и т.п.), которые затем могут иметь медицинское применение.
Технологии их применения на человеке - это скорее наномедицина, но подбор условий и изучение механизмов действия на клеточных культурах, органеллах, биомакромолекулах, и тем более на живых организмах разного уровня вполне можно отнести именно к области нанобиотехнологий.

Слайд 4 В принципе, дать точное однозначное определение, что есть
нанобиотехнология и чем она отличается от некоторых разделов биохимии или,
например, генной инженерии, крайне сложно.
Это междисциплинарная область, где применяются самые разные подходы, используемые и в других областях науки.
Это также трудно определить, как границу между биофизикой и физико-химической биологией или биохимией и биоорганической химией.
В процессе работы, как правило, используются самые различные методы исследования, способы интерпретации результатов.
Более конструктивно в каждом конкретном случае рассматривать, является ли рассматриваемый технологический продукт наноструктурой по своим размерам, был ли он специально сконструирован для определенных технологических целей и основано ли его получение на понимании структурной организации и механизма действия.
Слайд 5 Жизненные системы любого организма, в том числе
и человеческого, управляются молекулярным поведением в нанометрическом масштабе.
Молекулярные
строительные блоки жизни - протеины, нуклеиновые кислоты, липиды, углеводы - являются примерами материалов, обладающих уникальными свойствами в наноразмерном состоянии.
Предполагается, что изучение их вне организма и вне среды их деятельности позволит понять, как они функционируют в своей естественной среде.
Весьма смелое предположение, поскольку вне организма и вне среды, обеспечивающей жизнедеятельность они дохлые.
Вряд ли поможет разработке методов лечения различных заболеваний лицезрение полусгнившего трупа, вырытого из могилы через год после летального исхода.
Слайд 6 Светлые умы крайне малообразованных журналистов и темные умы
соискателей грантов различных фондов на полном серьезе утверждают, что:
Расширение наших возможностей в сфере определения индивидуального набора генов вызовет переворот в диагностике и терапии и позволит создать совершенно новые лекарственные препараты и реализовать новые пути доставки лекарств.
Появятся возможности охарактеризовать химические и механические свойства клеток, включая такие процессы как деление клеток и их передвижение.
Удастся разгадать тайну предела делимости клеток (41 раз для всех клеток, кроме раковых) в макроорганизмах.
Более того, появиться возможность управлять этим процессом и обеспечить лучших представителей рода человеческого, включая, видимо, и наше правительство, индивидуальным бессмертием.
Достижение наноразмера сделает возможным использование плохорастворимых веществ в качестве лекарств.
Слайд 7 Молекулярные сита позволят направленно фракционировать болезнетворные вирусы и
быстро находить пути их разрушения (вот это вряд ли).
С помощью нанотехнологии уже возможно создание биоимплантантов, повышение надежности их к отторжению и сенсорных систем, обнаруживающих возникновение заболевания в организме.
Биосовместимые наноматериалы медикотехнических изделий, контактируя с биосредой, обеспечивают сохранение собственных параметров для заданного функционирования изделий и не вызывают иммунных реакций среды с появлением вредных изменений в тканях и органах.
Данные материалы чаще всего применяются для медицинских имплантатов в ортопедии, стоматологии, сердечно-сосудистой хирургии с целью восстановления нарушенных либо утраченных функций органов.
Такие имплантаты испытывают механические и биологические воздействия, поэтому обычно имеют комбинированную конструкцию, включающую прочную основу из биоинертного металла и покрытие из биоактивного материала
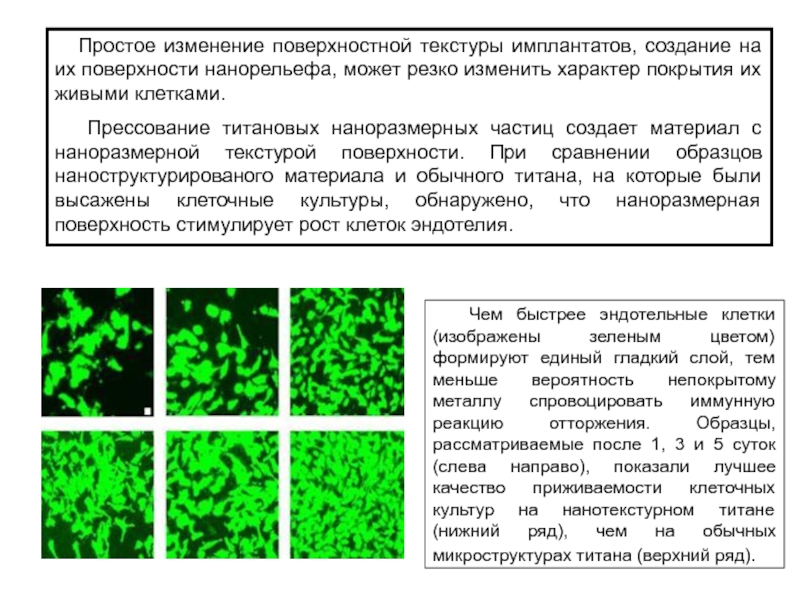
Слайд 8 Простое изменение поверхностной текстуры имплантатов, создание на их
поверхности нанорельефа, может резко изменить характер покрытия их живыми клетками.
Прессование титановых наноразмерных частиц создает материал с наноразмерной текстурой поверхности. При сравнении образцов наноструктурированого материала и обычного титана, на которые были высажены клеточные культуры, обнаружено, что наноразмерная поверхность стимулирует рост клеток эндотелия.
Чем быстрее эндотельные клетки (изображены зеленым цветом) формируют единый гладкий слой, тем меньше вероятность непокрытому металлу спровоцировать иммунную реакцию отторжения. Образцы, рассматриваемые после 1, 3 и 5 суток (слева направо), показали лучшее качество приживаемости клеточных культур на нанотекстурном титане (нижний ряд), чем на обычных микроструктурах титана (верхний ряд).
Слайд 9 Наночастицы реально могут использоваться в качестве эффективной системы
доставки лекарственных препаратов. С этой целью применяются многослойные наночастицы биодеградируемых
материалов (природные или синтетические полимеры, липиды), а также металлов.
Основные требования, которые предъявляются к наноносителям, это отсутствие токсичности, иммуногенности, способность к переносу достаточного количества лекарственного препарата и освобождение его в оптимальной дозе.
При внутривенном введении наночастицы быстро выводятся из крови, аккумулируясь преимущественно в клетках печени, что ей, правда, не очень нравится.
Наночастицы также применимы для адресной доставки лекарств. Терапевтические и диагностические агенты (препараты) могут быть инкапсулированы, привязаны к наноносителям или адсорбированы на них.
Благодаря малому размеру и функционализации наночастицы могут быть нацелены на определённый тип клеток и поступать в заданный сектор организма после системного введения.
Слайд 10 При лечении неоперабельных больных раком печени использовались технологии
введения под контролем ультразвукового аппарата специальными иглами капсул, размером меньше
рисового зерна, с наночастицами радиоактивного йода, который постепенно губит раковые клетки.
Каждое зерно облучает очень маленькое пространство, поэтому прилегающие нормальные клетки не подвергаются повреждению.
Начинку капсул составляет препарат BrachySil на основе радиоактивного материала, полученного с помощью нанотехнологий — 32P-BioSilicon
Микрокапсулы BioSilicon
Слайд 11 Разрабатывается методика лечения рака на основе использования структур
типа наносфер, представляющих собой микроскопические силиконовые шарики, покрытые тончайшим слоем
золота, и электромагнитного излучения длинноволновой инфракрасной области спектра.
Наносферы нетоксичны и выводятся из организма без каких-либо побочных эффектов, а длинноволновое ИК-излучение, испускаемое лазером, практически не взаимодействует с тканями организма.
При введении наносфер происходит их аккумуляция в опухоли. Последующее воздействие длинноволнового ИК света разогревает золотую оболочку частиц, что приводит к гибели опухолевых клеток.
Кроме того, благодаря своему размеру – несколько нанометров в диаметре – наносферы взаимодействуют со светом определенным образом, что позволяет, меняя размер ядра и оболочки, подстраивать их на определенную длину световой волны.
Для решения проблемы адресной доставки были сконструированы иммунонаносферы – наносферы, к которым, поверх золотого слоя, прикрепляются антитела, специфичные к опухолевым маркерам и позволяющие обнаружить опухоль в любой части тела

Слайд 12 Наносферы с золотом среди красных кровяных телец в
кровеносной артерии.
Полное торжество Фотошопа. Эксперимент необязателен.
Слайд 13 В лечении рака появилась фотодинамическая терапия, в основе
которой лежит использование светочувствительных материалов, известных как сенсибилизаторы. Эти вещества
способны выделять "реактивный кислород", уничтожающий раковые клетки.
Существующие на сегодняшний день сенсибилизаторы разлагаются под воздействием солнечного света, токсичны и оказывают побочный эффект на организм человека.
Предложено использовать специальные полимерные наночастицы, которые доставляют сенсибилизаторы к раковым клеткам, после чего сенсибилизаторы высвобождаются и производят противораковый эффект.
Для создания таких наночастиц использовали биоразлагаемый полимер, известный как полиакрилгликолевая кислота.
Эти наночастицы были использованы для инкапсулирования фоточувствительного сенсибилизатора.
Молекулы сенсибилизатора агрегируются внутри наночастицы, что позволяет минимизировать влияние на них солнечного света.
Слайд 14 Когда наночастицы встречаются с раковыми клетками, они распадаются
и высвобождают молекулы сенсибилизатора. Его молекулы дезагрегируются и более активно
уничтожают раковые клетки.
При условии хранения в темноте при комнатной температуре такие наночастицы, начиненные сенсибилизатором, остаются стабильными от 6 до 12 месяцев.
Наночастицы - универсальный контейнер по доставке лекарств
Слайд 15 Аналогично ля доставки токсинов внутрь клетки синтезировали специальные
двухслойные наночастицы, названные "наноснарядами".
Оказывается, чтобы капсула попала
по адресу, не нужно присоединять к ней белковые маркеры, комплементарные таким же на поверхности мембраны раковой клетки.
Морфология мембраны клеток такова, что у раковых клеток диаметр пор составляет около 400-500 нанометров, в то время как у здоровых клеток поры гораздо меньше.
Чтобы наноснаряды не попадали в здоровые клетки, а через поры раковых проходили достаточно легко их синтезировали диаметром 200 нанометров.
Для предотвращения попадания в организм человека токсинов, находящихся в нанокапсулах наноснаряды делают двойными: во внешней оболочке находится препарат, вызывающий коллапс кровеносных сосудов, что предотвратит распространение токсина по всему организму, а в ядре - токсин, убивающий раковую клетку.
Слайд 16 Внешняя оболочка наночастиц, попадая в опухолевую ткань, рассасывается,
выпуская наружу лекарство, сокращающее сосуды, в то время как остальные
наночастицы проникают через поры в мембранах раковых клеток, где вторая оболочка наночастиц выпускает токсин, медленно убивающий опухоль.
Микрофотографии нанокапсул и их структура
Слайд 17 Для покрытия наночастиц особенно часто используется полиэтиленгликоль (но
не в виде тосола или антифриза), который создаёт эффект "стерической
стабилизации". Его молекулы формируют защитный гидрофобный слой на поверхности наночастицы, который препятствует захвату наночастиц клетками системы фагоцитов
Биотехнология, основанная на нанокомпозитах, требует повышенного внимания с точки зрения воздействия на окружающую среду и общество.
Сконструированные на молекулярном уровне биоразрушаемые химикаты для питания растений и защиты от насекомых, улучшение генофонда животных и растений, снабжение генами и лекарствами животных и растений – все эти направления прямо или косвенно могут воздействовать на человека, его здоровье и качество жизни.
Наиболее перспективным считается создание основанных на наномассивах тестовых технологии для тестирования ДНК. Такие технологии позволят растениеводам узнать, какие гены активизируются в растении при засолении (почвы, а не огурчиков) или засухе.
Слайд 18 Применение нанотехнологий в сельском хозяйстве только начинает становиться
существенным и как это скажется на экологии, требует пристального внимания
целой толпы бездельников, включая «экологов» и журналюг.
Необходимо изучение потенциальных рисков, которые могут нанести наноматериалы здоровью, регулировать порядок использования продуктов на основе нанотехнологии.
Необходимо проведение исследований касающихся дальнейшей судьбы и транспортировки произведенных материалов, их влияния на окружающую среду, и в развитии технологий оценки полного жизненного цикла наноматериалов.
Важнейшей задачей нанотехнологии в медицине является разработка диагностических биочипов для экспресс анализа различных заболеваний и состояния организма. Ведущей организацией в России и мире по разработке и производству биологических микрочипов (биочипов) является Институт молекулярной биологии им. В.А. Энгельгардта РАН (г. Москва) и его дочерние фирмы, основная цель которых - коммерциализация результатов научно-исследовательских и опытно-конструкторских работ, проводимых в этой области.
Слайд 19 Разработанные технологии позволяют реализовывать как двумерные чипы, так
и трехмерные. Фотография двумерного чипа приведена на рисунке, реальный размер
подложки составляет единицы мм.
На двумерных чипах велико влияние подложки, которая вносит существенную неоднородность в молекулярные взаимодействия и приводит к уменьшению стабильности комплексов между зондами и анализируемыми молекулами, в тоже время в трехмерных гелевых биочипах взаимодействие между молекулами примерно такое же, как в растворе.
Увеличенное изображение двумерного биочипа.
Двумерный и трехмерный чипы.
В трехмерной конфигурации ячеек в гелевых биочипах общее число молекулярных зондов на 2-3 порядка выше, чем в поверхностных биочипах, что приводит соответственно к более сильному и достоверному сигналу флуоресценции при проведении анализа.
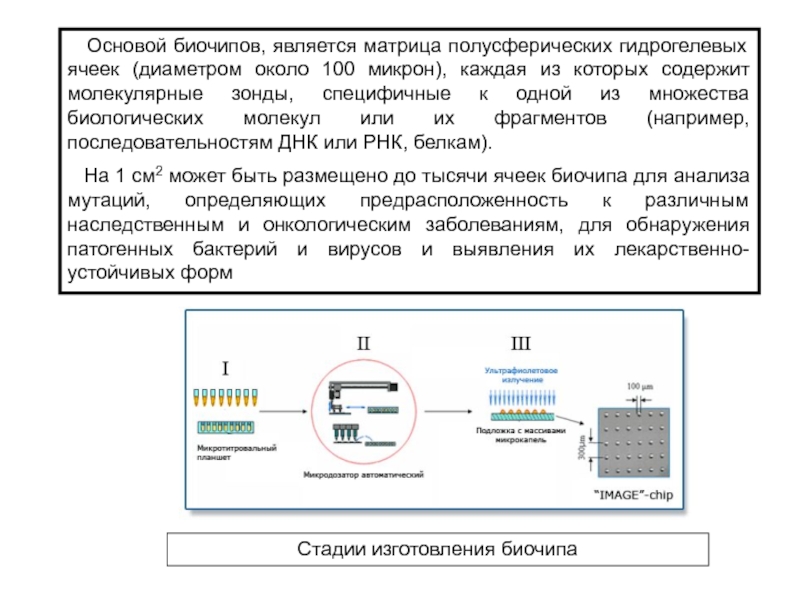
Слайд 20 Основой биочипов, является матрица полусферических гидрогелевых ячеек (диаметром
около 100 микрон), каждая из которых содержит молекулярные зонды, специфичные
к одной из множества биологических молекул или их фрагментов (например, последовательностям ДНК или РНК, белкам).
На 1 см2 может быть размещено до тысячи ячеек биочипа для анализа мутаций, определяющих предрасположенность к различным наследственным и онкологическим заболеваниям, для обнаружения патогенных бактерий и вирусов и выявления их лекарственно-устойчивых форм
Стадии изготовления биочипа
Слайд 21 На первой стадии (I) изготавливаются композиции, содержащие биологически
активное соединение, служащее зондом при анализе, и мономеры для формирования
гидрогеля. Эти композиции с помощью дозаторов переносятся в микротитровальные планшеты.
На второй стадии (II) композиции из микротитровальных планшетов переносятся на нефлуоресцирующую плоскую подложку (стекло, пластик, метал и т.д.) в виде массива микрокапель с помощью автоматического микродозатора (робота).
На третьей стадии (III) массивы микрокапель подвергаются воздействию ультрафиолетового излучения для инициирования процесса фотополимеризации.
I стадия
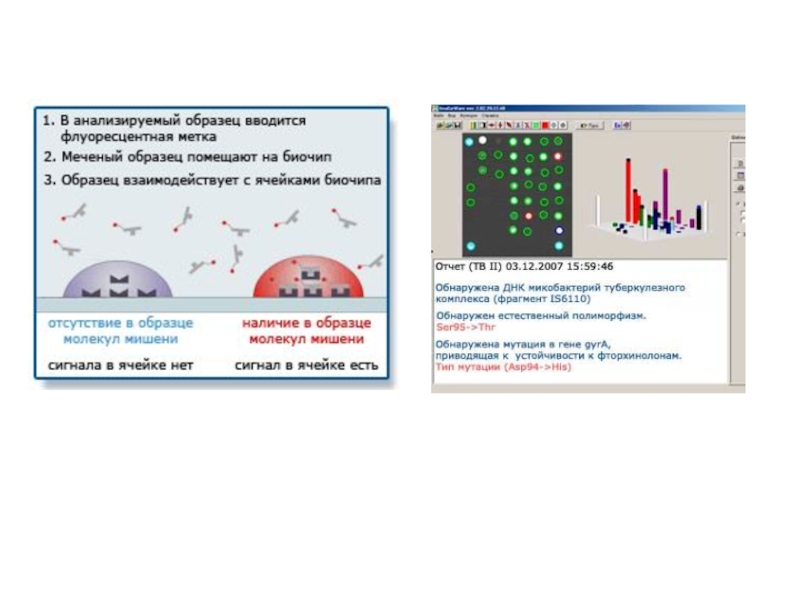
Слайд 22 Для тестирования каждого заболевания изготавливаются соответствующие биочипы.
Набор реагентов "ОМ-БИОЧИП (ПСА)" применяется для одновременного количественного определения
общей и свободной форм простат-специфического антигена методом иммуно-флуоресцентного анализа на биологическом микрочипе.
Анализ двух форм ПСА на биочипе проводится в формате "один пациент – один биочип".
. При проведении анализа иммобилизованный ПСА взаимодействует с проявляющими антителами, при этом интенсивность флуоресцентных сигналов гелевых ячеек пропорциональна концентрации иммобилизованного ПСА.
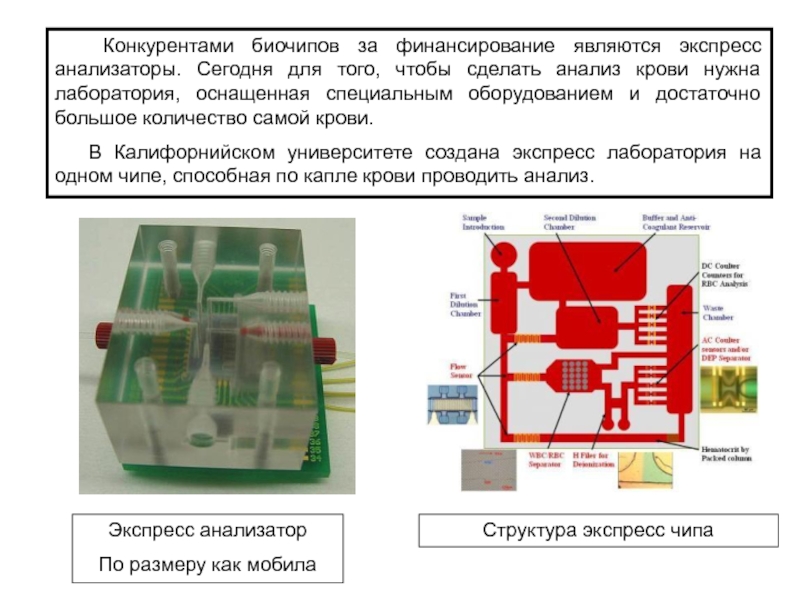
Слайд 24 Конкурентами биочипов за финансирование являются экспресс анализаторы. Сегодня
для того, чтобы сделать анализ крови нужна лаборатория, оснащенная специальным
оборудованием и достаточно большое количество самой крови.
В Калифорнийском университете создана экспресс лаборатория на одном чипе, способная по капле крови проводить анализ.
Экспресс анализатор
По размеру как мобила
Структура экспресс чипа
Слайд 25 Вначале капля крови поступает в смесительный резервуар, в
котором она смешивается с анти-коагуляторами, препятствующие ее свертыванию.
Затем в специальный контейнер, где кровь "разжижается", что позволяет затем посчитать отдельные клетки.
После разбавления крови образец поступает в сепаратор, где клетки отделяются друг от друга по размерам и направляются по отдельным конвейерам далее.
Сепарация осуществляется благодаря гидродинамическим свойствам крови как жидкости.
Анализатор можно переоборудовать для идентификации разных молекул, вирусов и бактерий, что позволит получить более полную информацию о крови чем та, которую можно получить с помощью традиционного анализа.
Слайд 26 Разработан новый метод введения биоматериалов в живые клетки,
основанный на электрораспылении частиц металла, несущих большой электрический заряд и
имеющих высокую скорость.
Если металлические частицы, поверхность которых покрыта генами, диспергировать, то они дезинтегрируются в жидких каплях под влиянием внешнего неоднородного поля.
Получаемые при этом фрагменты гена обладают зарядом того же знака, что и частицы металла, характеризуются высокой концентрацией и могут внедряться в живую клетку.
Вопрос о том, к чему это может привести совершенно никого не волнует, а зря.
В качестве новых контрастных материалов для магнитно-резонансных исследований в медицине предложено применять наночастицы с примесью ионов гадолиния. Такие частицы диаметром 120 нм достаточно малы и могут легко проникать в кровеносные сосуды.
Вопрос в том, как вывести их обратно. Но на результатах магнитно-резонансного исследования невывод таких частиц не скажется.
Слайд 27 Более 85% всех видов рака зарождаются в эпителии,
толщина которого в организме человека может быть до 500 мкм.
Мощным инструментом диагностики таких онкологических заболеваний на ранних стадиях является метод двухфотонного исследования, который позволяет проводить неразрушающую интроскопию (глубинное исследование) внутренних характеристик клеток, лежащих на сотни микрон вглубь ткани.
В этом методе используются маркеры - люминесцентные контрастные агенты: квантовые точки и металлические наночастицы.
Однако большинство квантовых точек содержат тяжелые металлы, которые являются цитотоксическими, что делает их непригодными для клинического применения, однако не создает проблем для лабораторного. Бомжей пока хватает.
Для нормальных клинических исследований оказались применимы наночастицы золота. Они не только биосовместимы, но и изображения, получаемые с их помощью, почти в 4000 раз ярче, чем при использовании метода автофлюоресценции. А их химическая инертность позволяет исключить нежелательные воздействия.
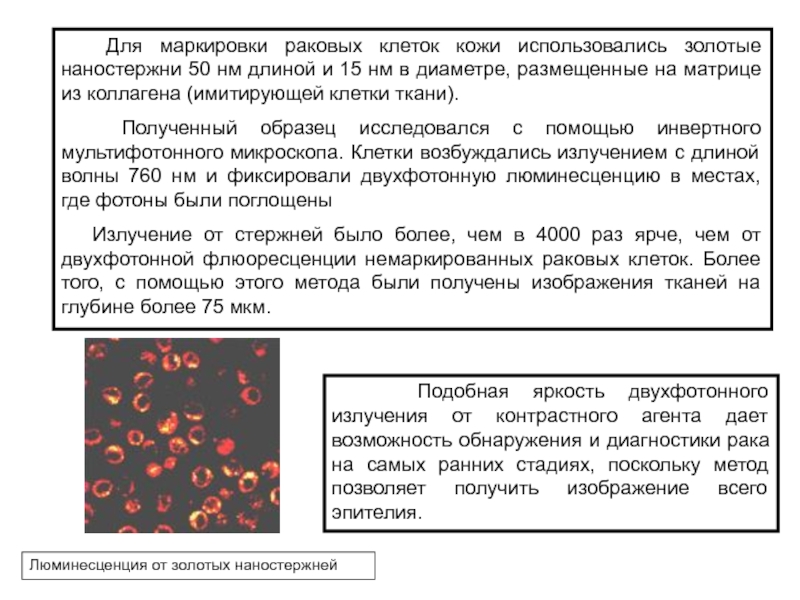
Слайд 28 Для маркировки раковых клеток кожи использовались золотые наностержни
50 нм длиной и 15 нм в диаметре, размещенные на
матрице из коллагена (имитирующей клетки ткани).
Полученный образец исследовался с помощью инвертного мультифотонного микроскопа. Клетки возбуждались излучением с длиной волны 760 нм и фиксировали двухфотонную люминесценцию в местах, где фотоны были поглощены
Излучение от стержней было более, чем в 4000 раз ярче, чем от двухфотонной флюоресценции немаркированных раковых клеток. Более того, с помощью этого метода были получены изображения тканей на глубине более 75 мкм.
Подобная яркость двухфотонного излучения от контрастного агента дает возможность обнаружения и диагностики рака на самых ранних стадиях, поскольку метод позволяет получить изображение всего эпителия.
Люминесценция от золотых наностержней
Слайд 29 Аналогично короткие отрезки нанопроводников (наноштыри) использовались в лазерном
сканировании кровеносных сосудов.
Преимущество в использовании наноматериалов состоит
в повышении их яркости при освещении ткани лазером.
Так, наноштыри в 60 раз ярче флуоресцентных родаминовых меток, используемых сейчас в диагностике, а их малые размеры (60 нанометров в длину, 20 нанометров в ширину, что в 200 раз меньше, чем красная кровяная клетка эритроцит) позволяют достичь высокого разрешения сканирования.
С их помощью можно будет изучать отдельные клетки, не говоря уже о сосудах.
Применение наноштырей позволяет использовать технику, называемую двухфотонной флуоресценцией.
Ее суть сводится к тому, что на наноштырь при диагностике попадает два фотона, что существенно увеличивает контраст изображения и его яркость. Благодаря этому эффекту можно использовать нелинейную оптику для улучшения качества изображения.
Слайд 30 В лабораторных тестах исследователи внедрили наноштыри в кровеносную
систему мыши и наблюдали структуру ее кровеносных сосудов, расположенных в
тканях уха.
Как оказалось, наноматериалы в 58 раз превышают по свечению родаминовые метки, тоже использующие технику двухфотонной флуоресценции.
Диагностика мыши закончилась уже через полчаса - наноштыри были выведены из крови почками, а мышь почему-то не сдохла.
Такую же технику диагностики можно использовать при нахождении раковых опухолей.
При этом диагностика будет точной и быстрой и не причинит вреда организму человека.
Диагностика с помощью наноштырей
Слайд 31 Одним из действительно реальных и значимых направлений нанотехнологии
является наука, ранее называвшаяся бионикой, но названия нанобионика почему-то не
получившая. Но все поправимо.
Основной и абсолютно правильный ее постулат – учиться у Природы. Приверженцы бионики совершенно разумно полагали, что все мало-мальски совершенное и нужное уже имеется в живой природе и надо только иметь мозги, чтобы это подсмотреть и использовать.
Поскольку с мозгами не все так хорошо, то апологеты бионики шли другим путем – брали то или иное техническое решение и искали его аналог в живой природе. И что характерно – чаще всего успешно, примеров тому не счесть.
Обратные примеры пока отсутствуют.
Однако есть перспективы, что на наноуровне они появятся.
Известно, что прочность нитей паутины превышает прочность стальной проволоки той же толщины, и даже превышает прочность нитей полимера кевлара в несколько раз.
Поэтому в исследовании искусственной паутины на сегодняшний день заинтересованы многие лаборатории.
Слайд 32 Оказалось, что нить паутины состоит из множества связанных
нановолокон. тогда как нить шёлка является единым цельным волокном.
Чтобы создать искусственную паутину, необходимо определить структуру и молекулярные особенности синтеза природной паутины, которую совершенно не заморачиваясь без проблем плетет крайне малообразованный паук.
Природная нить паутины имеет толщину около 5 микрон. При исследованиях синтеза паутины пауками класса Nephila, было показано, что специальные желёзы на брюшке паука выделяют нановолокна, сплетающиеся впоследствии в единую нить.
Железы, выделяющие нити паутины. Электронная микроскопия
Для работы использовался искусственный белок паутины Spidroin 1, экспрессированный в дрожжах в институте НИИ Генетики, Москва. В итоге была разработана модель нити паутины и показана возможность самосборки нановолокон паутины из раствора белка.
Благодаря использованию АСМ зондов удалось различить периодически меняющуюся толщину нановолокна.
Слайд 33 Оказалось, что путём самосборки из раствора белка концентрацией
около 0,15мг/мл образуются нановолокна паутины длиной от 100 нм до
5 микрон, и толщиной около 3 нм.
Удалось также различить периодически меняющуюся толщину нановолокна.
Нановолокна из рекомбинантного белка паутины. Толщина нанофибриллы меняется с периодом 25-30 нм.
Модель нановолокна паутины.
Слайд 34 Обнаружение периодичности нановолокон паутины и её количественное исследование
позволило аргументировано предложить модель структуры нановолокна.
Согласно этой
модели полиаланиновые последовательности объединяются не в плоскую β-структуру, а суперскрученную, при этом соседние β-структуры соединяются между собой глицин-богатыми участками. Такая модель имеет вид скрученной ленты.
Предполагается, что во время самосборки нанофибрилл, от основного нановолокна отслаиваются отдельные ленты, на которые в последствии наращиваются другие ленты, дополняя ответвление до полноразмерной нанофибриллы.
Слайд 35 Одним из самых важных направлений, связанных с нашей
жизнедеятельностью, является изучение вирусов. Вирусы - биологически активные частицы, состоящие
из белковой оболочки (капсида) и генетического материала (РНК или ДНК) .
Вначале вирусы считали ядовитыми веществами, затем - одной из форм жизни, потом - биохимическими соединениями. Сегодня предполагают, что они существуют между живым и неживым мирами и являются основными участниками эволюции.
Они характерны тем, что не имеют собственного белок-синтетического аппарата и для репродукции им требуется клетка хозяин, которая синтезирует вирусные белки и делает копии его генетического материала.
Грубо говоря, паразит, типа министра финансов Кудрина.
Как правило, вирусы имеют икосаэдрическую форму (сферические частицы) или спирально-симметричные палочки (прямые или изогнутые в зависимости от их длины и жесткости). Реже вирусы имеют более сложное строение.
Слайд 36 Любой вирус состоит из нуклеиновой кислоты (ДНК или
РНК), упакованной в белковую оболочку.
Помимо защитных белков
у некоторых из них есть специфические вирусные белки, участвующие в инфицировании клетки.
Если судить о вирусах только по этому описанию, то они действительно больше похожи на химические субстанции, чем на живой организм.
Но когда вирус проникает в клетку (после чего ее называют клеткой-хозяином), картина меняется.
Вирус сбрасывает белковую оболочку и подчиняет себе весь клеточный аппарат, заставляя его синтезировать вирусные ДНК или РНК и вирусные белки в соответствии с инструкциями, записанными в его геноме.
Далее происходит самосборка вируса из этих компонентов и появляется новая вирусная частица, готовая инфицировать другие клетки.
Слайд 37Различные виды вирусов: а) икосаэдрический, б)спиральносимметричный, в) оболочечный, г) бактериофаг
со смешанной симметрией
Низведение вирусов до уровня безжизненных
химических объектов произошло после 1935 г., когда Уэнделл Стэнли (Wendell Stanley) впервые закристаллизовал вирус табачной мозаики.
Обнаружилось, что кристаллы состоят из сложных биохимических компонентов и не обладают необходимым для биологических систем свойством - метаболической активностью.
Слайд 38 Вирусы, занимающие промежуточное положение между живым и неживым,
проявляют неожиданные свойства.
Вот одно из них. Обычно
вирусы реплицируются только в живых клетках, но способны расти и в погибших клетках, а иногда даже возвращают последних к жизни.
Как ни удивительно, но некоторые вирусы, будучи разрушенными, могут возродиться к "жизни взаймы".
Клетка, у которой уничтожена ядерная ДНК, - настоящий "покойник": она лишена генетического материала с инструкциями о деятельности.
Но вирус может использовать для своей репликации оставшиеся целыми компоненты клетки и цитоплазму. Он подчиняет себе клеточный аппарат и заставляет его использовать вирусные гены как источник инструкций для синтеза вирусных белков и репликации вирусного генома.
Уникальная способность вирусов развиваться в погибших клетках наиболее ярко проявляется, когда хозяевами служат одноклеточные организмы, прежде всего населяющие океаны.
Слайд 39 Бактерии, фотосинтезирующие цианобактерии и водоросли, потенциальные хозяева морских
вирусов, нередко погибают под действием ультрафиолетового излучения, которое разрушает их
ДНК.
При этом некоторые вирусы ("постояльцы" организмов) включают механизм синтеза ферментов, которые восстанавливают поврежденные молекулы хозяйской клетки и возвращают ее к жизни.
Например, цианобактерии содержат фермент, который участвует в фотосинтезе, и под действием избыточного количества света иногда разрушается, что приводит к гибели клетки.
И тогда вирусы под названием цианофаги "включают" синтез аналога бактериального фотосинтезирующего фермента, более устойчивого к УФ-излучению.
Если такой вирус инфицирует только что погибшую клетку, фотосинтезирующий фермент может вернуть последнюю к жизни. Таким образом, вирус играет роль "генного реаниматора"
Слайд 40 Безусловно, как все новое и неизведанное, нанотехнология и
ее продукция может в шаловливых ручонках представлять опасность, может даже
и большую, чем топор или бензопила, которой в Польше будущий жених на радостях перед свадьбой отрезал себе голову.
Его можно понять. Труднее понять великовозрастного, но крайне малообразованного недоумка Принца Чарльза, который прочитал фантастическую книгу "Жертва" Майкла Крайтона и теперь является одним из самых яростных противников развития нанотехнологий в мире.
Опасности нанотехнологии, реальные и мнимые
Только клинические идиоты, включая наследника британской короны, не имеющие даже поверхностного представления о современных производственных процессах, могут поверить в то, что ботинки или плазменные панели в наноэру будут производиться "тучей" нанороботов, собирающих их поатомно.
Такой же глупостью представляется идея получения сверхчистых материалов путем сепарации атомов молекулярным роботом. При разборке сырья на молекулы с помощью дизассемблеров возникает проблема идентификации отдельных "разобранных" атомов и молекул. Гораздо проще получить сверхчистые материалы в больших количествах методами промышленной химии.

Слайд 41 Весьма наивной представляется идея, что в эру нанотехнологий
все товары будут очень дешевыми и они будут доступны всем
желающим в любом количестве. Щас!
Любое высокотехнологичное производство никогда не было дешевым. Стоимость готового продукта (при самом грубом приближении) определяется суммированием затрат на производственное оборудование, затрат на сырье для производства и потребленную энергию, затрат на оплату труда обслуживающему персоналу и оплату интеллектуальной собственности (патентов и пр.). Также следует не забывать о том, что в готовом продукте немалую часть составляет прибыль предприятия-изготовителя плюс затраты на взятки чиновникам всех уровней.
Слайд 42 Мечтается, что можно будет воскрешать мертвых благодаря медицинским
нанороботам, которые будут восстанавливать тела умерших поатомно. Честное слово, так
и пишут!!!
И если затем что-то в твоем теле необходимо будет изменить, то полчища нанороботов перестроят его за доли секунды: вырастят дополнительные ноги/руки, изменят форму и прочность тела и некоторых жизненно важных органов, и переведут метаболизм с кислорода на метан или спирт. Впрочем, последним нас не удивишь.
В течение клинической смерти еще есть шансы поддержать жизнь в пациенте, пока жив головной мозг. При смерти человека происходит потеря структуры самого главного органа - головного мозга.
Даже если периодически записывать поатомную структуру головного мозга пациента, а потом восстанавливать его с последнего "чекпоинта", то это будет не тот человек, который умер.
Быстрые и не быстрые преобразования в организме возможны лишь в определенных пределах, поэтому не стоит ждать от нанотехнологий чудес.
Слайд 43 Является крайним заблуждением уверенность, что все эти чудеса
нанотеха произойдут уже через 10-20 лет! Держи – лови.
Создание первых примитивных наномашин (нанокомпьютеров, наноманипуляторов и наномеханизмов) потребует инструментария, которого еще не существует даже в головах инженеров.
С помощью современной атомно-силовой и сканирующей зондовой микроскопии сделать даже простейший наноподшипник практически невозможно, так как это трехмерная наноструктура.
На сегодняшний день исследователям удалось создавать атом за атомом лишь плоские структуры, состоящие из десятка атомов. Поатомная сборка современными микроскопами нанокомпьютера, например, сравнима со строительством египетских пирамид с помощью пинцета.
Поэтому с помощью современной технической и инструментальной базы сделать наносистемы с атомарной точностью нельзя.
Слайд 44 Вероятно, разовьются биотехнологические методы производства отдельных упорядоченных молекул
и заранее спроектированных белков.
Белки-энзимы в природе выполняют функции
природных наномашин, и если человеку удастся повторить эти биологические механизмы, то появится возможность производить и синтезировать простейшие наноструктуры, из которых впоследствии можно будет собрать наноманипуляторы и нанокомпьютеры, эти базовые блоки наномашин и нанороботов.
На основе живого мотора, использующего бактерию Mycoplasma mobile, была сконструирована микроструктура, состоящую из шестеренки-ротора диаметром 20 микрон, находящейся в специфической полости, в которой, собственно, и находились бактерии. Зацепившись за вращающийся ротор и подложку, бактерии должны были двигать его против часовой стрелки. Через несколько минут после запуска бактерий в канал скорость вращения шестеренки составила 1,5-2,6 оборотов в минуту. А зачем?
Структура биологического механизма.