Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Неорганическая химия Курс лекций для студентов медико-биологического
Содержание
- 1. Неорганическая химия Курс лекций для студентов медико-биологического
- 2. Лекция № 1 Химическое равновесие.Протолитические равновесия и процессы в растворах электролитов
- 3. Содержание лекции6. Степень и константа диссоциации4. Протолитическая
- 4. Цели и задачи курсаФормирование основных представлений о
- 5. РеакцииОБРАТИМЫЕ«НЕОБРАТИМЫЕ»Протекают в прямом и обратномнаправлениях:N2 +
- 6. Химическое равновесие ― такое состояние системы реагирующих
- 7. Фазовые равновесия:H2О(ж) H2O(г) –
- 8. Математическое выражение для Kc из закона действующих
- 9. Для гомогенного равновесия (все вещества находятся либо
- 10. "Изменение любого фактора, могущего влиять на состояние
- 11. Влияние различных факторов на равновесиеа А +
- 12. Пример 1.1Определите направление смещения равновесия в реакции:СО2(газ)
- 13. [HI]2 = 50.53 · 10–6[HI] = 7.1
- 14. H2 + I2 2HIx = 0.0022
- 15. Гомогенная реакция аА + bВ
- 16. Протолитические равновесия и процессы в растворах электролитов
- 17. Кислотность и основность«Классическая» теория (С. Аррениус, 1880)Кислота
- 18. Протолитическая теория кислот и оснований (И. Брёнстед,
- 19. Равновесия, устанавливающиеся в растворах между кислотами и
- 20. Если в одновременно существующих равновесиях имеется одна
- 21. Протолитическая теория кислот и оснований
- 22. Степень диссоциации α – доля молекул электролита,
- 23. Петер Дебай1884 - 1966Эрих Хюккель1896 - 1980Сильные
- 24. Ионная сила раствора (I) – количественная характеристика
- 25. Активность a – активная, т.е эффективная, концентрация,
- 26. Коэффициенты активности ионов в водных растворах при
- 27. Водородный показательШкала значений водородного показателя рН Сёрен Педэр Лауриц Сёренсен1868 - 1939Водородный показатель
- 28. Кислотность биологических жидкостей
- 29. Для сильных кислот: рН = – lgС1/z;
- 30. Слабые кислоты Одноосновные (СН3СООН) Двухосновные (Н2СО3) — диссоциируют ступенчатоВодородный показатель
- 31. Слайд 31
- 32. Расчет рН в растворах слабых кислот Пример
- 33. Слабые основания(pH > 7) – lg(K BH+
- 34. Расчет рН в растворах слабых оснований pH
- 35. Гидролитические равновесия в растворах солейСольволиз – процесс
- 36. Отношение солей к гидролизуСоли, образованные катионом сильного
- 37. Константа гидролиза Kh – константа гидролитического равновесия,
- 38. Гидролиз по катионуNH4Cl → NH4+ + Cl–
- 39. Гидролиз по анионуNaNO2 → Na+ + NO2–
- 40. Гидролиз соли по катиону и анионуNН4NO2 →
- 41. Расчет рН в растворах средних солей Пример
- 42. Кислая соль слабой кислоты и сильного основания
- 43. Средние соли многоосновных кислот При расчете рН
- 44. КОНЕЦ ЛЕКЦИИВСЕМ СПАСИБО!!!
- 45. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Неорганическая химия
Курс лекций
для студентов медико-биологического факультета, специальность 30.05.01
«Медицинская
биохимия»
МЕДИЦИНСКИЙ УНИВЕРСИТЕТ им. Н.И.ПИРОГОВАСлайд 2Лекция № 1
Химическое равновесие.
Протолитические равновесия и
процессы в растворах электролитов
Слайд 3Содержание лекции
6. Степень и константа диссоциации
4. Протолитическая теория кислот и
оснований
5. Протолитические равновесия в водных растворах
8. Расчет рН в растворах
сильных и слабых электролитов2. Химическое равновесие . Константа химического равновесия
3. Факторы, влияющие на смещение равновесия. Принцип
Ле Шателье-Брауна. Влияние температуры, давления и катализатора.
1. Введение. Значение химии в системе медицинского образования
7. Гидролитические процессы в растворах солей
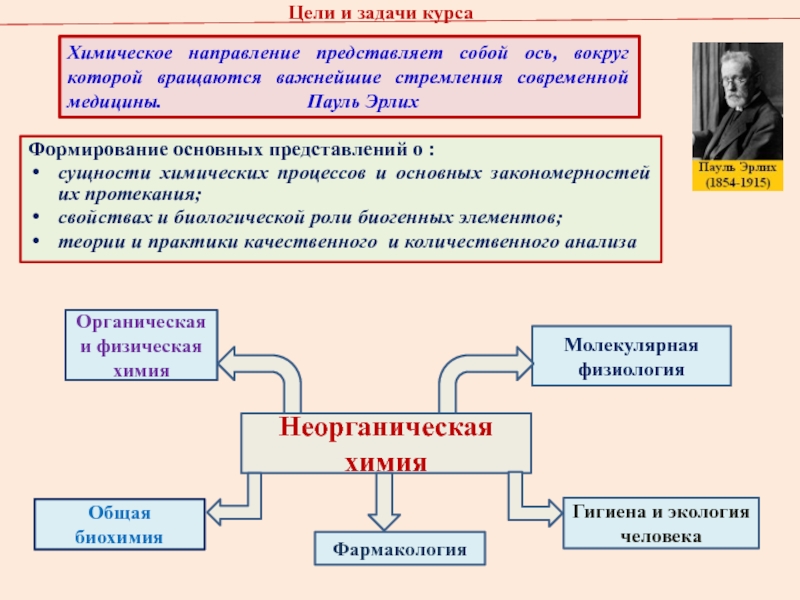
Слайд 4Цели и задачи курса
Формирование основных представлений о :
сущности химических процессов
и основных закономерностей их протекания;
свойствах и биологической роли биогенных
элементов; теории и практики качественного и количественного анализа
Неорганическая химия
Общая биохимия
Фармакология
Гигиена и экология человека
Молекулярная физиология
Органическая и физическая химия
Химическое направление представляет собой ось, вокруг которой вращаются важнейшие стремления современной медицины. Пауль Эрлих
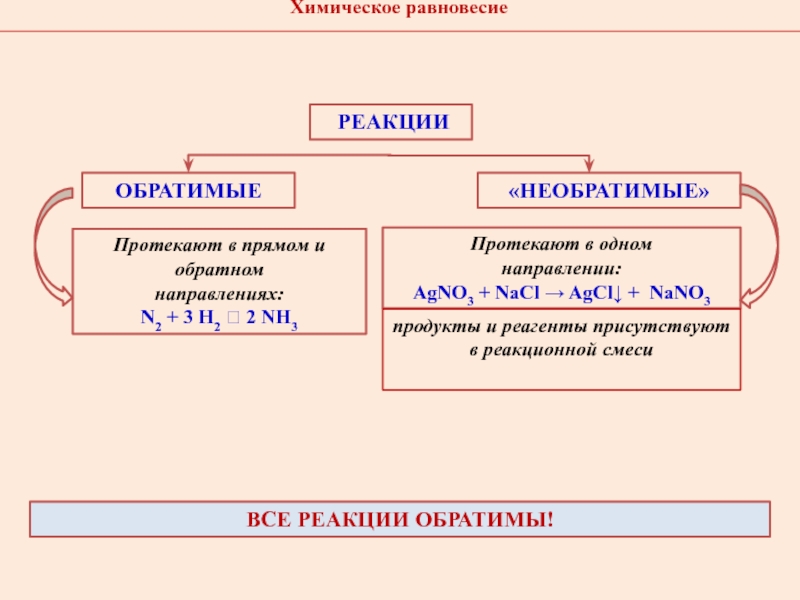
Слайд 5 Реакции
ОБРАТИМЫЕ
«НЕОБРАТИМЫЕ»
Протекают в прямом и обратном
направлениях:
N2 + 3 H2
2 NH3
Протекают в одном
направлении:
AgNO3 + NaCl AgCl
+ NaNO3ВСЕ Реакции обратимы!
Химическое равновесие
продукты и реагенты присутствуют в реакционной смеси
Слайд 6Химическое равновесие ― такое состояние системы реагирующих веществ, при котором
за определенный интервал времени в химическую реакцию вступают точно такие
же количества веществ, сколько их образуется из продуктов реакции.Химическое равновесие
Особенности равновесного состояния
1. Динамический характер: прямая и обратная реакции не прекращаются, а идут с равными скоростями относительно одного и того же вещества;
2. Постоянство состояния во времени при неизменных внешних условиях;
3. Подвижность равновесия – смещение равновесия при изменении внешних условий;
4. Возможен двусторонний подход к состоянию равновесия
Слайд 7Фазовые равновесия:
H2О(ж) H2O(г) – выпаривание – конденсация
Ассоциация
- диссоциация
2NO2(г) N2О4(г) – димеризация–диссоциация
Протолитические равновесия:
HF + H2O
H3O+ + F– – кислотно-основное равновесиеГетерогенные равновесия:
AgCl(тв) Ag+ + Cl– – равновесие в системе осадок – раствор
СO2(г) + Н2О(ж) СО2 ·Н2О (р-р) – растворение газов
Окислительно-восстановительные равновесия:
2Fe3+ + 2I– 2Fe2+ + I2 – окисление-восстановление
Лигандообменные равновесия:
Cu2+ + 4NH3 [Cu(NH3)4]2+ – образование-диссоциация комплекса
Изомеризация:
– циклооксотаутомерия
Примеры равновесных процессов
Химическое равновесие
Слайд 8Математическое выражение для Kc из закона действующих масс:
Гомогенная реакция
аА + bВ сС + dD
Константа равновесия –
количественная характеристика химического равновесия, которая зависит только от температуры и природы реагентов, и не зависит от их начальных концентрацийХимическое равновесие
Концентрации реагирующих веществ в условиях химического равновесия называют равновесными концентрациями и часто обозначают химической формулой вещества, заключенной в квадратные скобки. Например, для обратимой реакции: N2 + 3 H2 2 NH3
равновесные концентрации реагентов обозначаются [N2], [H2] и [NH3].
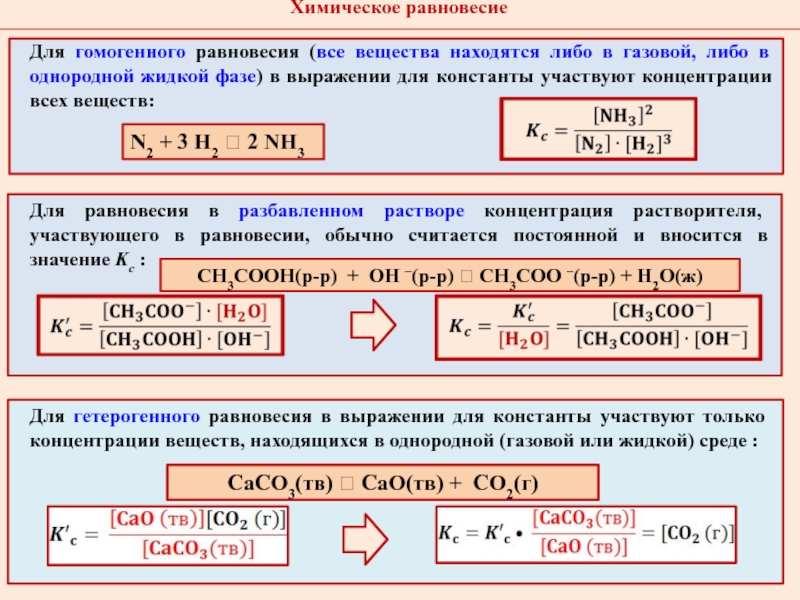
Слайд 9Для гомогенного равновесия (все вещества находятся либо в газовой, либо
в однородной жидкой фазе) в выражении для константы участвуют концентрации
всех веществ:Для равновесия в разбавленном растворе концентрация растворителя, участвующего в равновесии, обычно считается постоянной и вносится в значение Kc :
Для гетерогенного равновесия в выражении для константы участвуют только концентрации веществ, находящихся в однородной (газовой или жидкой) среде :
СаCO3(тв) СaО(тв) + CO2(г)
N2 + 3 H2 2 NH3
CH3COOH(р-р) + OH –(р-р) CH3COO –(р-р) + H2O(ж)
Химическое равновесие
Слайд 10"Изменение любого фактора, могущего влиять на состояние химического равновесия системы
веществ, вызывает в ней реакцию, стремящуюся противодействовать производимому изменению. Повышение
температуры вызывает реакцию, стремящуюся понизить температуру, то есть идущую с поглощением тепла. Увеличение давления вызывает реакцию, стремящуюся вызвать уменьшение давления, то есть сопровождающуюся уменьшением объема...".Лекции А.Л. Ле Шателье, Сорбонна, 1907-1908 гг
Принцип Ле Шателье-Брауна – если на систему, находящуюся в состоянии химического равновесия, оказывается внешнее воздействие, положение равновесия смещается в такую сторону, чтобы противодействовать эффекту этого воздействия
Анри Луи
Ле Шателье
1850 – 1936
Карл Браун
1850 – 1918
Химическое равновесие
Слайд 11Влияние различных факторов на равновесие
а А + b В (больший
объем) с С + d D (меньший
объем), Q > 0Химическое равновесие
Слайд 12Пример 1.1
Определите направление смещения равновесия в реакции:
СО2(газ) + Н2О(ж)
Н2СО3(раствор) + 20 кДж
Давление: р
↑ чтобы понизить возросшее давление →; Концентрация: с(СО2) ↑ чтобы понизить концентрацию →;
Температура (прямая реакция экзотермическая Q > 0, обратная – эндотермическая): Т ↑ при повышении температуры в систему вносится тепло, чтобы его поглотить идет эндотермический процесс ←;
Химическое равновесие
р ↓ ←
с ↓ ←
Т ↓ тепло отбирается из системы →
При изменении а) давления; б) концентрации СО2 и в) температуры
Слайд 13[HI]2 = 50.53 · 10–6
[HI] = 7.1 · 10–3 моль/л
ν(HI) = 7.1 · 10–3 моль
Вычисление концентраций реагентов и продуктов
в условиях равновесияH2(г) + I2(г) 2 HI(г)
Пример 1.2
В колбе объемом 1 л в состоянии равновесия при 448 оС находятся по 1.0·10–3 моль газообразных водорода и иода, какое количество HI находится в колбе? Кс = 50.53
Решение
Химическое равновесие
Слайд 14H2 + I2 2HI
x = 0.0022 моль/л
Пример 1.3
В
колбу объемом 5 л помещено 0.1 моля иодоводорода при 448
оС. Сколько водорода и иода окажется в колбе, когда ее содержимое придет в состояние равновесия? Кс = 50.53Решение
Химическое равновесие
c0(HI) = 0.1/5 = 0.02 моль/л
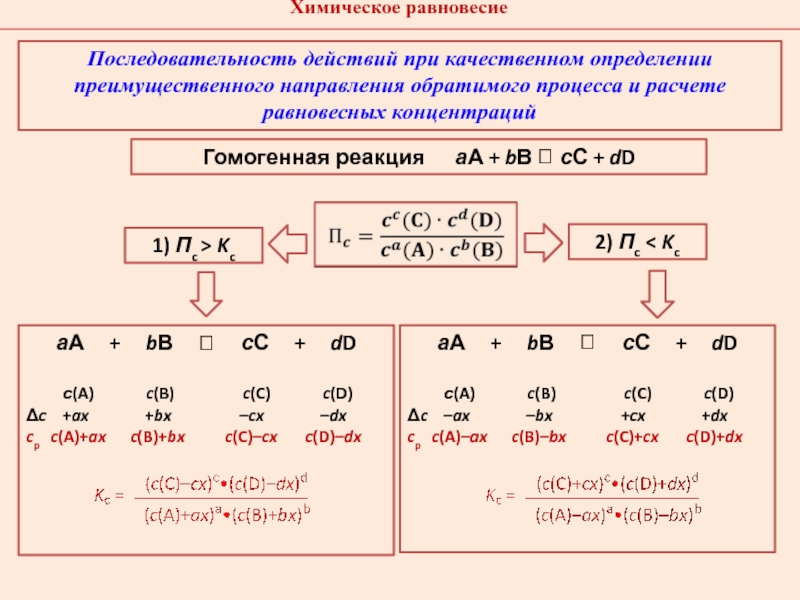
Слайд 15Гомогенная реакция аА + bВ сС +
dD
1) Пc > Kc
2) Пc < Kc
Последовательность действий
при качественном определении преимущественного направления обратимого процесса и расчете равновесных концентрацийаА + bВ сС + dD
с(A) c(B) c(C) c(D)
c +ax +bx –cx –dx
cp c(A)+ax c(B)+bx c(C)–cx c(D)–dx
аА + bВ сС + dD
с(A) c(B) c(C) c(D)
c –ax –bx +cx +dx
cp c(A)–ax c(B)–bx c(C)+cx c(D)+dx
Химическое равновесие
Слайд 17Кислотность и основность
«Классическая» теория (С. Аррениус, 1880)
Кислота – донор протона;
Основание – донор гидроксид-иона;
Амфолит – донор и Н+, и ОН–
Теория кислот и оснований
Электролиты распадаются (диссоциируют) на ионы при растворении, в отсутствии внешнего электрического поля
Ограничения теории Аррениуса
не учитывала химических взаимодействий между растворенным веществом и растворителем;
не учитывала межионные взаимодействия;
не могла объяснить кислотно-основные свойства частиц, не содержащих Н+ и ОН– (NH3, CО2, пиридин и т.д.)
Слайд 18Протолитическая теория кислот и оснований (И. Брёнстед, Т. Лоури, 1923)
Кислота
– молекула или ион, способные служить донором протона:
Нейтральные кислоты –
HCl, H2SO4, HCN и дрАнионные кислоты – HSO32–, H2PO4– и др.
Катионные кислоты – NH4+, H3O+, аквакомплексы металлов [Cu(H2O)4]2+
Основание – молекула или ион, способные присоединить протон, т.е. акцептор протона:
Нейтральные основания – NH3, H2O, C5H5N др.
Анионные основания – Cl–, CH3COO– и др.
Амфолиты – вещества, способные как отдавать, так и присоединять протон, т. е. реагировать и как кислоты и как основания ( H2O, HCO3–, +H3NCH2COO–, HPO42– )
Кислота и сопряженное ей основание составляют сопряженную кислотно-основную пару: СН3СООН/СН3СОО – , (НА/А – ), NH4+/NH3 (BH +/B)
Чем сильнее кислота, тем слабее сопряженное ей основание и наоборот
3. Кислотные свойства веществ проявляются только в присутствии основания, основные – в присутствии кислоты
Протолитическая теория кислот и оснований
Слайд 19Равновесия, устанавливающиеся в растворах между кислотами и сопряженными основаниями, называются
протолитическими
К протолитическим реакциям относятся:
– процессы диссоциации кислот:
СН3СООН +
Н2О ⇄ СН3СОО– + Н3О+кислота1 основание2 сопряженное сопряженная
основание1 кислота2
– ионизация оснований:
NН3 + Н2О ⇄ NH4+ + OH–
основание1 кислота2 сопряженная сопряженное
кислота1 основание2
– гидролиз солей:
СН3СООNa → Na+ + CH3COO–
СН3СОО– + Н2О ⇄ СН3СООН + OH–
основание1 кислота2 сопряженная сопряженное
кислота1 основание2
Протолитическая теория кислот и оснований
Протолитические равновесия всегда(!) смещены в сторону образования более слабых кислот или оснований.
Слайд 20Если в одновременно существующих равновесиях имеется одна или несколько общих
частиц, то говорят о совмещенных (сопряженных, конкурирующих) равновесиях:
HCl + Н2О
⇄ Н3О+ + Cl –НСООН + Н2О ⇄ НСОО– + Н3О+
Несколько одновременно существующих равновесий называются простыми (изолированными), если они независимы друг от друга, т.е. не имеют общих частиц:
HCl + Н2О ⇄ Н3О+ + Cl –
CaSO4 ⇄ Ca2+ + SO42 –
←
→
Протолитическая теория кислот и оснований
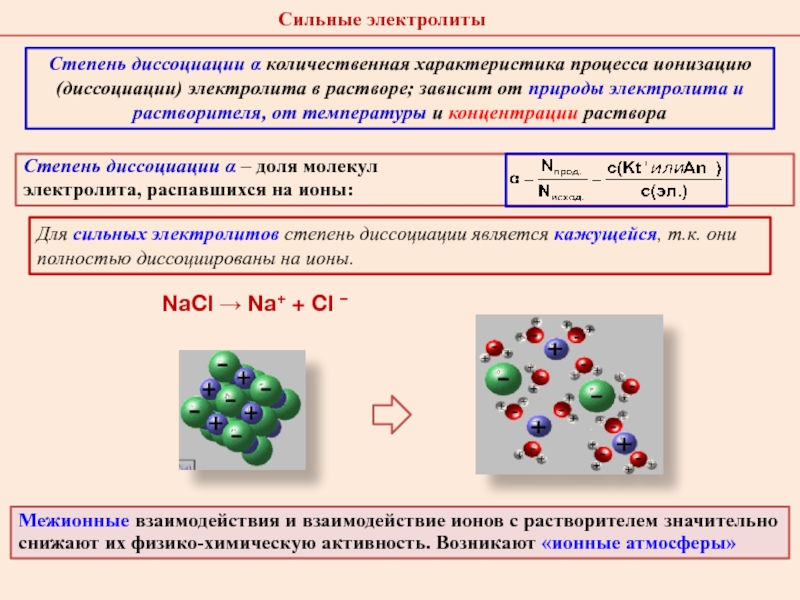
Слайд 22Степень диссоциации α – доля молекул
электролита, распавшихся на ионы:
Для сильных электролитов степень диссоциации является кажущейся, т.к. они полностью
диссоциированы на ионы. NaCl Na+ + Cl –
Межионные взаимодействия и взаимодействие ионов с растворителем значительно снижают их физико-химическую активность. Возникают «ионные атмосферы»
Сильные электролиты
Степень диссоциации α количественная характеристика процесса ионизацию (диссоциации) электролита в растворе; зависит от природы электролита и растворителя, от температуры и концентрации раствора
Слайд 23Петер Дебай
1884 - 1966
Эрих Хюккель
1896 - 1980
Сильные электролиты в растворах
практически полностью диссоиированы на ионы
В первом приближении теории ионы рассматриваются
как точечные заряды, без учета их масс, реальных размеров, наличия гидратной оболочкиИоны не взаимодействуют с молекулами растворителя
Диэлектрическая проницаемость раствора принята равной диэлектрической проницаемостью чистого растворителя
Между ионами в растворе действуют только силы кулоновского взаимодействия. Ионы распределены в растворе не хаотично, а среднее между упорядоченным за счет кулоновских взаимодействий и разупорядоченным за счет теплового движения
Вокруг каждого иона формируется ионная атмосфера из противоположно заряженных ионов
Основные положения и допущения теории
сильных электролитов Дебая – Хюккеля (1923 г.)
Сильные электролиты
Слайд 24Ионная сила раствора (I) – количественная характеристика интенсивности межионных взаимодействий
– величина, характеризующая интенсивность электростатического поля всех ионов в растворе
Пример
2.1: Для раствора, содержащего 0.1 М CaCl2 и 0.2 М KCl
b – моляльная концентрация иона [моль/кг,] z – его заряд;
для разбавленных водных растворов bi ≈ ci
(ci – молярная концентрация раствора [моль/л])
Сильные электролиты
Слайд 25Активность a – активная, т.е эффективная, концентрация, в соответствии с
которой электролит ведет себя в различных процессах
a = fа ·
cfа – коэффициент активности (мера различия поведения электролита в данном растворе и в растворе, принятом за идеальный)
Сильные электролиты
Правило ионной силы (Г.Льюис и М.Рендалл): в разбавленных растворах сильных электролитов с одинаковой ионной силой (не выше 0.01-0.02 моль/л) коэффициенты активности катионов и анионов одинакового заряда равны независимо от их химической природы
fа < 1; a < c;
Гилберт Ньютон
Льюис (1875-1946)
с 0, fа 1, a c
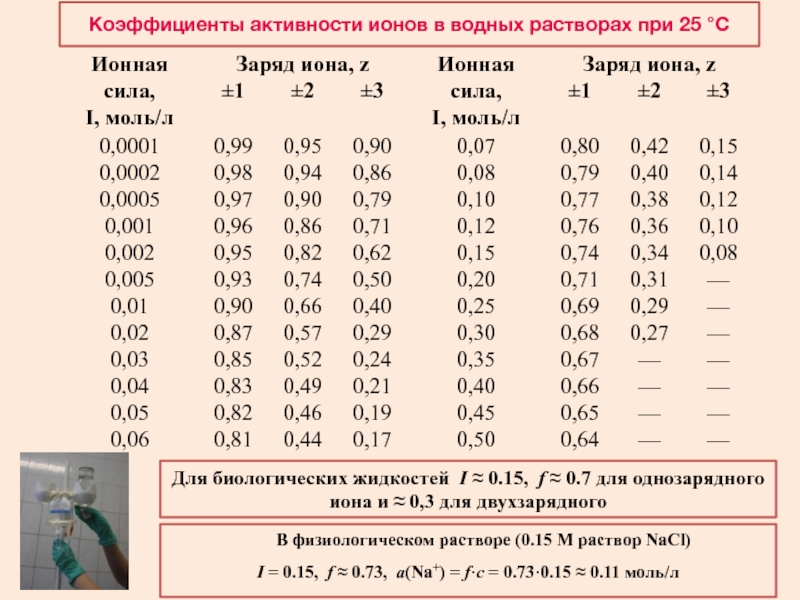
Слайд 26Коэффициенты активности ионов в водных растворах при 25 С
Для биологических
жидкостей I 0.15, f 0.7 для однозарядного иона
и 0,3 для двухзарядногоВ физиологическом растворе (0.15 М раствор NaCl)
I = 0.15, f 0.73, a(Na+) = f·c = 0.73·0.15 0.11 моль/л
Слайд 27Водородный показатель
Шкала значений водородного показателя рН
Сёрен Педэр
Лауриц Сёренсен
1868
- 1939
Водородный показатель
Слайд 29Для сильных кислот: рН = – lgС1/z; т.к. [H+] =
C1/z, отсюда С1/z = 10–рН
Для щелочей: рOН =
– lgС1/z; рН =14 + lgС1/z , отсюда С1/z = 10–рОНВодородный показатель
Расчет рН и рОН в растворах сильных кислот и оснований
Пример 2.2 Рассчитайте рН 0.001М раствора NaOH.
Решение:
pOH = – lg 10–3 = 3, тогда pH = 14 – pOH = 14 – 3 = 11
Пример 2.3 Определите концентрацию гидроксида калия в растворе, в котором значение рН равно 9.5. Расчет вести без учета коэффициентов активности.
Решение:
Из ионного произведения воды: рН + рОН =14,
отсюда рОН = 14 – 9.5 = 4.5. Тогда [OH–] = 10–4,5 = 3,16.10–5 (моль/л)
Слайд 30Слабые кислоты
Одноосновные (СН3СООН)
Двухосновные (Н2СО3) —
диссоциируют ступенчато
Водородный показатель
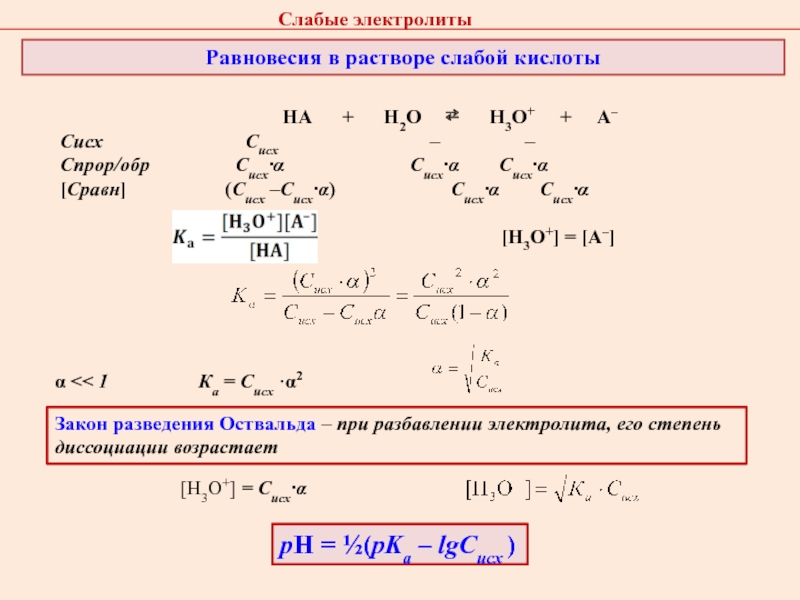
Слайд 31
НА + Н2О ⇄ Н3О+ + А–
Сисх Cисх – –
Спрор/обр Cисх·α Cисх·α Cисх·α
[Сравн] (Сисх –Cисх·α) Cисх·α Cисх·α
[Н3О+] = Cисх·α
α << 1
Закон разведения Оствальда – при разбавлении электролита, его степень диссоциации возрастает
[Н3О+] = [А–]
Ка = Сисх ·α2
рН = ½(рKа – lgCисх )
Равновесия в растворе слабой кислоты
Слабые электролиты
Слайд 32Расчет рН в растворах слабых кислот
Пример 2.4 Рассчитать рН
в 0.1 М растворе CH3COOH (pKa = 4.76)
Для расчета рН
растворов многоосновных кислот обычно используют первую константу кислотности (Kа1)
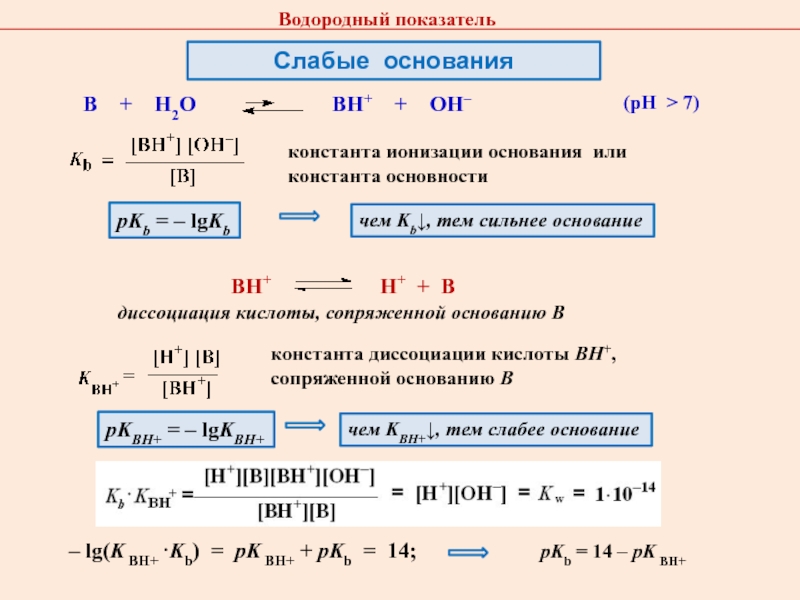
Слайд 33Слабые основания
(pH > 7)
– lg(K BH+ ·Kb) = pK
BH+ + pKb = 14;
диссоциация кислоты, сопряженной основанию В
Водородный
показательpKb = – lgKb
чем Kb↓, тем сильнее основание
pKBH+ = – lgKBH+
чем KBH+↓, тем слабее основание
pKb = 14 – pK BH+
Слайд 34Расчет рН в растворах слабых оснований
pH = ½(14 +
pKBH+ + lgcB) = ½(14 + 9.25 + lg10–2) =
½(14 + 9.25 – 2) = 10.63Пример 2.5 Рассчитать рН в 0.01 М растворе аммиака (pKBH+ = 9.25)
pH = ½(14 + pKBH+ + lgCB)
pOH = ½(pKb – lgСB)
pH = 14 – pOH = 14 – ½(pKb – lgСB)
pKb = 14 – pK BH+
pH = 14 – ½(14 – pK BH+ – lgcB)
Сисх CB – –
Спрор/обр (– CB·α) + CB·α + CB·α
[Сравн] (СB –CB·α) ≈ СB CB·α CB·α
т. к. [ОН–] = [ВН+]
Слайд 35Гидролитические равновесия в растворах солей
Сольволиз – процесс взаимодействия растворенного вещества
с ионами, образующимися при ионизации молекул растворителя
Гидролиз – частный случай
сольволиза – процесс взаимодействия ионов растворенной соли с Н+ или ОН– нейтральных молекул водыCu(H2O)4]2+ + Н2O ⇄ [Cu(OH)(H2O)3]+ + H3O+
Cu2+ + 2 H2O ⇄ Cu(OH)+ + H3O+
Не путать гидролиз с гидратацией(!):
Cu2+ + 4 H2O → [Cu(H2O)4]2+
или
Слайд 36Отношение солей к гидролизу
Соли, образованные катионом сильного основания и сильной
кислоты, гидролизу не подвергаются; рН их
растворов ≈ 7Примеры: K2SO4; LiCl; Na2CrO4; KMnO4; AgNO3 и т.д.
Соли, образованные катионом слабого основания и анионом сильной кислоты, гидролизуются по катиону; рН их растворов < 7
Примеры: NH4NO3; CuSO4; CoCl2; Fe2(SO4)3; CrCl3 и т.д.
Соли, образованные катионом сильного основания и анионом слабой кислоты, гидролизуются по аниону; рН р-ра > 7
Примеры: Na2SO3; CH3COOLi; NaCN; K2CO3 и т.д.
Соли, образованные катионом слабого основания и анионом слабой кислоты, гидролизуются по катиону и аниону; рН их растворов определяется силовыми характеристиками кислоты и основания Ka и Kb
Примеры: NH4NO2; (CH3COO)2Cu и др.
Гидролитические равновесия в растворах солей
Слайд 37Константа гидролиза Kh – константа гидролитического равновесия, характеризующая процесс гидролиза
Степень
гидролиза h – количественная характеристика полноты взаимодействия ионов слабого электролита,
образующихся при диссоциации соли, с водойNH4NO3 → NH4+ + NO3–
NH4+ + H2O ⇄ NH3 + H3O+
h увеличивается при разбавлении и повышении температуры
Гидролитические равновесия в растворах солей
Количественные характеристики гидролиза
Слайд 38Гидролиз по катиону
NH4Cl → NH4+ + Cl–
NH4+ + H2O
⇄ NH3 + H3O+
Kw
1/Kb(NH3)=KBH+
для солей, гидролизующихся по катиону
pH=
–lg(KBH+·Cc)1/2 = 1/2(–lgKBH+ –lgCc ) = 1/2(pKBH+ – lgCc)Слайд 39Гидролиз по аниону
NaNO2 → Na+ + NO2–
NO2– + H2O
⇄ HNO2 + OH–
Kw
1/Ka(HNO2)
для солей, гидролизующихся по аниону
pOH=
–lg(Kw·Cc/Ka)1/2 = 1/2(–lgKw –lgCc –(–lgKa)) = 1/2(14–pKa–lgCc)pH=14 – pOH= 14 – 1/2(14 – pKa–l gCc)= 1/2 (28 –14 + pKa+ lgCc) = 1/2 (14+pKa+lgCc)
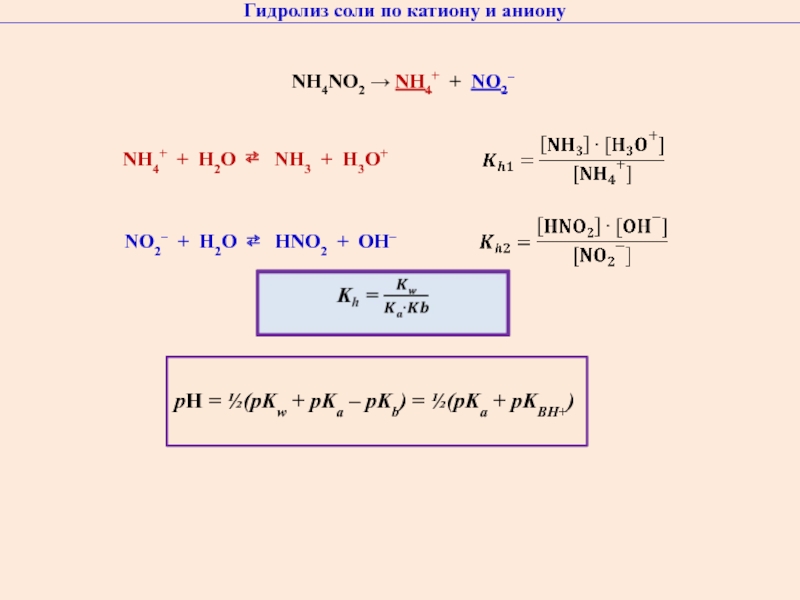
Слайд 40Гидролиз соли по катиону и аниону
NН4NO2 → NH4+ + NO2–
NO2– + H2O ⇄ HNO2 + OH–
NH4+ +
H2O ⇄ NH3 + H3O+
pH = ½(pKw + pKa – pKb) = ½(pKa + pKBH+)
Слайд 41Расчет рН в растворах средних солей
Пример 2.6 Рассчитать
рН в 1 М растворе NH4Cl
(pKBH+ = 9.2).Пример 2.7 Рассчитать рН в 0.01 М растворе CH3COONH4;
pKa (СН3СООН) = 4.76, pKBH+ (NH3) = 9.24).
pH раствора зависит от соотношения значений pKa и pKBH+
(pH = 7)
среда нейтральная
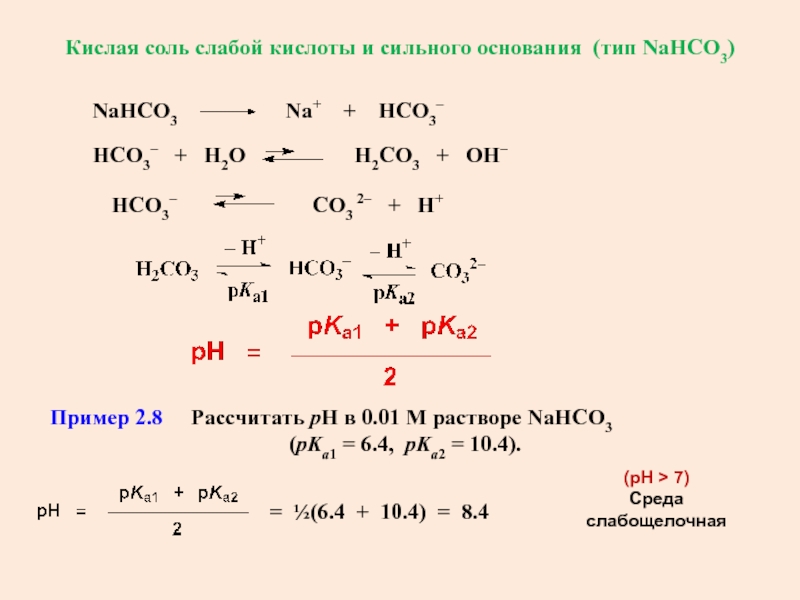
Слайд 42Кислая соль слабой кислоты и сильного основания (тип NaНCO3)
Пример 2.8
Рассчитать рН в 0.01 М растворе NaHCO3
(pKa1 = 6.4, pKa2 = 10.4).(pH > 7)
Среда слабощелочная
Слайд 43Средние соли многоосновных кислот
При расчете рН растворов средних солей
многоосновных кислот
используется pKa для последней ступени диссоциации
Пример 2.9
Рассчитать
рН 0.01 М раствора Na2CO3 (рКа1 = 6.36, рКа2 = 10.33).Решение
Na2CO3 CO32– + 2 Na+; CO32– + H2O HCO3– + OH–
(pH > 7)
pH = ½(14 + pKa2 + lgСсоли) = ½(14 + 10.33 + lg10 2) = 11.17









![Неорганическая химия
Курс лекций для студентов медико-биологического [HI]2 = 50.53 · 10–6[HI] = 7.1 · 10–3 моль/л ν(HI) [HI]2 = 50.53 · 10–6[HI] = 7.1 · 10–3 моль/л ν(HI) = 7.1 · 10–3 мольВычисление концентраций](/img/thumbs/e4a474afeeb04bbb3f69b455447e3083-800x.jpg)












![Неорганическая химия
Курс лекций для студентов медико-биологического Для сильных кислот: рН = – lgС1/z; т.к. [H+] = C1/z, Для сильных кислот: рН = – lgС1/z; т.к. [H+] = C1/z, отсюда С1/z = 10–рН Для](/img/tmb/4/324324/1136e115d78ee16ab32fb5a3ff754728-800x.jpg)