Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Неорганические и органические основания
Содержание
- 1. Неорганические и органические основания
- 2. Цель урока: обобщение, систематизация и углубление знаний о составе, классификации и свойствах оснований.
- 3. Основания - это…По структурной теории—это сложные вещества,
- 4. Согласно протолитической теории Брёнстеда-Лоуриоснования-это молекулы или ионы,
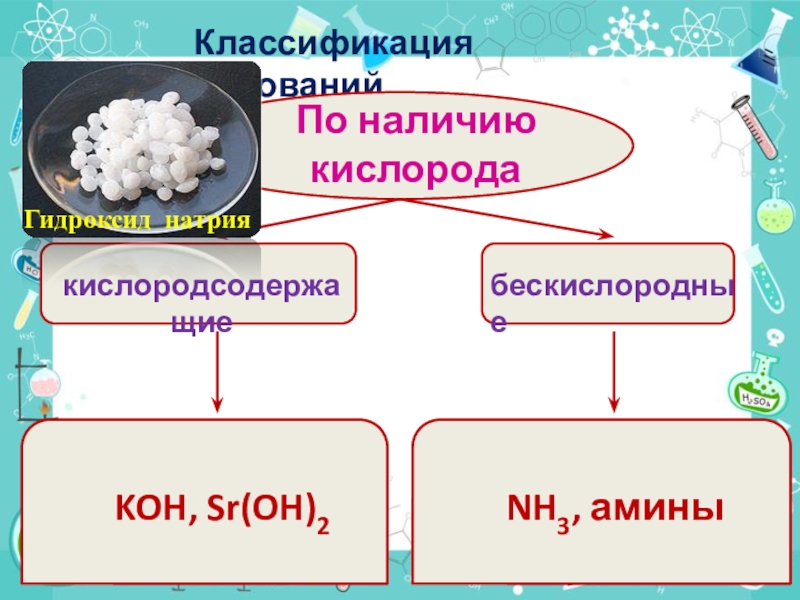
- 5. Классификация основанийПо наличию кислородакислородсодержащиебескислородные KOH, Sr(OH)2 NH3, аминыГидроксид натрия
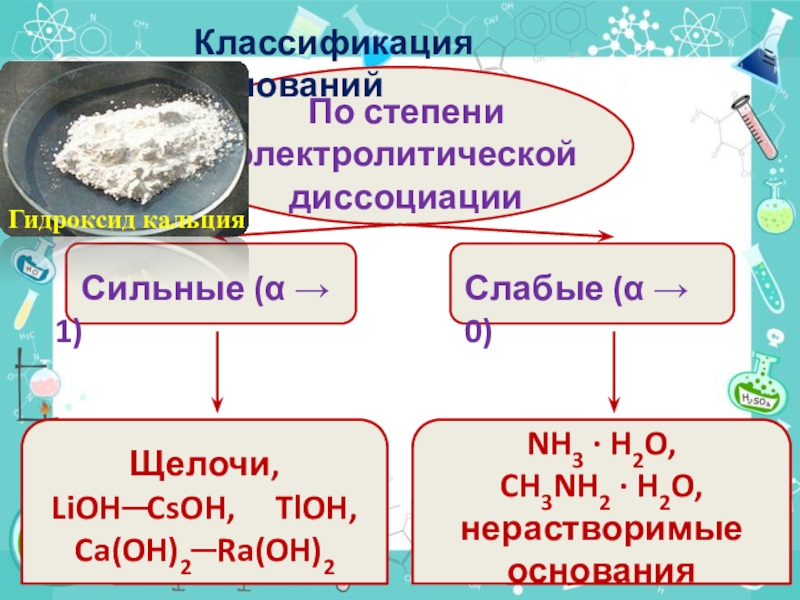
- 6. По степени электролитической диссоциации Сильные (α
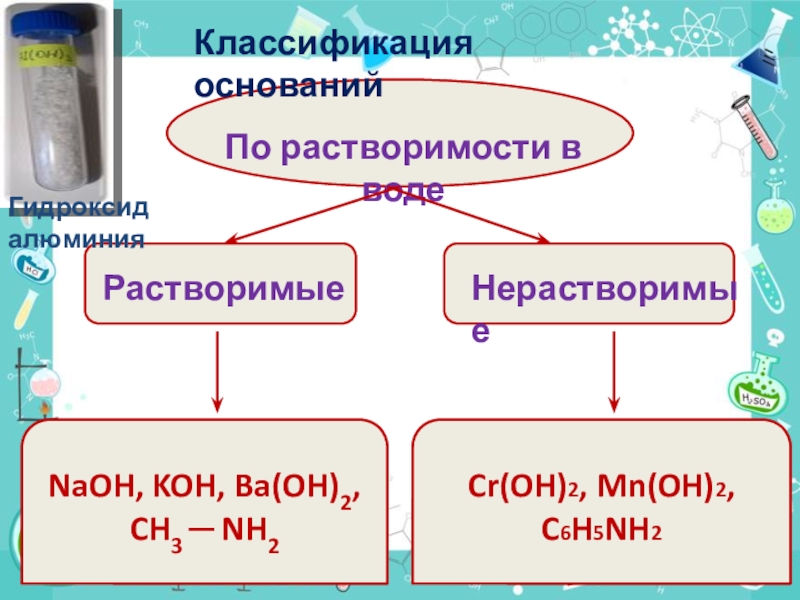
- 7. По растворимости в воде РастворимыеНерастворимыеNaOH, KOH, Ba(OH)2, CH3 ─ NH2Cr(OH)2, Mn(OH)2,C6H5NH2Классификация основанийГидроксид алюминия
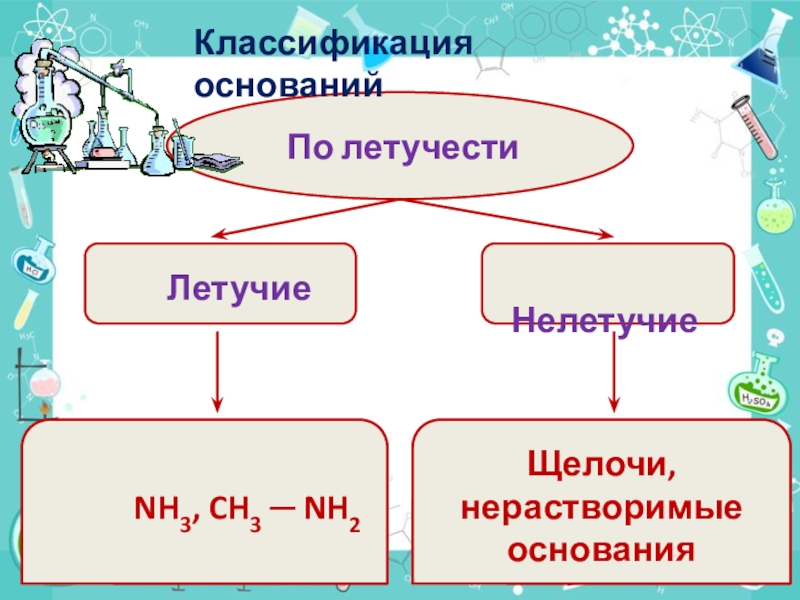
- 8. По летучести
- 9. По стабильности Стабильные Нестабильные
- 10. По кислотности (число групп ОН¯в составе или
- 11. Свойства щелочейВодные растворы щелочей мылкие на ощупь,
- 12. Свойства щелочей3)Взаимодействие с кислотами - реакция нейтрализацииNH3 + HCl = NH4ClCH3NH2 + HCl → [CH3NH3]+Cl-хлорид метиламмония
- 13. Свойства щелочейМногокислотные основания могут давать в таких реакциях как средние так и основные соли
- 14. Свойства щелочей4) Взаимодействие с кислотными оксидами Ca(OH)2 +
- 15. 6) Взаимодействие с амфотерными гидроксидами и оксидамиа)
- 16. Свойства щелочей7) Вступают в реакции с некоторыми
- 17. Разложение нерастворимых оснований при нагреванииCu(OH)2 = CuO + H2O2Al(OH)3 = Al2O3 + 3H2OСвойства нерастворимых оснований
- 18. Химические свойства аминовОсновные свойства:а)СН3NH2 + H2O =
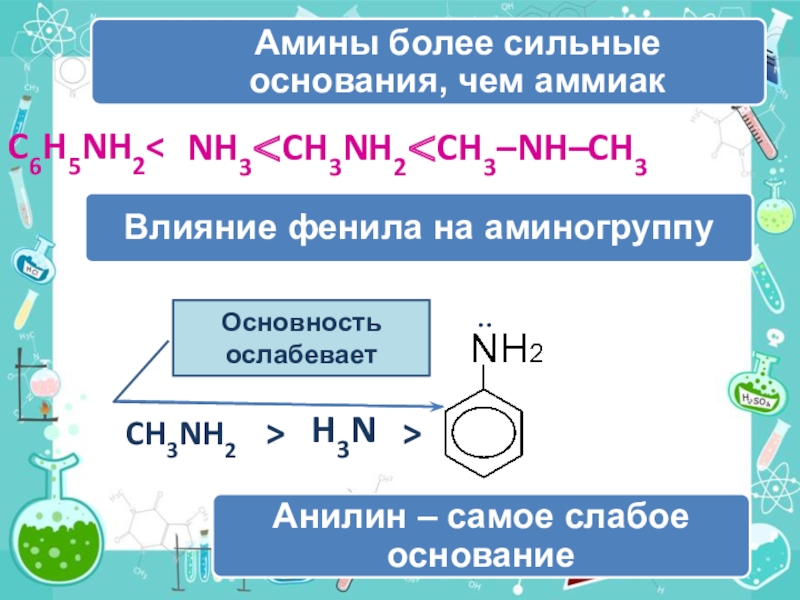
- 19. :CH3NH2>H3N>Основность ослабеваетNH3
- 20. Уменьшение электронной плотности на атоме азота приводит
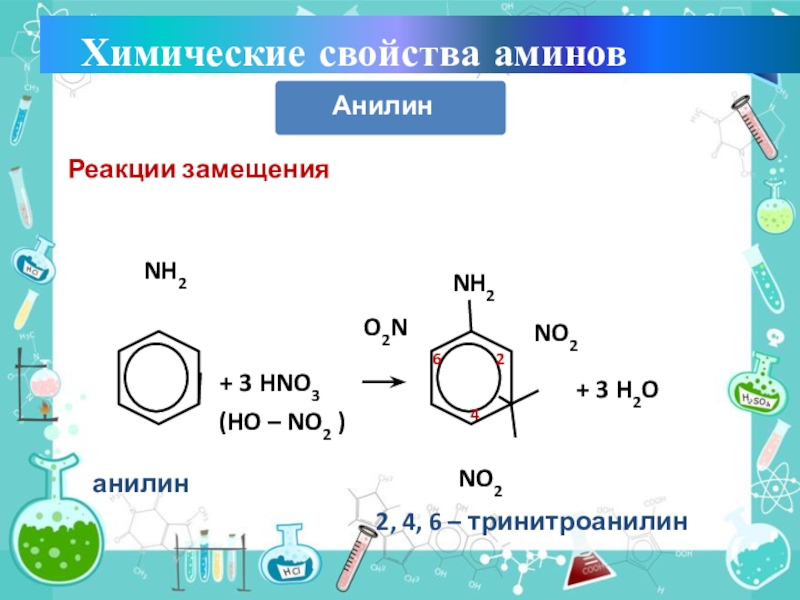
- 21. Реакции замещенияNH2+ 3 HNO3(HO – NO2 )NH2NO2NO2O2N+ 3 H2O2462, 4, 6 – тринитроанилинанилин Химические свойства аминовАнилин
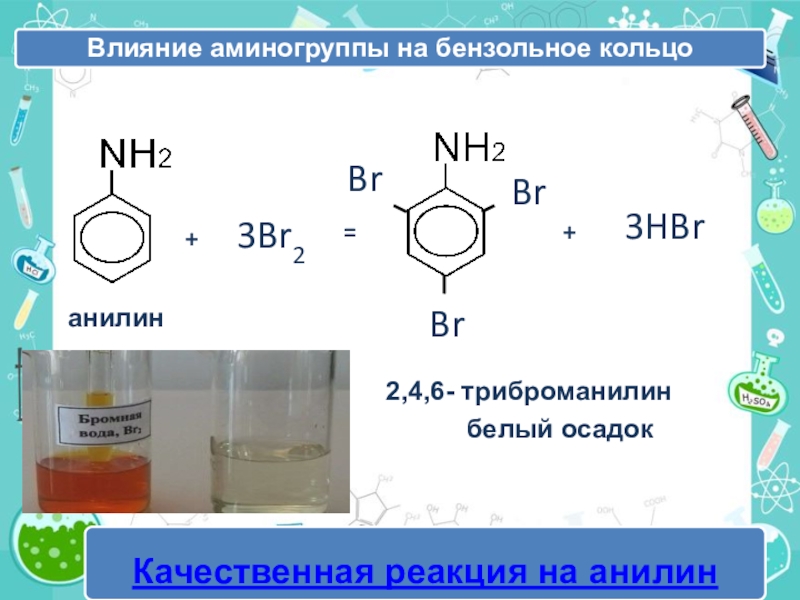
- 22. +3Br2=BrBrBrанилин3HBr+2,4,6- триброманилин белый осадокбелый
- 23. Применение оснований
- 24. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Цель урока: обобщение, систематизация и углубление знаний о составе, классификации
и свойствах оснований.
Слайд 3Основания - это…
По структурной теории—это сложные вещества, в состав которых
входят атомы металла, связанные с одной или несколькими гидроксогруппами (в
зависимости от степени окисления металла)По теории ТЭД –это электролиты, которые образуют в качестве отрицательных ионов только гидроксид –анионы
Слайд 4Согласно протолитической теории Брёнстеда-Лоури
основания-это молекулы или ионы, которые являются акцепторами
катионов водорода Н+ протонов.
Электронная теория Г.Н. Льюиса
основания-это вещества, имеющие неподелённые
электронные пары, донируя которые они могут образовывать ковалентные связи с каким-либо атомом, молекулой или иономСлайд 5Классификация оснований
По наличию кислорода
кислородсодержащие
бескислородные
KOH, Sr(OH)2
NH3, амины
Гидроксид
натрия
Слайд 6По степени электролитической диссоциации
Сильные (α → 1)
Слабые (α
→ 0)
Щелочи, LiOH─CsOH, TlOH, Ca(OH)2─Ra(OH)2
NH3 · H2O,
CH3NH2
· H2O, нерастворимые основанияКлассификация оснований
Гидроксид кальция
Слайд 7По растворимости в воде
Растворимые
Нерастворимые
NaOH, KOH, Ba(OH)2,
CH3 ─ NH2
Cr(OH)2, Mn(OH)2,
C6H5NH2
Классификация оснований
Гидроксид алюминия
Слайд 8По летучести
Летучие
Нелетучие
NH3, CH3 ─ NH2
Щелочи,
нерастворимыеоснования
Классификация оснований
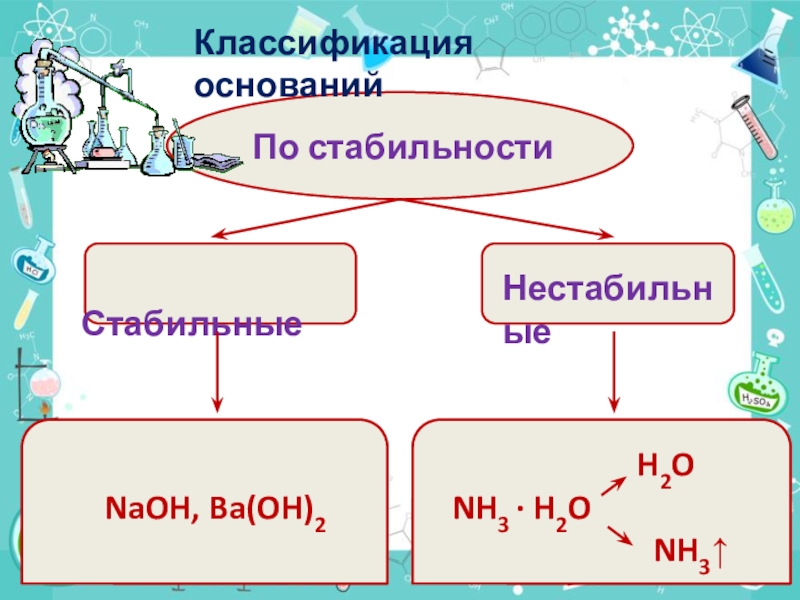
Слайд 9По стабильности
Стабильные
Нестабильные
NaOH, Ba(OH)2
H2O NH3 · H2O
NH3↑
Классификация оснований
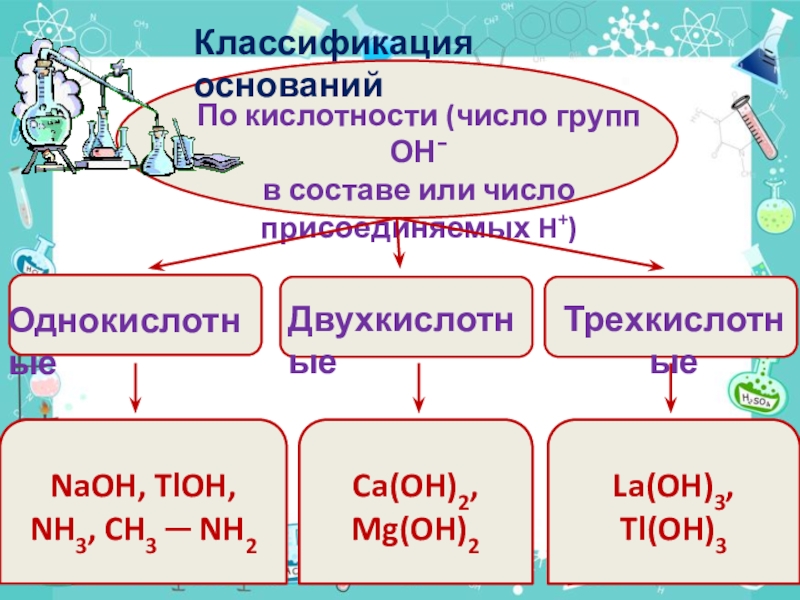
Слайд 10По кислотности (число групп ОН¯
в составе или число присоединяемых H+)
NaOH,
TlOH, NH3, CH3 ─ NH2
Ca(OH)2,
Mg(OH)2
La(OH)3, Tl(OH)3
Однокислотные
Двухкислотные
Трехкислотные
Классификация оснований
Слайд 11Свойства щелочей
Водные растворы щелочей мылкие на ощупь,
разъедают кожу, ткань.
Изменяют
окраску индикаторов: Лакмус – синий,
фенолфталеин малиновый
2) Диссоциация
Химические свойства
Слайд 12Свойства щелочей
3)Взаимодействие с кислотами - реакция нейтрализации
NH3 + HCl =
NH4Cl
CH3NH2 + HCl → [CH3NH3]+Cl-
хлорид метиламмония
Слайд 13Свойства щелочей
Многокислотные основания могут давать в таких реакциях как средние
так и основные соли
Слайд 14Свойства щелочей
4) Взаимодействие с кислотными оксидами
Ca(OH)2 + CO2 = CaCO3
+ H2O
Са(ОН)2 + СО2(изб) = Са(НСО3)2
5) С растворами солей, если
в результате образуется осадок или газFeCI3 + 3NaOH = Fe(OH)3↓ + 3NaCl
2NH4Cl+Ca(OH)2 =CaCl2 +2NH3↑+2H2O
Fe3+ + 3OH- = Fe(OH)3↓
Слайд 156) Взаимодействие с амфотерными гидроксидами и оксидами
а) при сплавлении:
2NaOH +
ZnO = Na2ZnO2 + H2O
2NaOH + Zn(OH)2 = Na2ZnO2 +
2H2Oб) в растворах:
2NaOH + H2O + ZnO = Na2[Zn(OH)4]
2NaOH + Zn(OH)2 = Na2[Zn(OH)4]
Свойства щелочей
Слайд 16Свойства щелочей
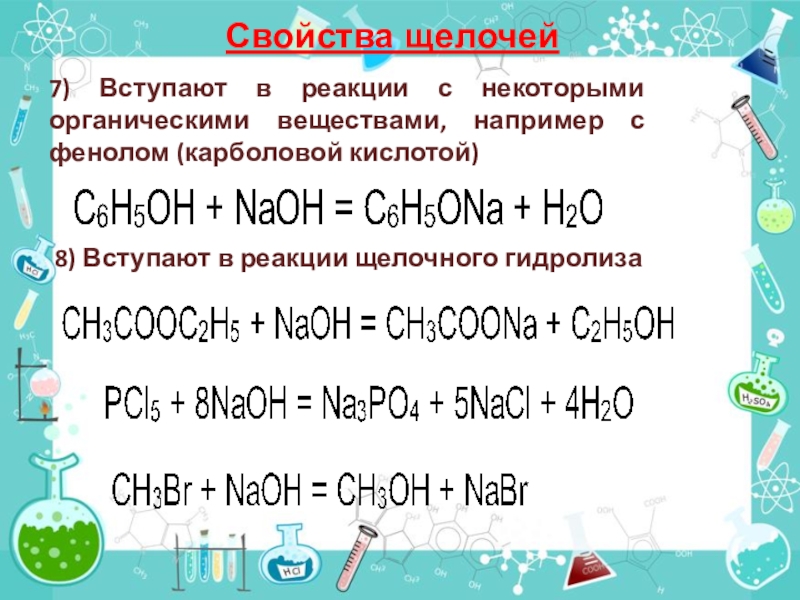
7) Вступают в реакции с некоторыми органическими веществами, например
с фенолом (карболовой кислотой)
8) Вступают в реакции щелочного гидролиза
Слайд 17Разложение нерастворимых оснований при нагревании
Cu(OH)2 = CuO + H2O
2Al(OH)3 =
Al2O3 + 3H2O
Свойства нерастворимых оснований
Слайд 18Химические свойства аминов
Основные свойства:
а)СН3NH2 + H2O = СН3NH3OH
Этиламин
гидроксид метиламмонияб)(С2Н5)2NH + HСl = (С2Н5)2NH2Cl
Диэтиламин хлорид диэтиламмония
видеоопыт
Слайд 20Уменьшение электронной плотности на атоме азота приводит к снижению способности
отщеплять протоны от слабых кислот. Поэтому анилин взаимодействует лишь с
сильными кислотами (HCl, H2SO4), а его водный раствор не окрашивает лакмус в синий цвет.Аминогруппа - заместитель 1-го рода (активирующий орто-пара-ориентант в реакциях электрофильного замещения в ароматическом ядре).
Такое взаимное влияние атомов в молекуле анилина объясняется сопряжением p-электронов бензольного кольца с неподеленной электронной парой атома азота (+M-эффект аминогруппы):
Химические свойства аминов
Анилин





![Неорганические и органические основания Свойства щелочей3)Взаимодействие с кислотами - реакция нейтрализацииNH3 + HCl = NH4ClCH3NH2 + HCl → [CH3NH3]+Cl-хлорид метиламмония Свойства щелочей3)Взаимодействие с кислотами - реакция нейтрализацииNH3 + HCl = NH4ClCH3NH2 + HCl → [CH3NH3]+Cl-хлорид метиламмония](/img/tmb/7/654383/f2b64a697b17993d1b21d3de262004c0-800x.jpg)