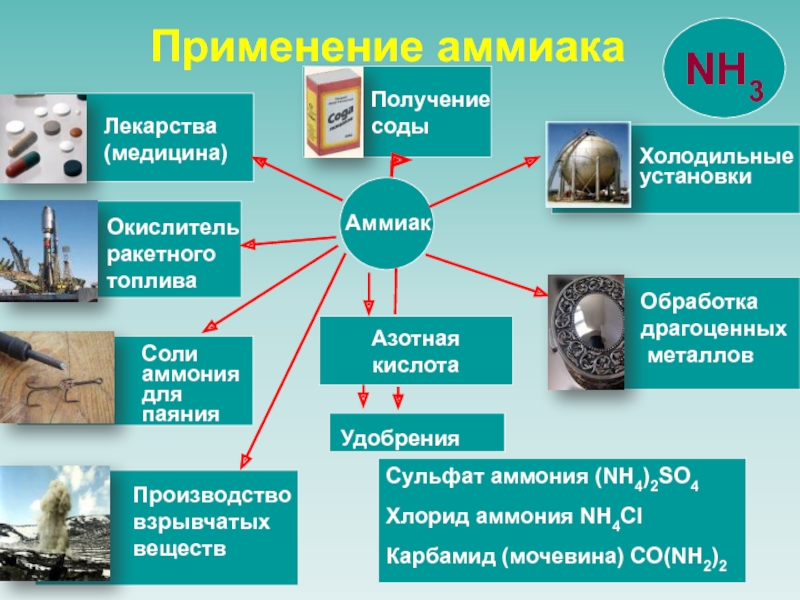
г. английским химиком
Джозефом Луи Пристли.
Он нагревал
аммониак (хлорид аммония) с гашеной известью (гидроксид кальция).
1711-1794 г.
Пристли назвал газ «щелочным воздухом
или летучей щелочью»,
поскольку водный раствор
аммиака имел все признаки щелочи.



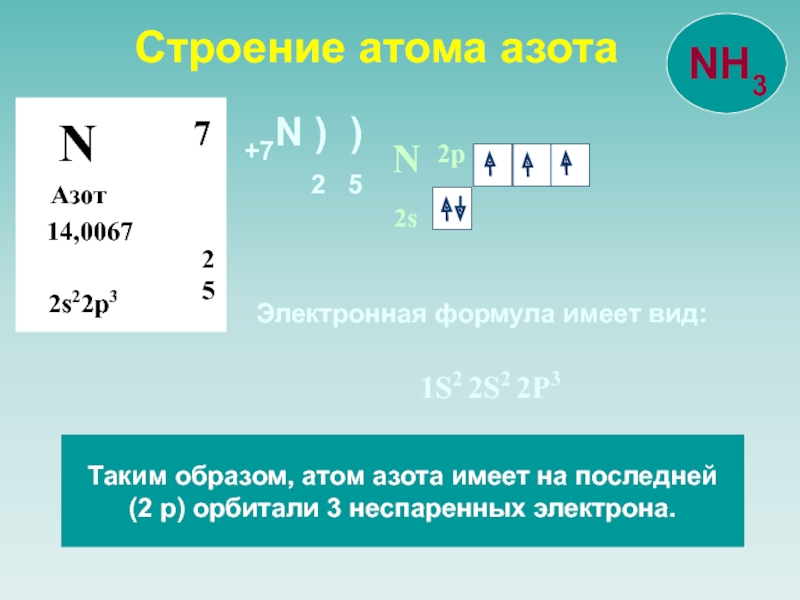
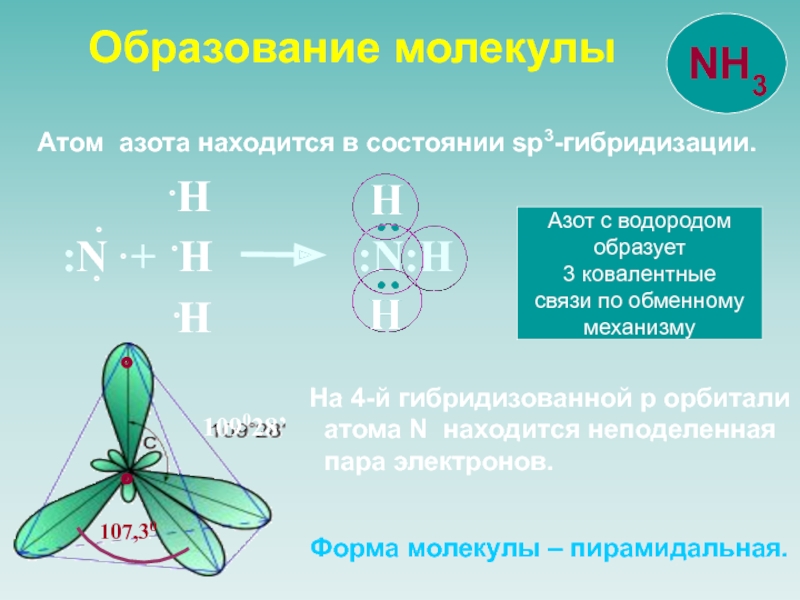
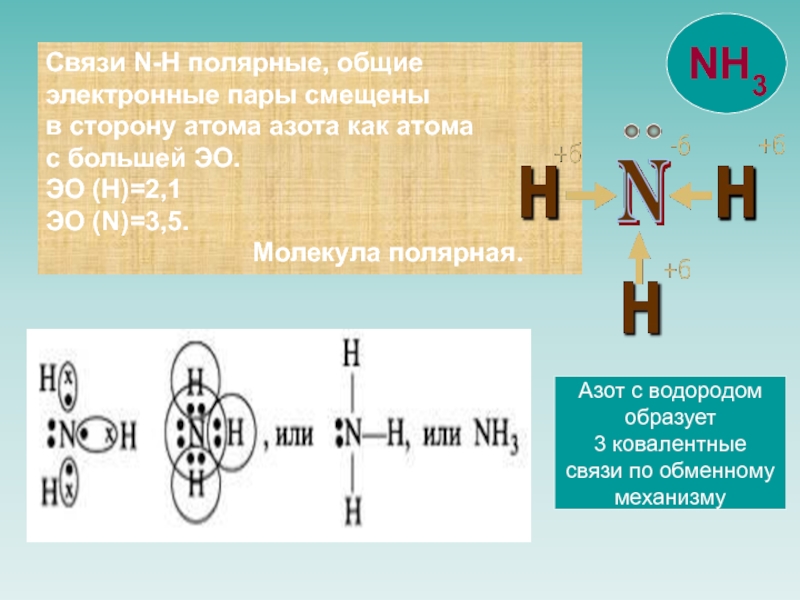
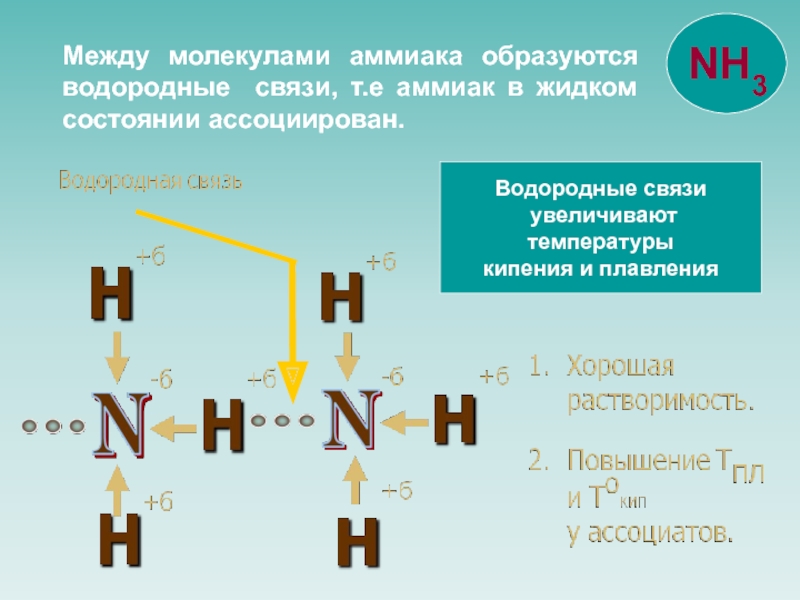
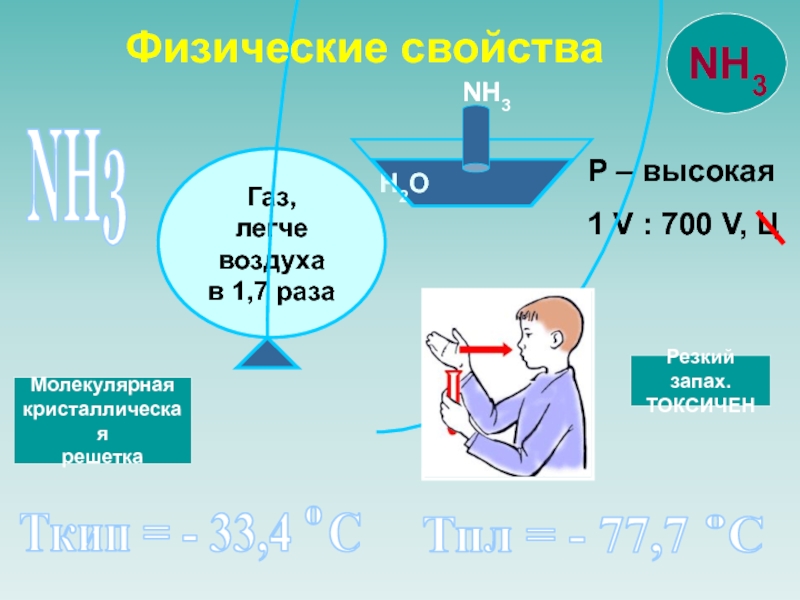




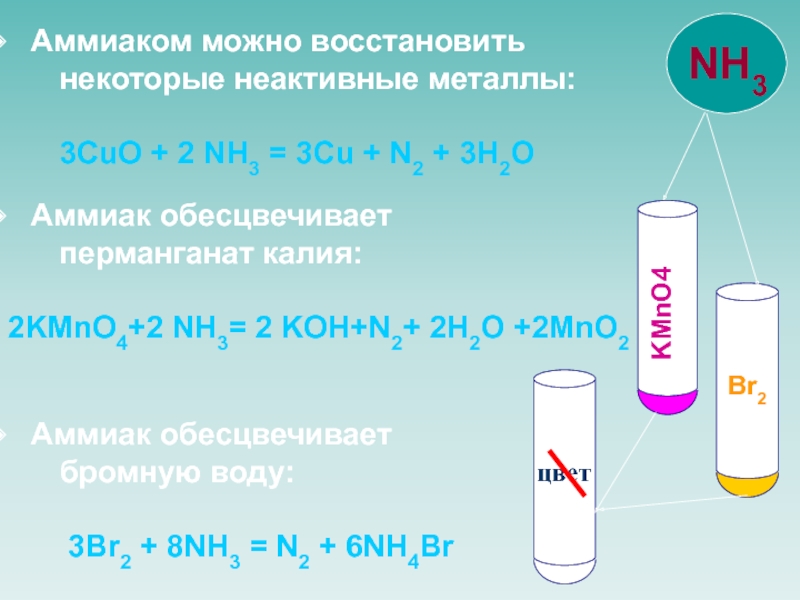


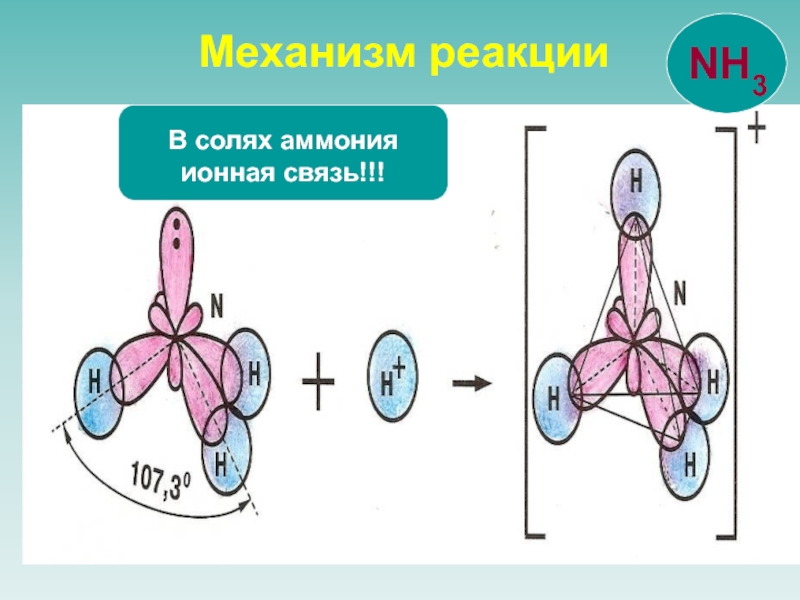



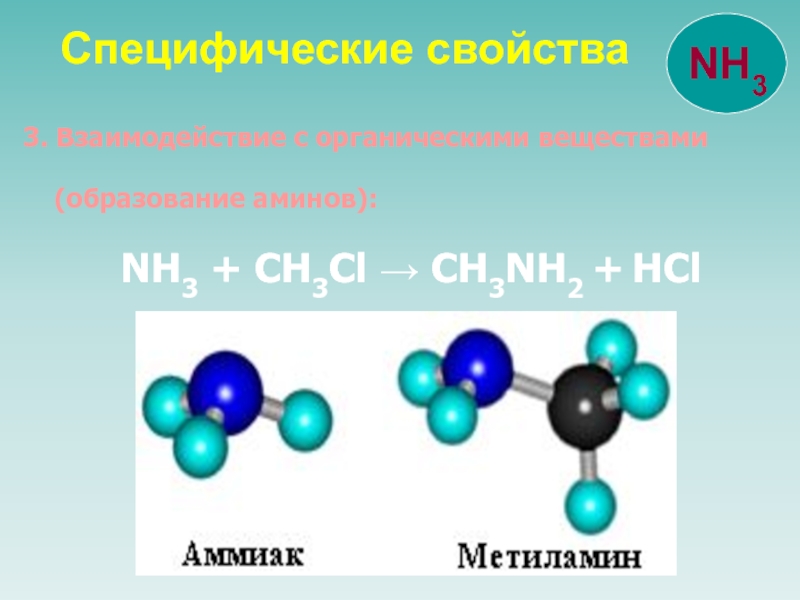
![NH 3
Аммиак 4. Комплексообразование: CuSO4 + 4NH3 → [Cu(NH3)4]SO4Cu(OH)2+ 4NH3 4. Комплексообразование: CuSO4 + 4NH3 → [Cu(NH3)4]SO4Cu(OH)2+ 4NH3 → [Cu(NH3)4](OH)2](/img/thumbs/f5c58e62b0ed7283b2025ac7445d3867-800x.jpg)