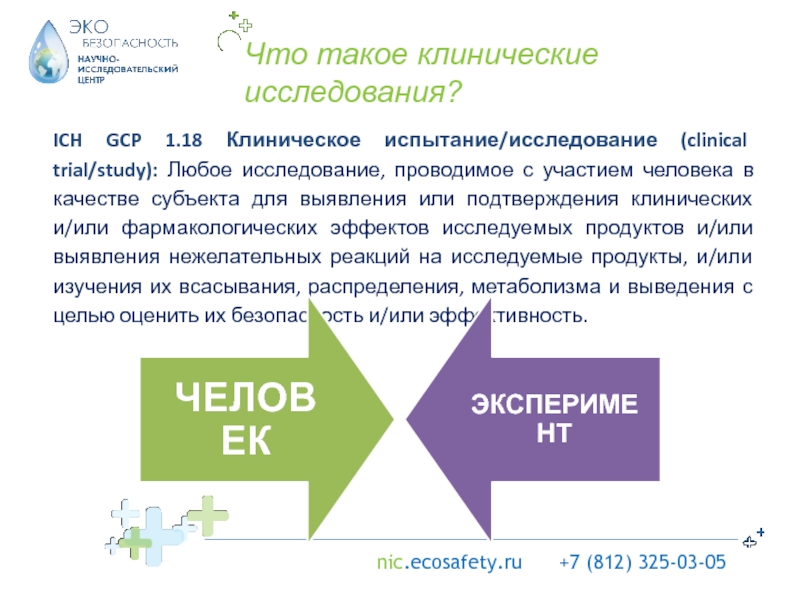
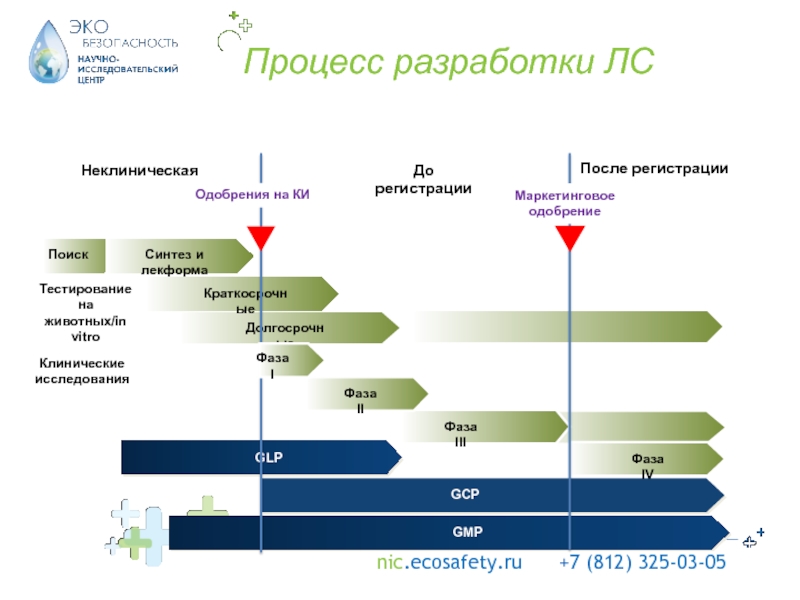
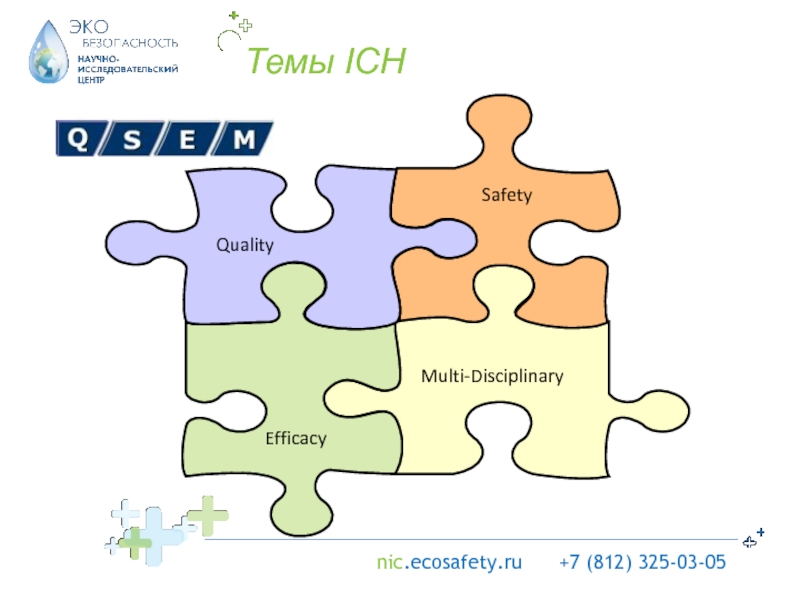
решения.
Захаров Константин Анатольевич
Руководитель научно-исследовательского отдела
«Научно-исследовательский центр Эко-Безопасность»konstantin.zakharov@mail.ru
+7 (921) 950-2991
Санкт-Петербург
2016