Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Окислительно-восстановительные реакции
Содержание
- 1. Окислительно-восстановительные реакции
- 2. Классификация реакций Все химические реакции
- 3. Процесс отдачи электронов - окисление, сопровождается увеличением
- 4. Атомы, молекулы или ионы, присоединяющие электроны, называются
- 5. Окислители это: простые вещества, атомы которых обладают
- 6. Восстановители- это:Элементы I, II, III групп главных
- 7. Три типа окислительно-восстановительных реакций. - межмолекулярные,- внутримолекулярные,-
- 8. происходят с изменением степени окисления разных
- 9. Реакции диспропорционированияпротекают с одновременным уменьшением и
- 10. Влияние среды на характер протекания ОВР -
- 11. Рассмотрим несколько примеров. 1. KMnO4 (перманганат калия)
- 12. Окислительно- восстановительная двойственность пероксида водорода
- 13. Окислительные свойства К2СrО4 и К2Сr2О73. Хромат калия
- 14. Метод электронно-ионного баланса (метод полуреакций). Реакции, протекающие
- 15. Пример 1. КМnO4 + Na2SO3
- 16. Реакции, протекающие в щелочной среде. Правило: если
- 17. Пример 1. Cr2O3 + KNO3 +
- 18. Реакции, протекающие в нейтральной среде.
- 19. Пример 1. KMnO4 + Na2SO3 +
- 20. Теория возникновения равновесных электродных и окислительно-восстановительных потенциалов Определение направления окислительно-восстановительного процесса
- 21. Потенциал, устанавливающийся в условиях равновесия электродной реакции, называется равновесным электродным потенциалом.
- 22. Если металл погрузить в раствор его соли,
- 23. Стандартный электродный потенциал
- 24. Стандартный электродный потенциал (Е0)- это ЭДС гальванического
- 25. Ряд стандартных электродных потенциалов металлов
- 26. Величина потенциала в реальных условиях рассчитывается по уравнению Нернста:
- 27. Слайд 27
- 28. Если известен потенциал водородного электрода, можно рассчитать рН раствора:
- 29. Хлорсеребряный электрод (ХСЭ) Ag, AgCl | KClЭлектрод
- 30. Ag Ag+ + e
- 31. Окислительно-восстановительные потенциалыFe 2+(р-р) Fe 3+(р-р)+е ( Pt
- 32. ОВ потенциал зависит от: температуры
- 33. Стандартный ОВ потенциалЭДС ГЭ, составленного из окислительно-восстановительной
- 34. В реальных условиях расчет ОВ потенциала ОВ-системы производится по уравнению Нернста-Петерса:
- 35. Чем больше стандартный ОВ потенциал системы, тем
- 36. Критерии самопроизвольного протекания ОВ реакций
- 37. БЛАГОДАРЮ ЗА ВНИМАНИЕ !
- 38. Скачать презентанцию
Слайды и текст этой презентации
Слайд 3
Процесс отдачи электронов - окисление, сопровождается увеличением положительной степени окисления
или уменьшением отрицательной. Процесс принятия электронов - восстановление, сопровождается уменьшением
положительной степени окисления или увеличением отрицательной.Слайд 4Атомы, молекулы или ионы, присоединяющие электроны, называются окислителями. Атомы, молекулы
или ионы, отдающие электроны, называются восстановителями.
Окисление всегда сопровождается восстановлением. Окислительно-восстановительные
реакции представляют собой единство двух противоположных процессов – окисления и восстановления.Слайд 5Окислители это:
простые вещества, атомы которых обладают большой величиной электроотрицательности. Это
элементы VII, VI, V групп главных подгрупп, из них наиболее
активные – фтор, кислород, хлор.сложные вещества, катионы которых находятся в высшей степени окисления.
Например: SnCl4, FeCl3, CuSO4.
сложные вещества, в анионах которых атом металла или неметалла находятся в высшей степени окисления
Например: К2Сr2O7, КМnO4, КNO3, H2SO4.
Слайд 6Восстановители- это:
Элементы I, II, III групп главных подгрупп. Например: Na,
Zn, H2, Al.
Сложные вещества, катионы которых находятся в низшей степени
окисления. Например: SnCl2, FeCl2 .Сложные вещества, у которых анионы достигают предельной отрицательной степени окисления. Например: KI, H2S, NH3 .
Вещества, ионы которых находятся в промежуточных степенях окисления могут быть как окислителем, так и восстановителем Например: Na2SO3 .
Мерой восстановительных свойств служит величина энергии ионизации (это энергия, необходимая для последовательного отделения электронов от атома.)
Слайд 7Три типа окислительно-восстановительных реакций.
- межмолекулярные,
- внутримолекулярные,
- диспропорционирования
- В межмолекулярных ОВР
элементы окислитель и восстановитель находятся в разных
веществах. Например:SnCl2 + 2FeCl3 → SnCl4 + 2FeCl2
2 Fe 3+ + e = Fe 2+ - восстановление
1 Sn 2+ - 2е = Sn 4+ - окисление
Слайд 8 происходят с изменением степени окисления разных атомов в одной
и той же молекуле. Например:
2 КClO3 → 2KCl + 3O2
2 Cl5+ + 6e = Cl - - восстановление
3 2О2- - 4е- = О2 - окисление
Внутримолекулярные
реакции
Слайд 9 Реакции диспропорционирования
протекают с одновременным уменьшением и увеличением степени окисления
атомов одного и того же элемента.
3HNO2 → HNO3 +
2NO + H2O 2 N 3+ + e = N 2+ - восстановление
1 N 3+ - 2е = N 5+ - окисление
Слайд 10Влияние среды на характер протекания ОВР
-
ОВР могут протекать в различных средах: в кислой (избыток Н3О+
- ионов), нейтральной (Н2О) и щелочной (избыток ОН- - ионов).В зависимости от среды может меняться характер протекания реакции между одними и теми же веществами. Среда влияет на изменение степени окисления атомов.
Слайд 11Рассмотрим несколько примеров.
1. KMnO4 (перманганат калия) является сильным окислителем, в
сильнокислой среде восстанавливается до ионов Мn2+, в нейтральной среде -
до MnO2 (оксида марганца IV) и в сильно щелочной среде - до МnО42- (манганат-иона).Слайд 12
Окислительно- восстановительная двойственность пероксида водорода
Пероксид водорода как окислитель.
Н
– О Н + 2Н2О
Н2О2 + 2Н3О+ + 2е = 4Н2О| +
Н – O ОН- 2ОН- Н2О2 + 2е = 2ОН-
Пероксид водорода как восстановитель.
Н – О Н + O2 + 2Н3О+ ; Н2О2 - 2е + 2Н2О = O2 + 2Н3О+
| +
Н – O ОН- O2 + 2Н2О; Н2О2 + 2ОН- - 2е = O2 + 2Н2О
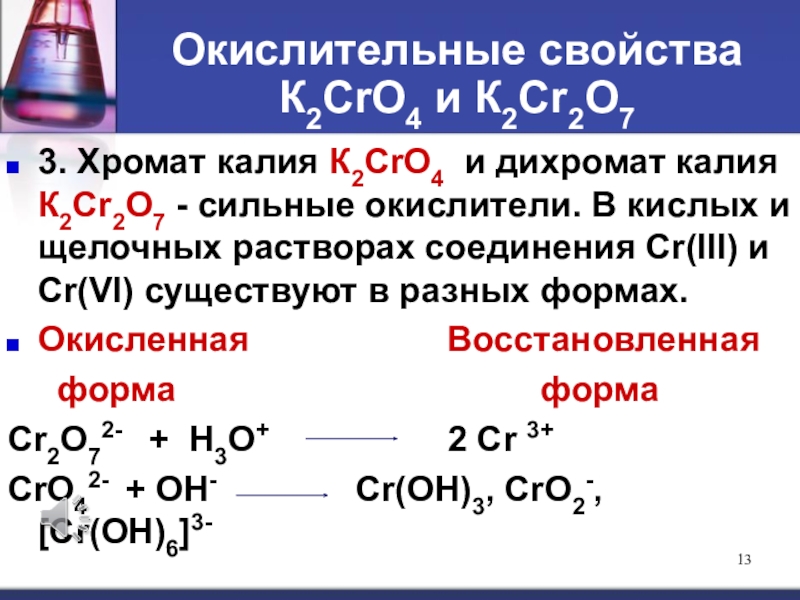
Слайд 13Окислительные свойства К2СrО4 и К2Сr2О7
3. Хромат калия К2СrО4 и дихромат
калия К2Сr2О7 - сильные окислители. В кислых и щелочных растворах
соединения Сr(III) и Сr(VI) существуют в разных формах.Окисленная Восстановленная
форма форма
Cr2O72- + H3O+ 2 Cr 3+
CrO42- + OH- Cr(OH)3, CrO2-, [Cr(OH)6]3-
Слайд 14Метод электронно-ионного баланса (метод полуреакций).
Реакции, протекающие в кислой среде.
Правило: если
реакция протекает в кислой среде, то можно оперировать ионами Н3О+
(Н+) и молекулами воды. Ионы Н3О+ (Н+) записывают в той части уравнения полуреакции, где есть избыток кислорода, молекулы воды записывают соответственно в той части, где кислорода нет или есть недостаток его. Причём количество Н3О+ (Н+) берётся в два раза больше, чем количество избыточных атомов кислорода.Слайд 15Пример 1.
КМnO4 + Na2SO3 + H2SO4 =
MnSO4 + K2SO4 + …
ок вос
средаРешение
2 MnO4- + 8H+ + 5e = Mn2+ + 4H2O
5 SО32- + Н2О – 2е = SО42- + 2Н+
2MnО4- +16H++5SО32-+5Н2О=2Mn2++8H2O+5SO42- +10H+
2КMnО4 + 5Nа2SО3 + 3Н2SО4 = 2MnSO4 + К2SO4 +5Na2SO4 + 3H2O
КMnО4 –окислитель, вос-ся; Nа2SО3 –восстановитель, окис-ся
Слайд 16Реакции, протекающие в щелочной среде.
Правило: если реакция протекает в щелочной
среде, то можно оперировать ионами ОН- и молекулами воды. Ионы
ОН- записываются в той части уравнения полуреакции, где есть недостаток кислорода, молекулы воды записываются соответственно в той части, где кислорода больше. Причем, на каждый недостающий атом кислорода записывают два иона ОН-.Слайд 17Пример 1.
Cr2O3 + KNO3 + KOH = K2CrO4 +
KNO2 + …
вос. ок. средаРешение.
3 | NO3- + H2O + 2e = NO2- + 2OH-
1 | Cr2O3 + 10 OH- -6e = 2CrO4 2- + 5H2O
3NO3-+3H2O+Cr2O3+10OH-=3NO2-+6OH-+ 2CrO42- + 5 H2O
Cr2O3 + 3KNO3 + 4 KOH = 2 K2CrO4 + 3 KNO2 + 2 H2O
Cr2O3 - восстановитель, окисляется;
KNO3 - окислитель, восстанавливается.
Слайд 18 Реакции, протекающие в нейтральной
среде.
Правило: если реакция протекает в
нейтральной среде, следует оперировать только молекулами воды. Причем избыток кислорода
в окислителе связывается молекулами воды, за счёт ионов Н3О+ (Н+), на каждый избыточный атом кислорода расходуется одна молекула воды, которая ставится в левую часть уравнения полуреакции, в растворе накапливаются ОН- - ионы и ставятся они в правую часть уравнения полуреакции. Недостаток кислорода восстановитель восполняет из молекул воды за счет ОН- - ионов, на каждый недостающий атом кислорода расходуется одна молекула воды, которая ставится в левую часть уравнения полуреакции, в растворе накапливаются ионы Н3О+ (Н+) и ставятся они в правую часть уравнения полуреакции.Слайд 19Пример 1.
KMnO4 + Na2SO3 + H2O = MnO2 +
Na2SO4 + …
ок. вос. Решение.
2 | MnO4- + 2H2O +3e = MnO2 + 4 OH-
3 | SO32- + H2O -2e = SO42- + 2 H+
2 MnO4-+4H2O+3SO32-+3H2O=2MnO2 +8OH- + 6H++ 3SO42-
2KMnO4 +3Na2SO3 + H2O = 2 MnO2 + 3 Na2SO4 + 2 KOH
КMnО4–окислитель, вос-ся; Nа2SО3–восстановитель, окис-ся
Слайд 20 Теория возникновения равновесных электродных и окислительно-восстановительных потенциалов
Определение направления
окислительно-восстановительного процесса
Слайд 21 Потенциал, устанавливающийся в условиях равновесия электродной реакции, называется равновесным электродным
потенциалом.
Слайд 22Если металл погрузить в раствор его соли, то на границе
«металл – раствор», образуется двойной электрический слой (ДЭС)
Для сравнения
электродных потенциалов различных металлов выбирают стандартные условия: температура - 250 С,давление - 101,3 кПа, активность одноименного иона - 1 моль/л.
Разность потенциалов, возникающая между металлом и раствором в таких условиях называется стандартным электродным потенциалом.
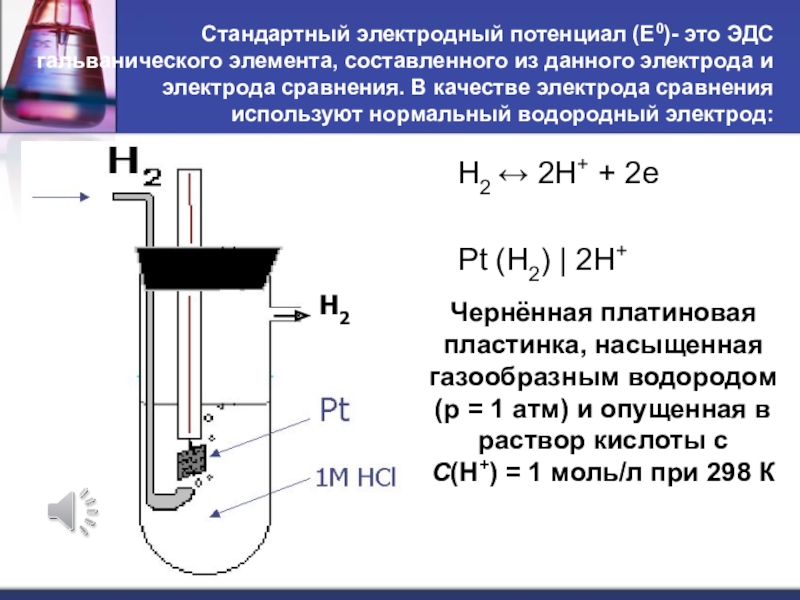
Слайд 24Стандартный электродный потенциал (Е0)- это ЭДС гальванического элемента, составленного из
данного электрода и электрода сравнения. В качестве электрода сравнения используют
нормальный водородный электрод:H2 2H+ + 2e
Pt (H2) | 2H+
Чернённая платиновая пластинка, насыщенная газообразным водородом (р = 1 атм) и опущенная в раствор кислоты с
С(Н+) = 1 моль/л при 298 К
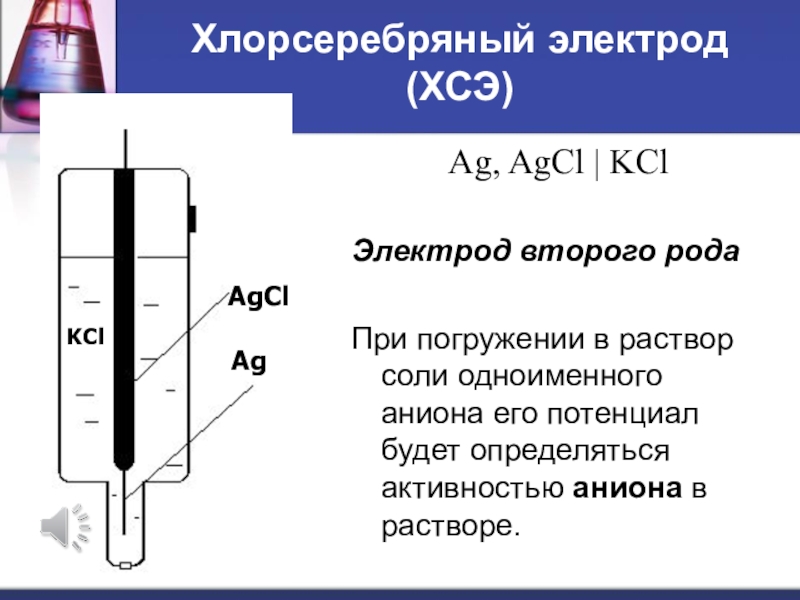
Слайд 29Хлорсеребряный электрод (ХСЭ)
Ag, AgCl | KCl
Электрод второго рода
При
погружении в раствор соли одноименного аниона его потенциал будет определяться
активностью аниона в растворе.Слайд 30Ag Ag+ + e
(1)
AgCl Ag+ + Cl-
(2)KCl K+ + Cl- (3)
Чем больше концентрация KCl, тем больше концентрация Cl- , тем меньше растворимость AgCl и меньше концентрация Ag+. [Ag+] в этих условиях очень мала и практически неопределяема. Потенциал, возникающий на границе Ag|Ag+ определяется уравнением Нернста:
Ks
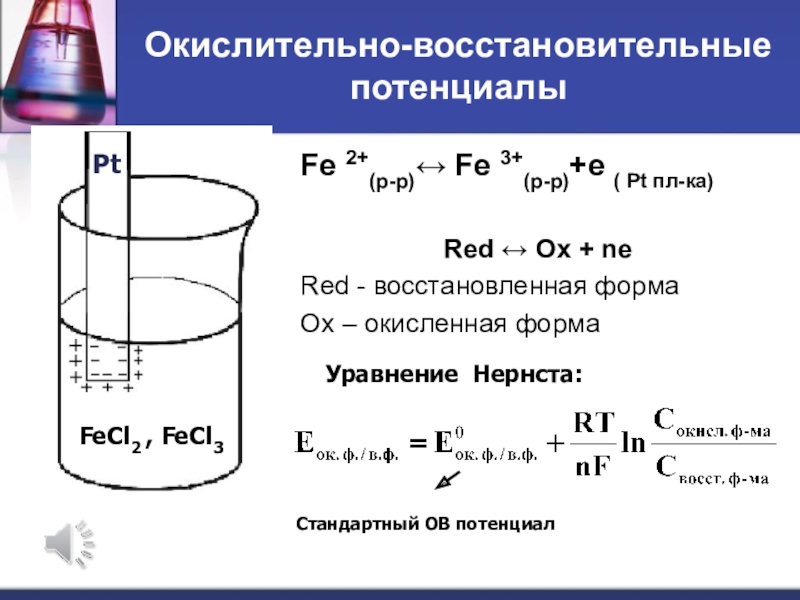
Слайд 31Окислительно-восстановительные потенциалы
Fe 2+(р-р) Fe 3+(р-р)+е ( Pt пл-ка)
Red Ox
+ ne
Red - восстановленная форма
Ox – окисленная форма
Уравнение Нернста:
Стандартный ОВ
потенциалСлайд 32ОВ потенциал зависит от:
температуры
природы окислителя и восстановителя
концентрации
окисленной и восстановленной форм
рН среды
Слайд 33Стандартный ОВ потенциал
ЭДС ГЭ, составленного из окислительно-восстановительной системы, содержащей окисленную
и восстановленную формы – есть стандартный ОВ потенциал данной ОВ
системыСлайд 34В реальных условиях расчет ОВ потенциала ОВ-системы производится по уравнению
Нернста-Петерса:
Слайд 35Чем больше стандартный ОВ потенциал системы, тем в большей степени
выражены ее окислительные свойства в стандартных условиях. Например,
MnO4-/Mn2+
E0= 1,51 BFe3+/Fe2+ E0= 0,77 B
Sn4+/Sn2+ E0= 0,15 B