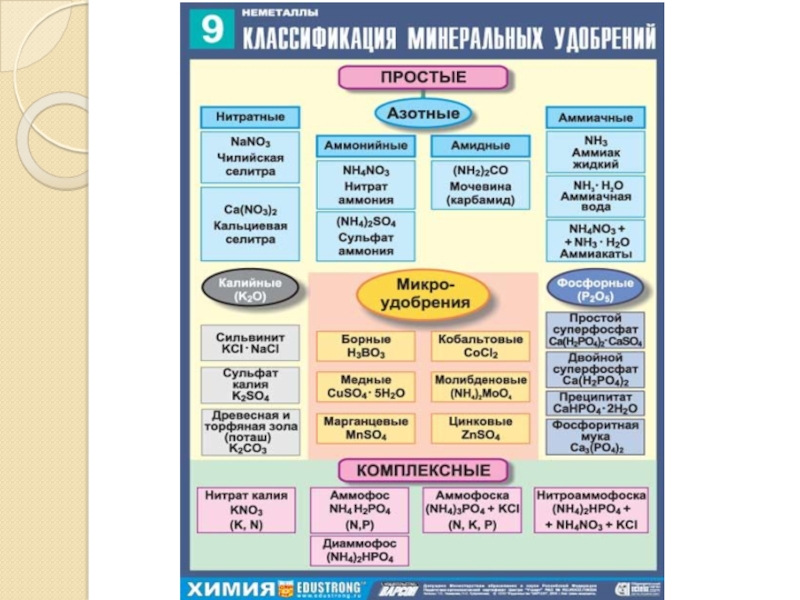
Р2О5 — белый гигроскопичный порошок (поглощает воду), следует хранить в
плотно закрытых сосудах.Получение: Получается при горении фосфора в избытке воздуха или кислорода
4P + 5O2 = 2P2O5
Применение: Оксид фосфора (V) очень энергично соединяется с водой, а также отнимает воду от других соединений. Применяется как осушитель газов и жидкостей.