Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Опыт Э.Резерфорда по строению атома
Содержание
- 1. Опыт Э.Резерфорда по строению атома
- 2. Ещё, быть может, каждый атом-Вселенная, где сто
- 3. Древнегреческие и древнеиндийские учёные и философы считали,
- 4. Модель атома ТомсонаТомсон
- 5. Атом, по мысли Томсона, очень похож на
- 6. Опыт РезерфордаКак же
- 7. Целью опыта было исследование атома с помощью альфа-частиц,
- 8. Но на практике всё оказалось по-другому. Большинство
- 9. Планетарная модель атома РезерфордаРезерфорд пришёл к выводу,
- 10. Вращение электронов происходит под действием кулоновской силы,
- 11. Почему атом существует?Однако модель атома
- 12. Но почему этого не происходит?Причину этого явления
- 13. Спасибо за внимание
- 14. Скачать презентанцию
Ещё, быть может, каждый атом-Вселенная, где сто планет;Там всё, что здесь, в объеме сжатом,Но также то, чего здесь нет.
Слайды и текст этой презентации
Слайд 2Ещё, быть может, каждый атом-
Вселенная, где сто планет;
Там всё, что
здесь, в объеме сжатом,
В.БрюсовСлайд 3Древнегреческие и древнеиндийские учёные и философы считали, что все окружающие
нас вещества состоят из мельчайших частиц, которые не делятся.
Они были
уверены, что в мире не существует ничего, что было бы меньше этих частиц, которые они назвали атомами. И, действительно, впоследствии существование атомов было доказано такими известными учёными, как Антуан Лавуазье, Михаил Ломоносов, Джон Дальтон. Неделимым атом считали вплоть до конца XIX – начала ХХ века, когда выяснилось, что это не так.Слайд 4 Модель атома Томсона
Томсон предложил первую электронную
модель атома. Согласно ей атом представляет собой шар, внутри которого
находится заряженное вещество, положительный заряд которого равномерно распределён по всему объёму..
Джозеф Джон Томсон
Слайд 5Атом, по мысли Томсона, очень похож на пудинг с изюмом:
электроны, как “изюминки”, а “каша” – положительно заряженное вещество атома.
Но модель Томсона оказалась неверной, что было доказано британским физиком сэром Эрнестом Резерфордом.Слайд 6 Опыт Резерфорда
Как же всё-таки устроен атом?
На этот вопрос Резерфорд дал ответ после своего эксперимента, проведенного
в 1909 г. совместно с немецким физиком Гансом Гейгером и новозеландским физиком Эрнстом Марсденом.Эрнест Резерфорд
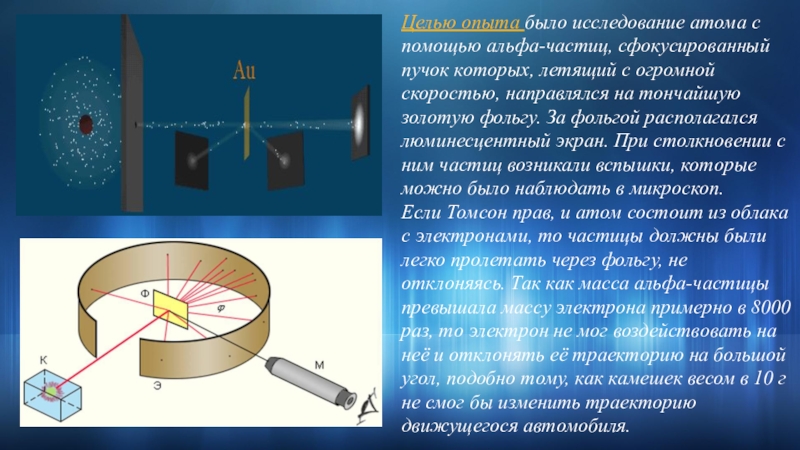
Слайд 7Целью опыта было исследование атома с помощью альфа-частиц, сфокусированный пучок которых,
летящий с огромной скоростью, направлялся на тончайшую золотую фольгу. За
фольгой располагался люминесцентный экран. При столкновении с ним частиц возникали вспышки, которые можно было наблюдать в микроскоп.Если Томсон прав, и атом состоит из облака с электронами, то частицы должны были легко пролетать через фольгу, не отклоняясь. Так как масса альфа-частицы превышала массу электрона примерно в 8000 раз, то электрон не мог воздействовать на неё и отклонять её траекторию на большой угол, подобно тому, как камешек весом в 10 г не смог бы изменить траекторию движущегося автомобиля.
Слайд 8Но на практике всё оказалось по-другому. Большинство частиц действительно пролетало
через фольгу, практически не отклоняясь или отклоняясь на небольшой угол.
Но часть частиц отклонялась довольно значительно или даже отскакивала назад, словно на их пути возникало какое-то препятствие. Как сказал сам Резерфорд, это было так же невероятно, как если бы 15-дюймовый снаряд отскочил от куска папиросной бумаги.Что же заставило некоторые альфа-частицы так сильно изменить направление движения? Учёный предположил, что причиной этому стала часть атома, сосредоточенная в очень малом объёме и имеющая положительный заряд. Её он назвал ядром атома.
Слайд 9Планетарная модель атома Резерфорда
Резерфорд пришёл к выводу, что атом состоит
из плотного положительно заряженного ядра, расположенного в центре атома, и
электронов, имеющих отрицательный заряд. В ядре сосредоточена практически вся масса атома. В целом атом нейтрален. Положительный заряд ядра равен сумме отрицательных зарядов всех электронов атома. Но электроны не вкраплены в ядро, как в модели Томсона, а вращаются вокруг него подобно планетам, вращающимся вокруг Солнца.Слайд 10Вращение электронов происходит под действием кулоновской силы, действующей на них
со стороны ядра. Скорость вращения электронов огромна. Над поверхностью ядра
они образуют подобие облака. Каждый атом имеет своё электронное облако, заряженное отрицательно. По этой причине они не «слипаются», а отталкиваются друг от друга.Из-за своей схожести с Солнечной системой модель Резерфорда была названа планетарной.
Слайд 11 Почему атом существует?
Однако модель атома Резерфорда не смогла
объяснить, почему атом так устойчив. Ведь, согласно законам классической физики,
электрон, вращаясь на орбите, движется с ускорением, следовательно, излучает электромагнитные волны и теряет энергию. В конце концов эта энергия должна иссякнуть, а электрон должен упасть на ядро. Если бы это было так, атом смог бы существовать всего лишь 10 -8 с.Слайд 12Но почему этого не происходит?
Причину этого явления позже объяснил датский
физик Нильс Бор. Он предположил, что электроны в атоме двигаются
только по фиксированным орбитам, которые называются «разрешёнными орбитами». Находясь на них, они не излучают энергию. А излучение или поглощение энергии происходит только при переходе электрона с одной разрешённой орбиты на другую. Если это переход с дальней орбиты на более близкую к ядру, то энергия излучается, и наоборот. Излучение происходит порциями, которые назвали квантами.Хотя описанная Резерфордом модель не смогла объяснить устойчивость атома, она позволила значительно продвинуться вперёд в изучении его строения.
Нильс Бор