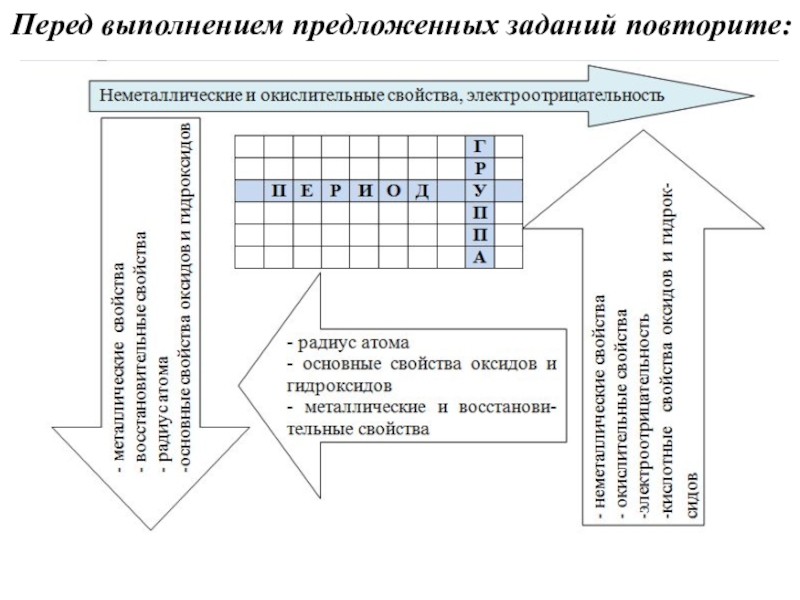
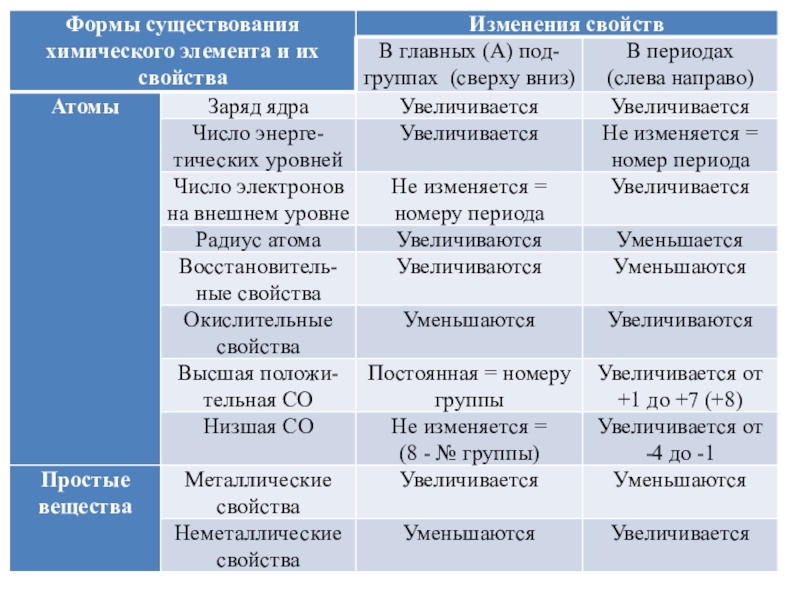
в Периодической системе химических элементов.
Примерное время выполнения задания – 2
минутыУровень сложности задания – базовый
Максимальный балл за выполнение задания - 1
Задание № 2 направлено на проверку знания и понимания периодического закона Д. И. Менделеева, а также умения использовать его для обоснования закономерностей изменения свойств элементов, простых и сложных веществ, образованных атомами данных элементов.
Задание содержит текстовое условие с тремя химическими элементами. В ответе надо записать цифры в нужной последовательности согласно условию задания.