Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Основные классы неорганических соединений
Содержание
- 1. Основные классы неорганических соединений
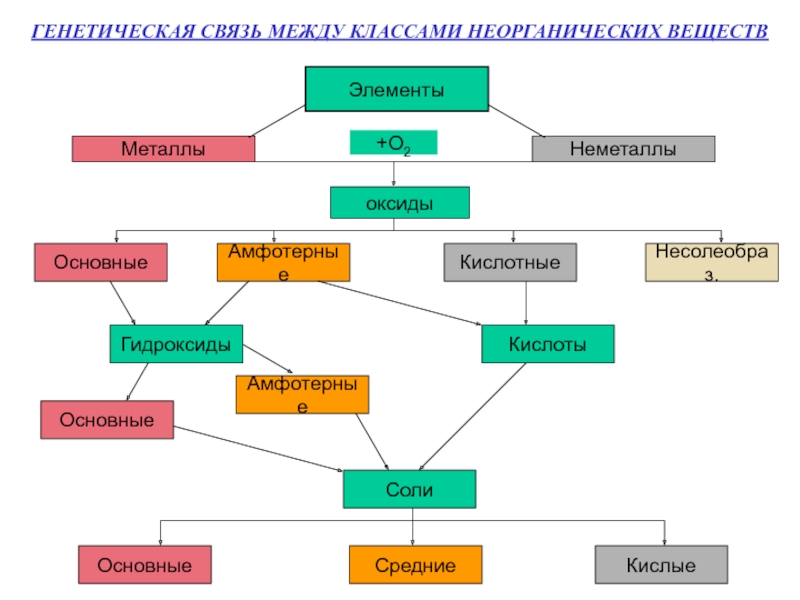
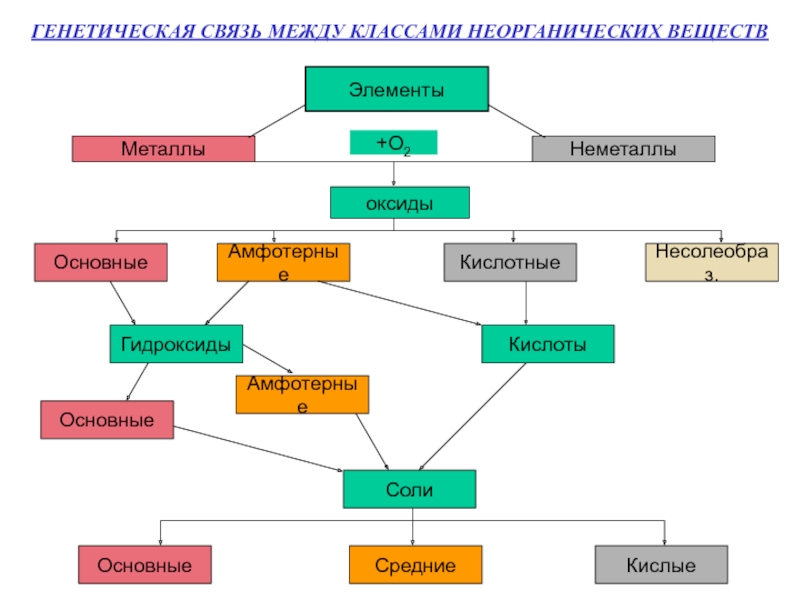
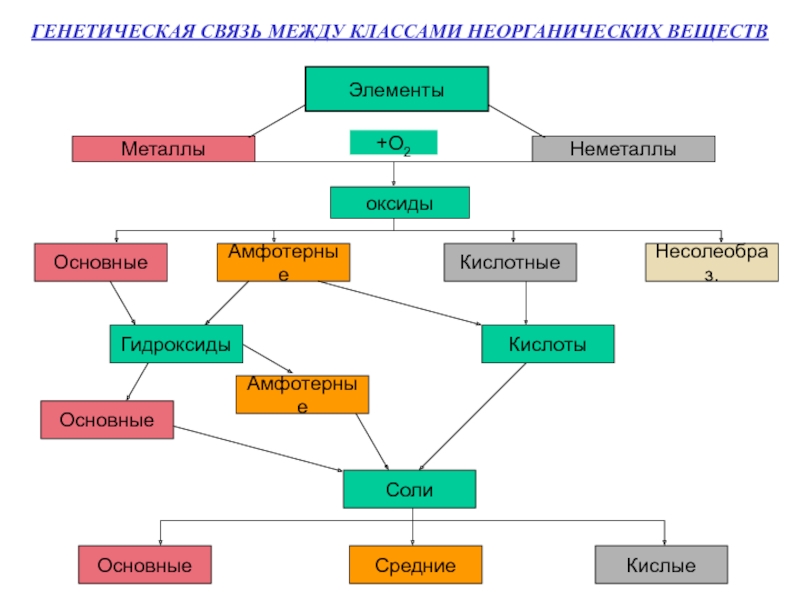
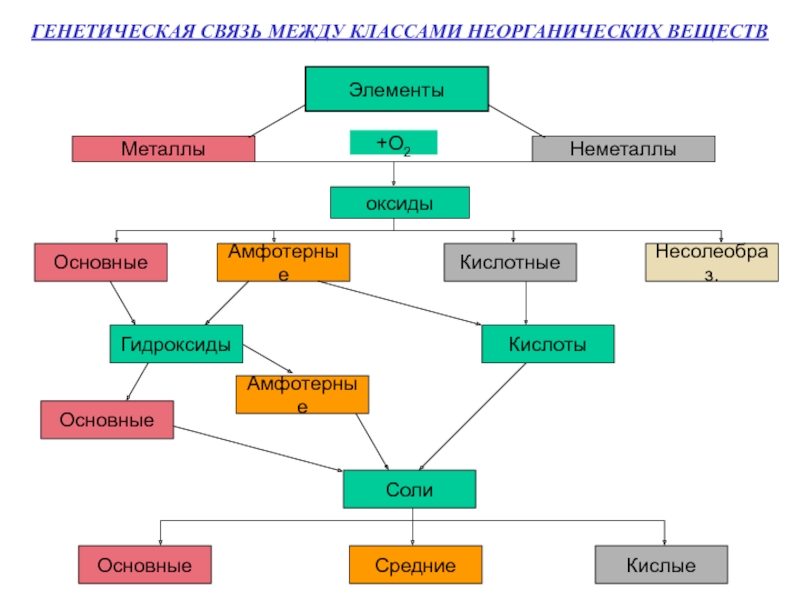
- 2. ГЕНЕТИЧЕСКАЯ СВЯЗЬ МЕЖДУ КЛАССАМИ НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ ЭлементыМеталлыНеметаллы+О2оксидыОсновныеАмфотерныеКислотныеНесолеобраз.ГидроксидыКислотыОсновныеАмфотерныеСолиОсновныеСредниеКислые
- 3. ОКСИДЫ. КЛАССИФИКАЦИЯ. ПОЛУЧЕНИЕ. СВОЙСТВА Оксиды - сложные
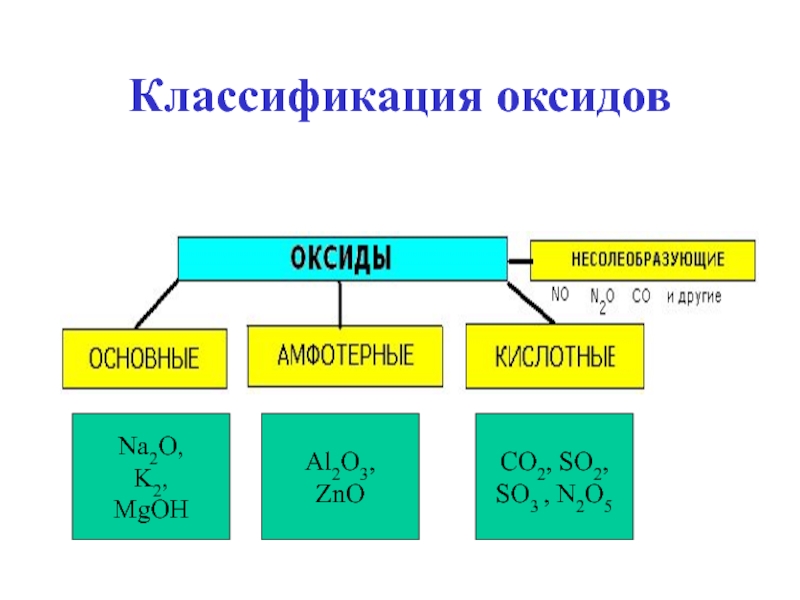
- 4. Классификация оксидов Na2O,K2,MgOHAl2O3,ZnOCO2, SO2,SO3 , N2O5
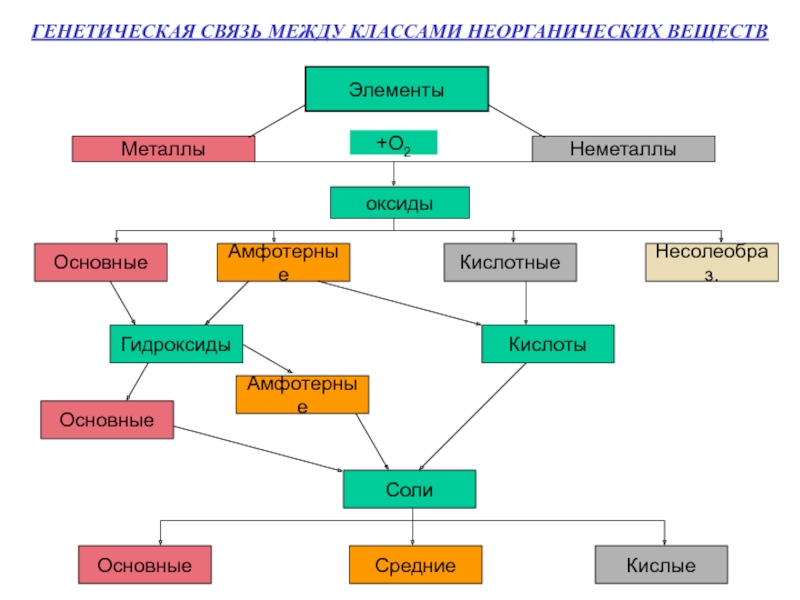
- 5. ГЕНЕТИЧЕСКАЯ СВЯЗЬ МЕЖДУ КЛАССАМИ НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ ЭлементыМеталлыНеметаллы+О2оксидыОсновныеАмфотерныеКислотныеНесолеобраз.ГидроксидыКислотыОсновныеАмфотерныеСолиОсновныеСредниеКислые
- 6. Химические свойства оксидов 1. Взаимодействие с водой
- 7. Химические свойства оксидов (продолжение) 3. С кислотными
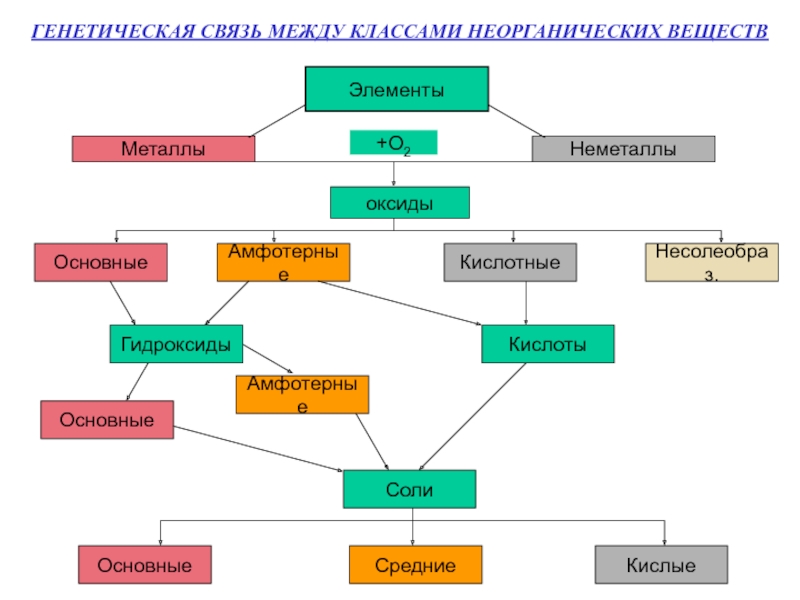
- 8. ГЕНЕТИЧЕСКАЯ СВЯЗЬ МЕЖДУ КЛАССАМИ НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ ЭлементыМеталлыНеметаллы+О2оксидыОсновныеАмфотерныеКислотныеНесолеобраз.ГидроксидыКислотыОсновныеАмфотерныеСолиОсновныеСредниеКислые
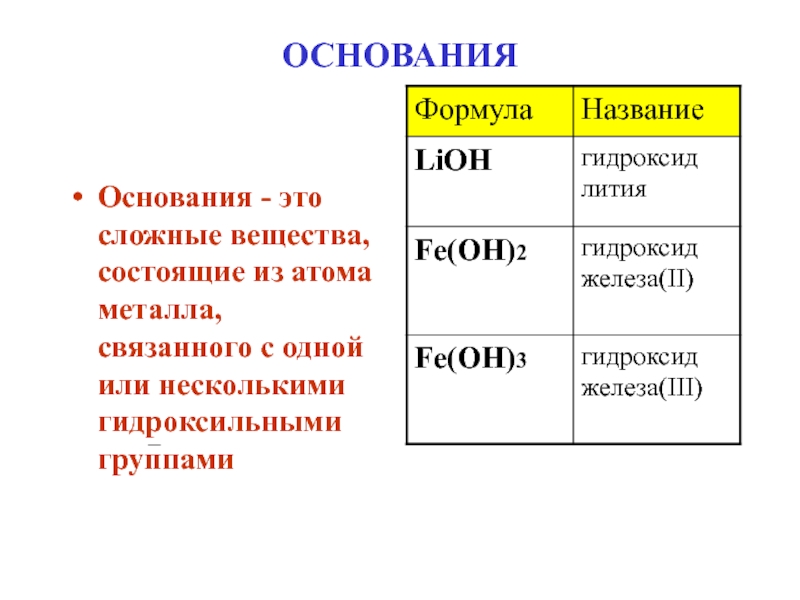
- 9. ОСНОВАНИЯОснования - это сложные вещества, состоящие из атома металла, связанного с одной или несколькими гидроксильными группами
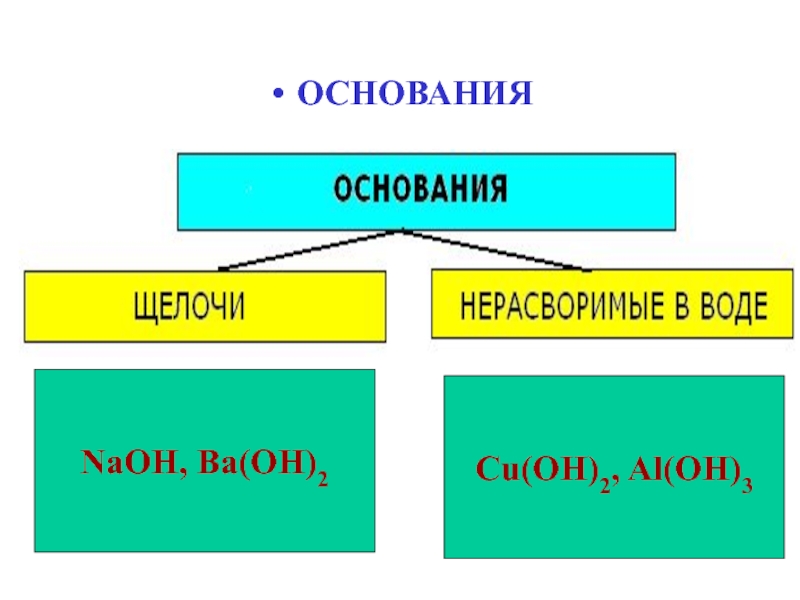
- 10. ОСНОВАНИЯCu(OH)2, Al(OH)3NaOH, Ba(OH)2
- 11. Основания (по теории электролитической диссоциации) - электролиты,
- 12. ОСНОВАНИЯЩелочи - растворимые гидроксиды щелочных и щелочноземельных
- 13. ГЕНЕТИЧЕСКАЯ СВЯЗЬ МЕЖДУ КЛАССАМИ НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ ЭлементыМеталлыНеметаллы+О2оксидыОсновныеАмфотерныеКислотныеНесолеобраз.ГидроксидыКислотыОсновныеАмфотерныеСолиОсновныеСредниеКислые
- 14. КИСЛОТЫКислоты - сложные вещества, состоящие из одного
- 15. Кислоты (по теории электролитической диссоциации) - электролиты,
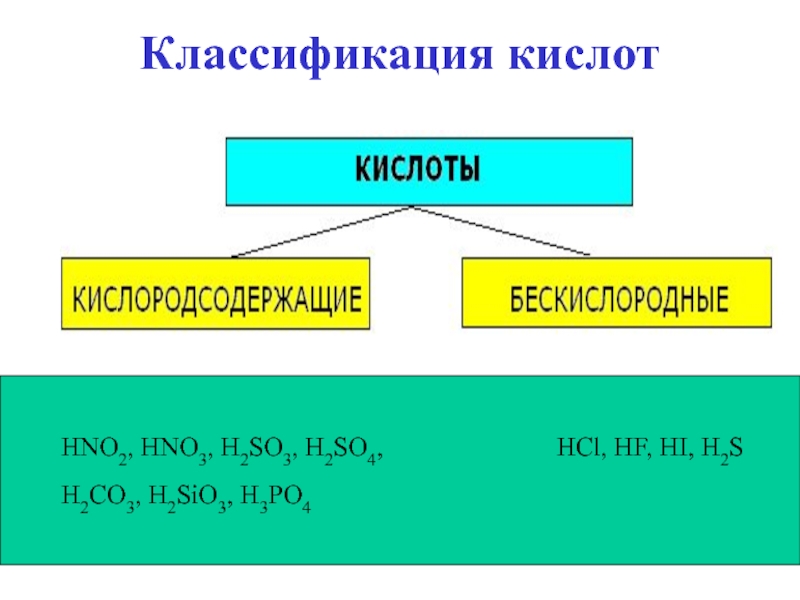
- 16. Классификация кислотЧисло атомов водорода определяет
- 17. 2) двухосновные:
- 18. Классификация кислот HNO2,
- 19. Химические свойства кислот1. С основаниями, образуя соль
- 20. ГЕНЕТИЧЕСКАЯ СВЯЗЬ МЕЖДУ КЛАССАМИ НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ ЭлементыМеталлыНеметаллы+О2оксидыОсновныеАмфотерныеКислотныеНесолеобраз.ГидроксидыКислотыОсновныеАмфотерныеСолиОсновныеСредниеКислые
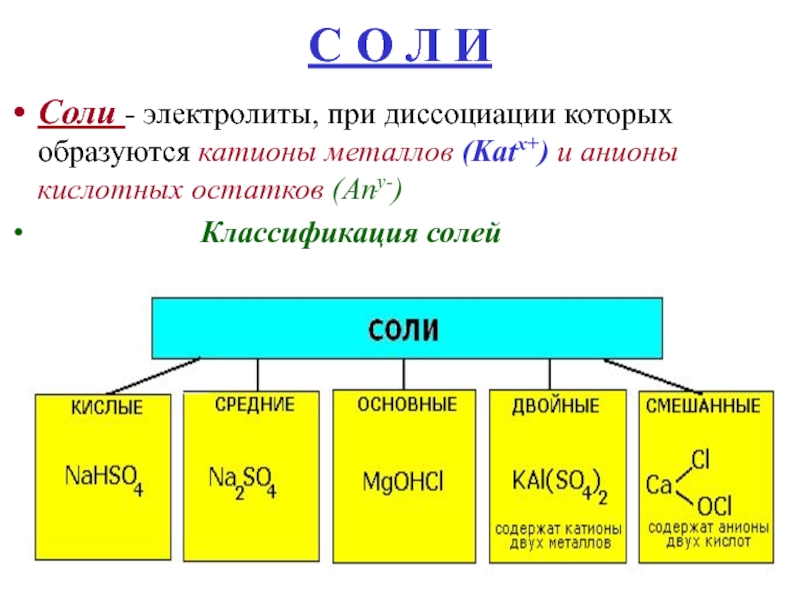
- 21. С О Л ИСоли - электролиты, при
- 22. Классификация солей1) средние (нормальные) - в реакции
- 23. Классификация солей2) кислые : в реакции нейтрализации
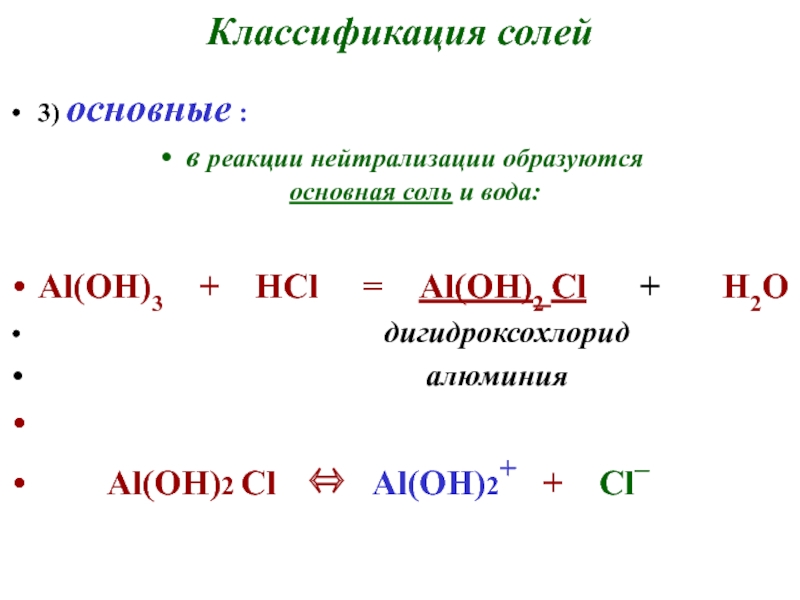
- 24. Классификация солей3) основные :в реакции нейтрализации образуются
- 25. ГЕНЕТИЧЕСКАЯ СВЯЗЬ МЕЖДУ КЛАССАМИ НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ ЭлементыМеталлыНеметаллы+О2оксидыОсновныеАмфотерныеКислотныеНесолеобраз.ГидроксидыКислотыОсновныеАмфотерныеСолиОсновныеСредниеКислые
- 26. Скачать презентанцию
ГЕНЕТИЧЕСКАЯ СВЯЗЬ МЕЖДУ КЛАССАМИ НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ ЭлементыМеталлыНеметаллы+О2оксидыОсновныеАмфотерныеКислотныеНесолеобраз.ГидроксидыКислотыОсновныеАмфотерныеСолиОсновныеСредниеКислые
Слайды и текст этой презентации
Слайд 2ГЕНЕТИЧЕСКАЯ СВЯЗЬ МЕЖДУ КЛАССАМИ НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ
Элементы
Металлы
Неметаллы
+О2
оксиды
Основные
Амфотерные
Кислотные
Несолеобраз.
Гидроксиды
Кислоты
Основные
Амфотерные
Соли
Основные
Средние
Кислые
Слайд 5ГЕНЕТИЧЕСКАЯ СВЯЗЬ МЕЖДУ КЛАССАМИ НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ
Элементы
Металлы
Неметаллы
+О2
оксиды
Основные
Амфотерные
Кислотные
Несолеобраз.
Гидроксиды
Кислоты
Основные
Амфотерные
Соли
Основные
Средние
Кислые
Слайд 6Химические свойства оксидов
1. Взаимодействие с водой :
а) основной
оксид
CaO + H2O = Ca(OH)2 ; оксид кальция гидроксид кальция
основной оксид основание
б) кислотный оксид
SO3 + H2O = H2SO4
оксид серы (IV) серная кислота
кислотный оксид кислота
2. С кислотами :
а) основной оксид
Li2O + 2HCl = 2LiCl + 2H2O ;
оксид Li хлорид лития
основной оксид соль
б) амфотерный оксид
AI2O3 + 6HCl = 2AlCl3 + 3H2O
оксид AI хлорид AI
амфотерный оксид соль
Слайд 7Химические свойства оксидов
(продолжение)
3. С кислотными оксидами:
а) основной оксид
CaO + CO2 = CaCO3 основной кислотный сольоксид оксид
б) амфотерный оксид
ZnO + SiO2 = ZnSiO3
амфотерный кислотный соль
оксид оксид
Слайд 8ГЕНЕТИЧЕСКАЯ СВЯЗЬ МЕЖДУ КЛАССАМИ НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ
Элементы
Металлы
Неметаллы
+О2
оксиды
Основные
Амфотерные
Кислотные
Несолеобраз.
Гидроксиды
Кислоты
Основные
Амфотерные
Соли
Основные
Средние
Кислые
Слайд 9ОСНОВАНИЯ
Основания - это сложные вещества, состоящие из атома металла, связанного
с одной или несколькими гидроксильными группами
Слайд 11Основания (по теории электролитической диссоциации) - электролиты, при диссоциации которых
в качестве анионов образуются только анионы гидроскила ОН¯ :
1) диссоциация однокислотного основания:
NaOH Na+ + OН– ;
2) ступенчатая диссоциация двухкислотного основания:
Ba(OH)2 Ba OН+ + OН– - 1 ступень,
Ba OН+ Ba 2+ + OН– - 2 ступень
Слайд 12ОСНОВАНИЯ
Щелочи - растворимые гидроксиды щелочных и щелочноземельных металлов: LiOH, NaOH,
KOH, RbOH, CsOH, Ca(OH)2, Sr(OH)2, Ba(OH)2.
Реакция нейтрализации: KOH +
HCl = KCl + H2OНерастворимые - амфотерные гидроксиды, которые взаимодействуют
с кислотами - как основания,
а со щёлочами - как кислоты.
Cu(OH)2 + 2HCl = CuCl2 + 2H2O
Al(OH)3 + NaOH = Na[Al(OH)4]
Слайд 13ГЕНЕТИЧЕСКАЯ СВЯЗЬ МЕЖДУ КЛАССАМИ НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ
Элементы
Металлы
Неметаллы
+О2
оксиды
Основные
Амфотерные
Кислотные
Несолеобраз.
Гидроксиды
Кислоты
Основные
Амфотерные
Соли
Основные
Средние
Кислые
Слайд 14КИСЛОТЫ
Кислоты - сложные вещества, состоящие из одного или нескольких атомов
водорода и кислотных остатков (Hx Any).
Кислотные остатки (анионы):
Сl-
(хлорид), SO4 2- (сульфат), РО43- (фосфат)Слайд 15Кислоты (по теории электролитической диссоциации) - электролиты, при диссоциации которых
в качестве катионов образуются только катионы водорода Н+
1) диссоциация одноосновной кислоты:
HNO3 Н+ + NO3– ;
2) ступенчатая диссоциация двухосновной кислоты:
H2SO4 Н+ + НSO4– - 1 ступень,
НSO4– Н+ + SO42– - 2 ступень
Слайд 16Классификация кислот
Число атомов водорода определяет
основность кислот:
1) одноосновные:
HCl
- хлороводородная, или соляная;HF - фтороводородная, или плавиковая;
HI - иодоводородная кислота;
HBr - бромоводородная кислота;
HNO2 - азотистая кислота;
HNO3 - азотная кислота;
Слайд 172) двухосновные:
H2S
- сероводородная кислота;H2SO4 - серная кислота ;
H2CO3 - угольная кислота;
2) трехосновные:
H3PO4 - фосфорная кислота
Слайд 19Химические свойства кислот
1. С основаниями, образуя соль и воду (реакция
нейтрализации)
Н2SО4 + 2NаOH = Nа2SО4 + 2Н2О;
2. С основными
оксидами 2НСl + МgО = МgСl2 + Н2О ;
Слайд 20ГЕНЕТИЧЕСКАЯ СВЯЗЬ МЕЖДУ КЛАССАМИ НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ
Элементы
Металлы
Неметаллы
+О2
оксиды
Основные
Амфотерные
Кислотные
Несолеобраз.
Гидроксиды
Кислоты
Основные
Амфотерные
Соли
Основные
Средние
Кислые
Слайд 21С О Л И
Соли - электролиты, при диссоциации которых образуются
катионы металлов (Katх+) и анионы кислотных остатков (Any-)
Классификация солейСлайд 22Классификация солей
1) средние (нормальные) -
в реакции нейтрализации образуются средняя
соль и вода:
KOH + HNO3
= КNO3 + H2O ; нитрат калия
К+ + OH¯ + H + + NO3 ¯ = К+ + NO3– + H2O
КNO3 К+ + NO3–
Слайд 23Классификация солей
2) кислые :
в реакции нейтрализации образуются
кислая соль
и вода:
KOH + H2S
= КHS + H2O ; гидросульфид калия
K+ + OH¯ + H + + HS¯ = К + + HS¯ + H2O
КHS К+ + НS–
Слайд 24Классификация солей
3) основные :
в реакции нейтрализации образуются
основная соль и
вода:
Al(OH)3 + HCl = Al(OH)2
Cl + H2O дигидроксохлорид
алюминия
Al(OH)2 Cl Al(OН)2+ + Cl–