Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Основные положения теории электролитической диссоциации
Содержание
- 1. Основные положения теории электролитической диссоциации
- 2. Ионы - это одна из форм существования химического
- 3. В результате взаимодействия электролита с молекулами воды
- 4. Следовательно, существует ещё одна классификация ионов – по
- 5. Наряду с процессом диссоциации (распад электролита на
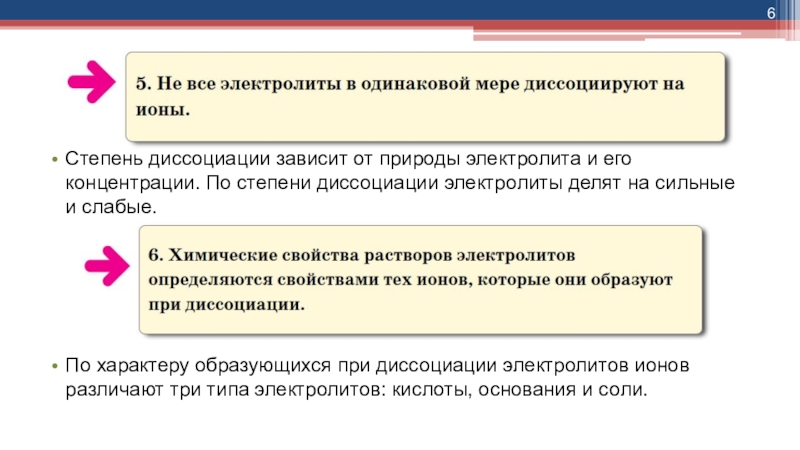
- 6. Степень диссоциации зависит от природы электролита и
- 7. Кислоты Все кислоты объединяет то, что они
- 8. Все общие свойства оснований – мылкость на ощупь,
- 9. Свойства солей определяются как катионами металла, так
- 10. Скачать презентанцию
Ионы - это одна из форм существования химического элемента.Свойства ионов совершенно не похожи на свойства атомов, которые их образовали. Например, атомы металла натрия Na0 энергично взаимодействуют с водой, образуя при этом щёлочь (NaOH)
Слайды и текст этой презентации
Слайд 1Основные положения теории электролитической диссоциации
ХИМИЯ - 8
Автор: Кунова Г.В. -
учитель химии ГОАОУ «ЦОРиО» г. Липецк
Слайд 2Ионы - это одна из форм существования химического элемента.
Свойства ионов совершенно
не похожи на свойства атомов, которые их образовали.
Например, атомы металла
натрия Na0 энергично взаимодействуют с водой, образуя при этом щёлочь (NaOH) и водород H2, в то время как ионы натрия Na+ таких продуктов не образуют. Хлор Cl2 имеет жёлто-зелёный цвет и резкий запах, ядовит, а ионы хлора Cl– бесцветны, неядовиты, лишены запаха.
По составу ионы делят на простые – Cl–, Na+ и сложные – OH-, NH4+.
Слайд 3В результате взаимодействия электролита с молекулами воды образуются гидратированные, т. е.
связанные с молекулами воды, ионы.
Следовательно, по наличию водной оболочки ионы
делят на гидратированные (в растворах и кристаллогидратах) и негидратированные (в безводных солях).Свойства гидратированных и негидратированных ионов отличаются.
Слайд 4Следовательно, существует ещё одна классификация ионов – по знаку их заряда.
В
растворах электролитов сумма зарядов катионов равна сумме зарядов анионов, вследствие
чего эти растворы электронейтральны.Слайд 5Наряду с процессом диссоциации (распад электролита на ионы) протекает и
обратный процесс – ассоциация (соединение ионов).
Поэтому в уравнениях электролитической диссоциации
слабых электролитов вместо знака равенства ставят знак обратимости, например:Слайд 6Степень диссоциации зависит от природы электролита и его концентрации. По
степени диссоциации электролиты делят на сильные и слабые.
По характеру образующихся
при диссоциации электролитов ионов различают три типа электролитов: кислоты, основания и соли.Слайд 7Кислоты
Все кислоты объединяет то, что они при диссоциации обязательно
образуют катионы водорода.
Поэтому общие характерные свойства кислот – кислый вкус,
изменение окраски индикаторов и др. – обусловлены катионами водорода.Слайд 8Все общие свойства оснований – мылкость на ощупь, изменение окраски индикаторов
и др. – обусловлены общими для всех оснований гидроксид-ионами OH–.
Основания
Слайд 9Свойства солей определяются как катионами металла, так и анионами кислотного
остатка.
В отличие от многоосно́вных кислот и оснований, содержащих несколько гидроксид-ионов,
такие соли, как K2SO4, Al2(SO4)3 и т. д., диссоциируют сразу полностью, а не ступенчато:Соли