Слайд 1Основные понятия органической химии
Органическая химия — это химия соединений углерода
- органических соединений.
Органическая химия — это химия углеводородов и
их производных.
Основой органической химии является структурная теория, или теория химического строения органических соединений, которая была разработана во второй половине XIX в.
Слайд 2Биоорганическая химия
Это наука, изучающая биологическую функцию органических веществ в организме.
Она возникла во второй половине XX в.
Объектами ее изучения служат
биополимеры, биорегуляторы и отдельные метаболиты.
Биомолекулы – органические соединения, входящие в состав организмов, образующие клеточные структуры и участвующие в биохимических реакциях обмена веществ.
Слайд 3Основные классы биомолекул:
Белки и аминокислоты.
Нуклеиновые кислоты и нуклеотиды.
Углеводы
Липиды
Витамины
Гормоны и медиаторы
Кроме того в организме имеются
промежуточные продукты метаболизма (метаболиты или интермедиаты), а именно: азотистые соединения, низкомолекулярные моно-, ди- и трикарбоновые кислоты, спирты, и амины.
Слайд 4Основой органической химии является
Структурная теория,
Или
Теория химического строения органических
соединений,
которая была разработана во второй половине XIX в. русским
химиком А. М. Бутлеровым
Слайд 5Основные положения структурной теории:
Атомы в органических молекулах соединены между собой
в определенном порядке химическими связями в соответствии с их валентностью.
Этот порядок называется химическим строением. Углерод во всех органических соединениях четырехвалентен.
2) Химическое строение можно выразить структурной формулой, в которой химические связи между атомами изображаются черточками. Общее число черточек, отходящих от каждого атома, равно его валентности.
Слайд 63) Физические и химические свойства веществ зависят не только от
их качественного и количественного состава, но и от строения молекул.
Вещества, описываемые одинаковой молекулярной формулой (изомеры), могут иметь совершенно разные физические и химические свойства.
4) Атомы в молекуле оказывают друг на друга взаимное влияние. Свойства каждого атома зависят не только от его природы, но и от его окружения.
Слайд 7Для классификация органических соединений используют понятия «углеродный скелет» и «функциональная
группа».
Углеродный скелет — это каркас органической молекулы; он представляет собой
последовательность химически связанных между собой атомов углерода. Во многих органических реакциях углеродный скелет остается неизменным.
Углеродные скелеты бывают алифатические, в которых углеродная цепь не замкнута, и циклические, в которых углеродная цепь замкнута в цикл.
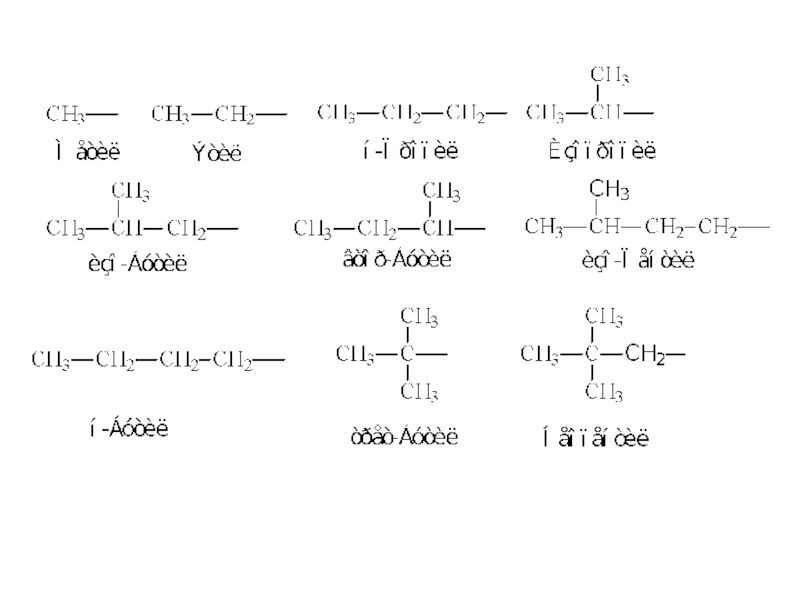
Слайд 9Углеродные скелеты бывают неразветвленные (линейные, нормальные) и разветвленные:
в неразветвленных
скелетах каждый атом углерода связан с одним или двумя атомами
углерода,
в разветвленных скелетах хотя бы один атом углерода связан с тремя или четырьмя атомами углерода.
Слайд 10Атомы углерода в скелетах различают по числу химически связанных с
ними других атомов углерода.
Если данный атом углерода связан с
одним атомом углерода, то его называют первичным, с двумя — вторичным, тремя — третичным и четырьмя — четвертичным.
Слайд 11Органические соединения классифицируют также по кратности связи углерод-углерод.
Соединения, содержащие
только одинарные связи углерод-углерод, называют насыщенными, или предельными.
Соединения со
связями С=С или С≡С называют ненасыщенными, или непредельными.
Соединения, в которых атомы углерода связаны только с атомами водорода, называют углеводородами.
Слайд 12Функциональные группы образуют все атомы, кроме водорода, или группы атомов,
связанные с атомом углерода.
Функциональные группы — это активные центры
органических молекул. Именно они чаще всего определяют многие химические и физические свойства органических соединений и испытывают химические превращения.
Слайд 13Соединения, имеющие одинаковые функциональные группы, но отличающиеся числом атомов углерода,
обладают весьма похожими физическими и химическими свойствами. Такие соединения называют
гомологами.
Гомологи — это соединения, принадлежащие одному классу, но отличающиеся друг от друга по составу на целое число групп —СН2—. Совокупность всех гомологов образует гомологический ряд.
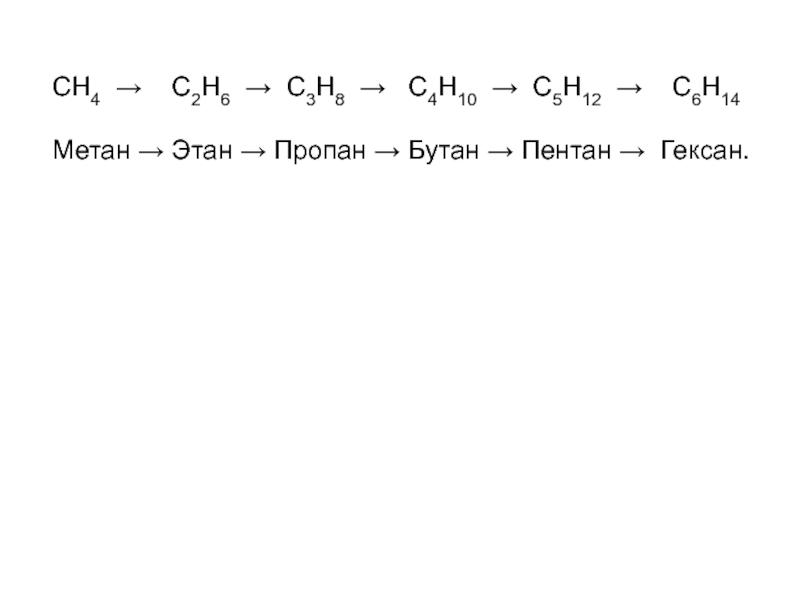
Слайд 14СН4 → С2Н6 → С3Н8 → С4Н10 →
C5H12 → С6Н14
Метан → Этан → Пропан → Бутан
→ Пентан → Гексан.
Слайд 15Изомеры это вещества имеющие одинаковый качественный и количественный состав (молекулярную
формулу), но разное строение молекул.
Различают два вида изомерии —
структурную и пространственную.
Структурные изомеры отличаются друг от друга порядком соединения атомов.
В пространственных изомерах порядок соединения атомов один и тот же, однако некоторые атомы благодаря электронным или геометрическим особенностям отличаются положением в пространстве относительно других атомов.
Слайд 16Структурные изомеры могут отличаться :
строением углеродных скелетов;
положением функциональной группы;
положением кратной связи;
по классам органических
соединений.
Слайд 17Пространственные изомеры (стереоизомеры) можно разделить на два класса:
цис-транс-изомеры;
оптические изомеры.
Цис транс изомерия связана с разным положением
заместителей относительно двойной связи С=С или одинарной связи С—С в циклах.
Оптическая изомерия характерна для молекул, которые не совпадают со своим зеркальным отображением. Таким свойством обладают любые молекулы, имеющие хотя бы один атом углерода, связанный с четырьмя различными заместителями.
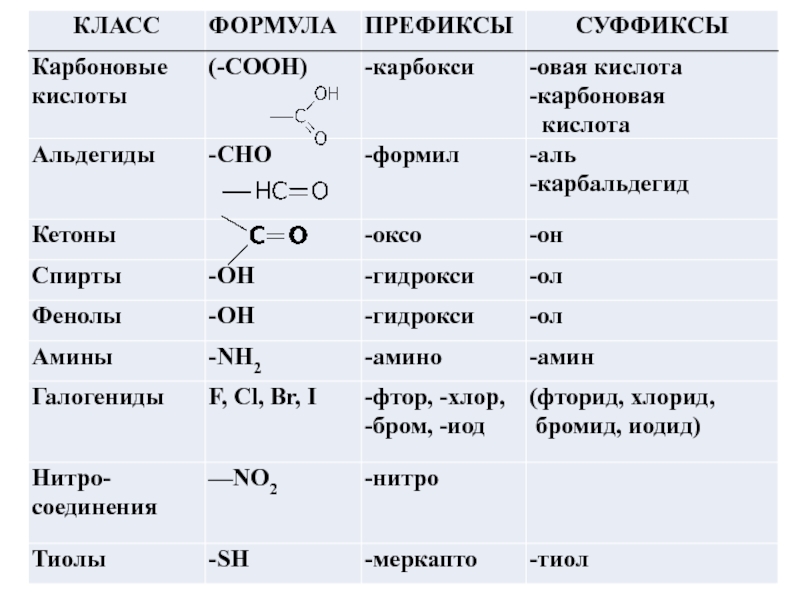
Слайд 18Составление названия органического соединения по номенклатуре IUPAC (заместительная номенклатура)
Определите функциональную
(характеристическую) группу, если она имеется, суффикс которой используют при составлении
названия.
При составлении названия используется суффикс только одной функциональной группы, называемой главной
( исключение: суффиксы двойной или тройной связи). Все заместители, в том числе и другие младшие функциональные группы, указываются префиксами.
Слайд 20Все атомы в органических молекулах находятся во взаимосвязи и испытывают
взаимное влияние.
Смещение электронных облаков (электронной плотности) в молекуле под
влиянием заместителей называют электронными эффектами.
Если атом или группа атомов смещают электронную плотность на себя, то говорят, что они обладают электроноакцепторными свойствами и проявляют отрицательный электронный эффект.
В противном случае они обладают электронодонорными свойствами и проявляют положительный эффект.
Слайд 21Смещение электронной плотности по цепи одинарных связей называют индуктивным эффектом:
+I-эффект в случае повышения заместителем электронной плотности;
–I-эффект в случае понижения
заместителем электронной плотности
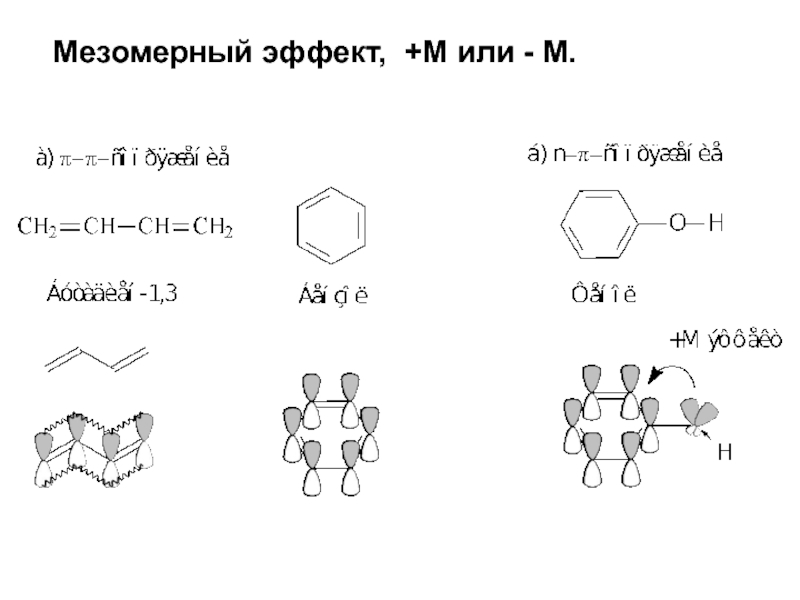
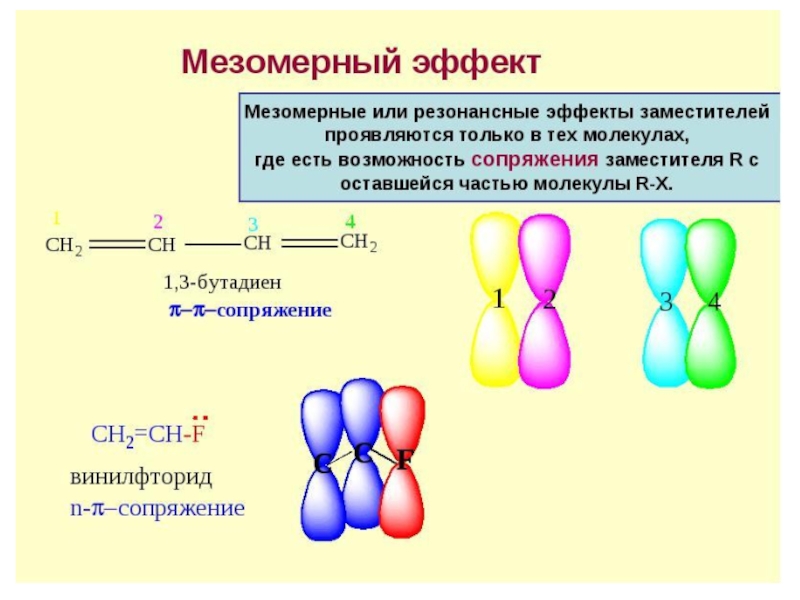
Слайд 22Смещение электронной плотности, передаваемое по цепи кратных связей, называют мезомерным
эффектом,
+М или - М.
Мезомерный эффект (эффект сопряжения, резонансный
эффект) — смещение электронной плотности химической связи по π-связям.
Мезомерный эффект объясняется теорией химического резонанса.