Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Железо
Содержание
- 1. Железо
- 2. Железо: строение атома, физические и химические свойства. Генетические ряды железа (II) и железа (III).
- 3. Положение элемента – железа в периодической системе Д.И. Менделеева.Порядковый номерПериодГруппаПодгруппа26Четвертый8Побочная
- 4. Строение атома железаДопишите электронную формулу1s2 2s2 2р6 3s2 3р6….
- 5. 1s2 2s2 2р6 3s2 3р6 3d6 4s2
- 6. Запомните! Валентные электроны атомов элементов побочных подгрупп распределяются на последнем и предпоследнем уровнях.
- 7. Для железа характерны две основные степени окисления:
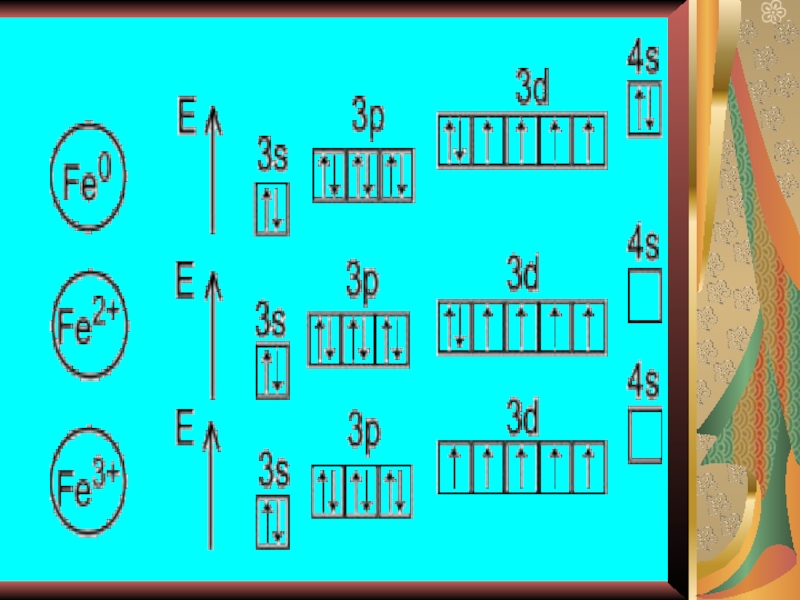
- 8. Постройте электронно – графические конфигурации нормального и возбужденного состояния атома железа.
- 9. Слайд 9
- 10. Основными железными рудами являются:магнетит (магнитный железняк) –
- 11. гематит (железный блеск, кровавик)– Fe2O3 содержит до 65% железа, такие месторождения встречаются в Криворожском районе:
- 12. лимонит (бурый железняк) – Fe2O3*nH2O содержит до 60% железа, месторождения встречаются в Крыму:
- 13. пирит (серный колчедан, железный колчедан, кошачье золото)
- 14. Соединения железа: Fe3O4 – магнитный железнякFe2O3 –
- 15. Физические свойства железа:ЦветБлескПластичностьМагнитные свойстваТемпература плавленияТвердостьСеребристо-белыйБлестящийОчень пластичный, легко куется, прокатывается, штампуетсяНамагничивается и размагничивается15390СТвердый
- 16. Железо – металл серого цвета
- 17. Получение железаFeO + C = Fe +
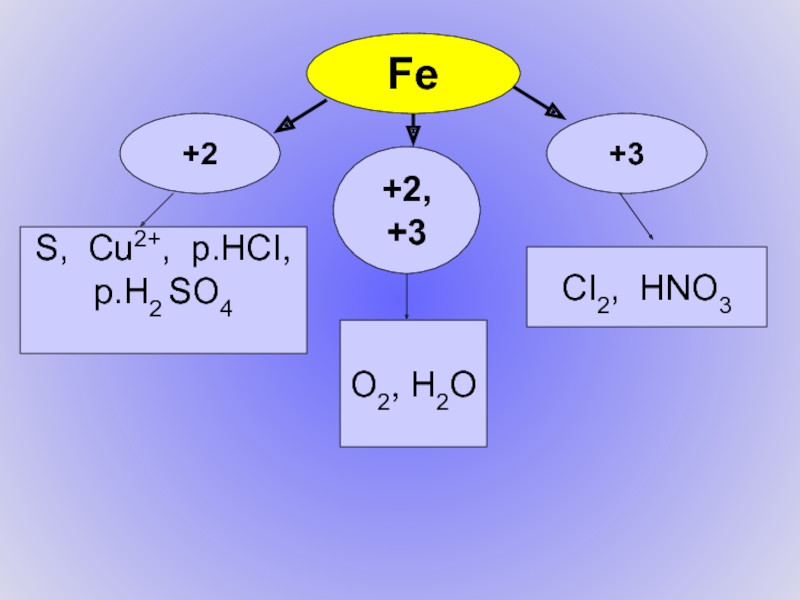
- 18. Fe+3+2+2, +3O2, H2OCI2, HNO3S, Cu2+, p.HCI, p.H2 SO4
- 19. Fe + CI2 =
- 20. Химические свойства железаВзаимодействие с простыми
- 21. Слайд 21
- 22. Слайд 22
- 23. Химические свойства железаВзаимодействие с простыми веществами -
- 24. 0 0
- 25. Химические свойства железаВзаимодействие со сложными веществами1) С
- 26. Химические свойства железа2) С кислотами.ОПЫТ: осуществите реакцию
- 27. Fe + 2HCl —>FeCl2 + H2 Металлывзаимодействуют
- 28. В концентрированных кислотах – окислителях железо растворяется только при нагревании
- 29. 2Fe + 6H2SO4(конц.) t˚C→ Fe2(SO4)3 + 3SO2
- 30. Химические свойства железа3) С солями.ОПЫТ: осуществите реакцию
- 31. Fe + CuCl2 —> FeCl2 + CuМеталлывзаимодействуют
- 32. Генетические ряды железа (II) и железа
- 33. Степень окисления металла в оксиде должна соответствовать
- 34. Какие из реакций соответствуют схеме Fe+2 =>Fe+3
- 35. I. Гидроксид железа (II)Образуется при действии растворов
- 36. Слайд 36
- 37. Гидроксид железа (III)Образуется при действии растворов щелочей
- 38. Слайд 38
- 39. Качественные реакции на ионы железа Fe2+ и Fe3+
- 40. Слайд 40
- 41. Качественные реакции на ионы железа Fe2+
- 42. Применение железа.Основная часть получаемого в мире железа
- 43. Лабораторный опыт Осуществите практически цепочки химических превращений.
- 44. Домашнее задание
- 45. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Железо: строение атома, физические и химические свойства. Генетические ряды железа (II)
и железа (III).
Слайд 3Положение элемента – железа
в периодической системе
Д.И. Менделеева.
Порядковый номер
Период
Группа
Подгруппа
26
Четвертый
8
Побочная
Слайд 51s2 2s2 2р6 3s2 3р6 3d6 4s2
Какие электроны для элементов
главных подгрупп являются валентными?
А какие электроны для элементов побочных подгрупп
являются валентными?Запомни!
Особенностью электронного строения элементов побочных подгрупп является заполнение электронами не последнего, а предпоследнего уровня.
валентные электроны
Слайд 6 Запомните!
Валентные электроны атомов элементов побочных подгрупп
распределяются на последнем и предпоследнем уровнях.
Слайд 8Постройте электронно – графические конфигурации нормального и возбужденного состояния атома
железа.
Слайд 10Основными железными рудами являются:
магнетит (магнитный железняк) – Fe3O4 содержит 72%
железа, месторождения встречаются на Южном Урале, Курской магнитной аномалии:
Слайд 11гематит (железный блеск, кровавик)– Fe2O3 содержит до 65% железа, такие
месторождения встречаются в Криворожском районе:
Слайд 12лимонит (бурый железняк) – Fe2O3*nH2O содержит до 60% железа, месторождения
встречаются в Крыму:
Слайд 13пирит (серный колчедан, железный колчедан, кошачье золото) – FeS2 содержит
примерно 47% железа, месторождения встречаются на Урале.
Слайд 14Соединения железа:
Fe3O4 – магнитный железняк
Fe2O3 – красный железняк (гематит)
2Fe2O3 *
3H2O – бурый железняк
FeS2 – железный колчедан
Слайд 15 Физические свойства железа:
Цвет
Блеск
Пластичность
Магнитные свойства
Температура плавления
Твердость
Серебристо-белый
Блестящий
Очень пластичный, легко куется, прокатывается,
штампуется
Намагничивается и размагничивается
15390С
Твердый
Слайд 19
Fe + CI2 =
Fe + S
=
Fe + HCI =
Fe + O2 =
Fe + CuSO4
=Fe + H2O =
Fe + O2 + H2O =
Закончить уравнения химических реакций:
Слайд 20Химические свойства железа
Взаимодействие с простыми веществами -неметаллами
1)
С кислородом.
0 0
+2, +3 -2 +2 -2 +3 -23Fe + 2O2 —>Fe3O4 (FeO • Fe2O3 )
Слайд 23Химические свойства железа
Взаимодействие с простыми веществами - неметаллами.
2) С серой
и хлором.
Запишите уравнение реакции и составьте электронный
баланс.Слайд 240 0 +2
-2
Fe + S —>FeS
электронный баланс
Fe0 – 2e- —> Fe2+
S0 + 2e- —> S2-
+3 -1
2Fe0 + 3Cl20 —> 2FeCl3
электронный баланс
Fe0 – 3e- —> Fe3+
Cl20 +2e- —> 2Cl1-
Почему железо является восстановителем?
1
2
Слайд 25Химические свойства железа
Взаимодействие со сложными веществами
1) С водой.
+2, +3
3Fe0 + 4H2O —>
Fe3O4 + 4H20 при t =7000 - 9000
Слайд 26Химические свойства железа
2) С кислотами.
ОПЫТ: осуществите реакцию между порошком железа
и соляной кислотой.
В каком случае возможны реакции между металлом
и кислотой?Составить уравнение реакции.
Сделать вывод.
Fe
FeCl
2
Слайд 27Fe + 2HCl —>FeCl2 + H2
Металлы
взаимодействуют с кислотами
если:
1.
Металл находится в ряду активности металлов до водорода.
2. Должна получиться
растворимая соль.3. Реакция характерна для растворов кислот.
4. Металл + кислота → соль + водород
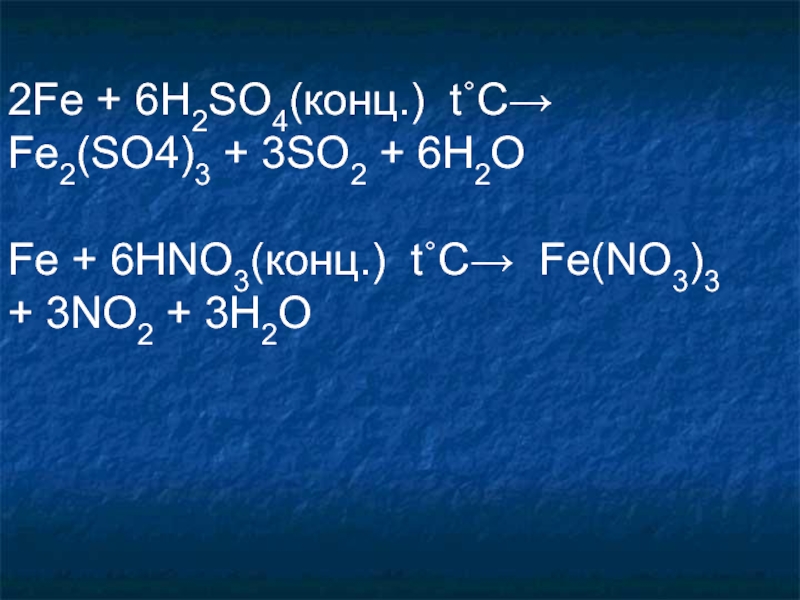
Слайд 292Fe + 6H2SO4(конц.) t˚C→ Fe2(SO4)3 + 3SO2 + 6H2O
Fe +
6HNO3(конц.) t˚C→ Fe(NO3)3 + 3NO2 + 3H2O
Слайд 30Химические свойства железа
3) С солями.
ОПЫТ: осуществите реакцию между порошком железа
и раствором хлорида
меди (II).
В каком случае возможны реакции между
металлом и растворами солей?Составить уравнение реакции.
Сделать вывод.
Слайд 31Fe + CuCl2 —> FeCl2 + Cu
Металлы
взаимодействуют с растворами солей
если:
1. Каждый металл вытесняет из растворов солей все другие металлы,
расположенные правее его в ряду напряжений.2. Обе соли (и реагирующая, и образующая в результате реакции) должны быть растворимыми.
Слайд 32Генетические ряды
железа (II) и железа (III).
Задание:
запишите формулы оксида
железа (II) и оксида железа (III);
составьте соответствующие им формулы гидроксидов;
отметьте
характер этих соединений.Слайд 33Степень окисления металла в оксиде должна соответствовать степени окисления металла
в соответствующем гидроксиде
+2
+2FeO —>Fe(OH)2
Данный оксид носит основный характер.
Какие реакции подтверждают основный характер оксидов?
+3 +3
Fe2O3 —> Fe(OH)3
Какие соединения называются амфотерными?
Слайд 34Какие из реакций соответствуют схеме Fe+2 =>Fe+3 ?
1) 2FeCI2 +
CI2 = 2FeCI3
2) FeCI3 + 3NaOH = Fe(OH)3 + 3NaCI
3)
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3Слайд 35I. Гидроксид железа (II)
Образуется при действии растворов щелочей на соли
железа (II) без доступа воздуха:
FeCl2 + 2KOH = 2KCl +
Fе(OH)2↓Fe(OH)2 - слабое основание, растворимо в сильных кислотах:
Fe(OH)2 + H2SO4 = FeSO4 + 2H2O
Fe(OH)2 + 2H+ = Fe2+ + 2H2O
Слайд 37Гидроксид железа (III)
Образуется при действии растворов щелочей на соли трёхвалентного
железа: выпадает в виде красно–бурого осадка
Fe(NO3)3 + 3KOH = Fe(OH)3↓
+ 3KNO3Fe3+ + 3OH- = Fe(OH)3↓
Слайд 41Качественные реакции
на ионы железа Fe2+ и Fe3+
На ионы Fe2+
+2
+3 +2FeCl2 + K3[Fe(CN)6] —> KFe[Fe(CN)6]+2KCL
красная кровяная соль синий осадок
-----------------------------------------------------------------------------------------------------------
На ионы Fe3+
+3 +3 +2
FeCl3 + K4[Fe(CN)6] —> KFe[Fe(CN)6]+3KCL
желтая кровяная соль синий осадок
+3 +3
FeCl3 + KCNS —> Fe(CNS)3 + 3KCl
роданид калия раствор красного
цвета