Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Основы дизайна функциональных материалов Лекция № 4 ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ И
Содержание
- 1. Основы дизайна функциональных материалов Лекция № 4 ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ И
- 2. Классификация дисперсных систем по размеру частиц1. Грубодисперсные
- 3. По размерам частиц дисперсной фазы выделяют высокодисперсные (ультрамикрогетерогенные),
- 4. Частицы, расположенные на поверхности, находятся в другом
- 5. Общая величина поверхностной энергии фазы будет определяться
- 6. Поверхностная энергия фазы и поверхностное натяжение может
- 7. Свободную энергию фазы G можно представить как
- 8. Из уравнения (IV.4) следует, что при одном
- 9. На границе конденсированной (т.е. твердой или жидкой)
- 10. Адсорбция на границе раствор - пар
- 11. Слайд 11
- 12. Уменьшение поверхностного натяжения и, следовательно, поверхностной энергии
- 13. Структуры , возникающие в растворах ПАВ:
- 14. Количественной мерой адсорбции на границе раствор-пар является
- 15. Поверхностную активность ПАВ при некоторой концентрации C1
- 16. Для водных растворов органических веществ, Траубе и
- 17. При малой концентрации раствора тепловое движение нарушает
- 18. Адсорбция на границе твердое тело - газПри
- 19. Физическая адсорбция возникает за счет ван-дер-ваальсовых взаимодействий.
- 20. Явления физической и химической адсорбции четко различаются
- 21. Теории адсорбции Теория мономолекулярной адсорбции Лэнгмюра1. Адсорбция является
- 22. Скорость десорбции прямо пропорциональна доле занятых активных
- 23. Так как Х = Г / Г0
- 24. При описании процесса адсорбции газов в уравнении
- 25. Теория полимолекулярной адсорбции ПоляниЧасто (особенно при адсорбции
- 26. Основные положения теории Поляни:1. Адсорбция вызвана чисто физическими
- 27. Теория Фрейндлиха 1. Поверхность адсорбента неоднородна, 2.
- 28. Показатель степени n и коэффициент пропорциональности а
- 29. Слайд 29
- 30. Адсорбция на границе твердое тело - раствор
- 31. Слайд 31
- 32. Адсорбция из растворов электролитовАдсорбция из водных растворов
- 33. Обменная адсорбция представляет собой процесс обмена ионов
- 34. КОЛЛОИДНЫЕ СИСТЕМЫ Коллоидные частицы имеют весьма малые
- 35. Коллоидные системы подразделяются на две группы, резко
- 36. Лиофильные системы термодинамически устойчивы (Δ G ≤
- 37. При длительном хранении гидрофильные золи переходят в
- 38. Для лиофобных коллоидов единицей структуры является сложный
- 39. Дисперсионные методыПроцесс диспергирования осуществляется
- 40. Схема коллоидной мельницы: а – неподвижные выступы, b – лопасти
- 41. Методы конденсацииЭтот метод основан на конденсации паров
- 42. В 1 и 3 прибора подвергаются испарению
- 43. Коллоидные растворы можно получать также и методом
- 44. СТРОЕНИЕ КОЛЛОИДНЫХ ЧАСТИЦобразования частиц на примере образования
- 45. 1. При избытке AgNO3 в растворе будут
- 46. В процесс адсорбции противоионов устанавливается динамическое равновесие
- 47. Образование мицеллы AgI в избытке AgNO3: I
- 48. Процесс адсорбции противоионов, в результате которого установится
- 49. Строение двойного электрического слоя: 1 – потенциалопределяющие
- 50. Строение мицеллы золя коллоидного золота можно представить
- 51. Золь серы может быть получен окислением сероводорода
- 52. Процесс гидролиза различных солей может приводить к
- 53. Избирательное поглощение и рассеяние света объясняют окраску
- 54. Слайд 54
- 55. ОЛЯЦИЯГИДРОКСОКОМПЛЕКСЫ, координац. соед., содержащие в кач-ве лигандов
- 56. Реакции гидролиза и конденсации Si(OC2H5)4 + xH2O
- 57. Коллоидные растворы SiO2 в воде, полученные золь – гель методом. Влияние размера частиц на седиментационную устойчивость.
- 58. Фотография с оптического микроскопа (не видна микроструктура частиц).
- 59. Фотография с электронного микроскопа (видна микроструктура частиц).
- 60. По мере протекания гидролиза ТЭОС равновесие сильно
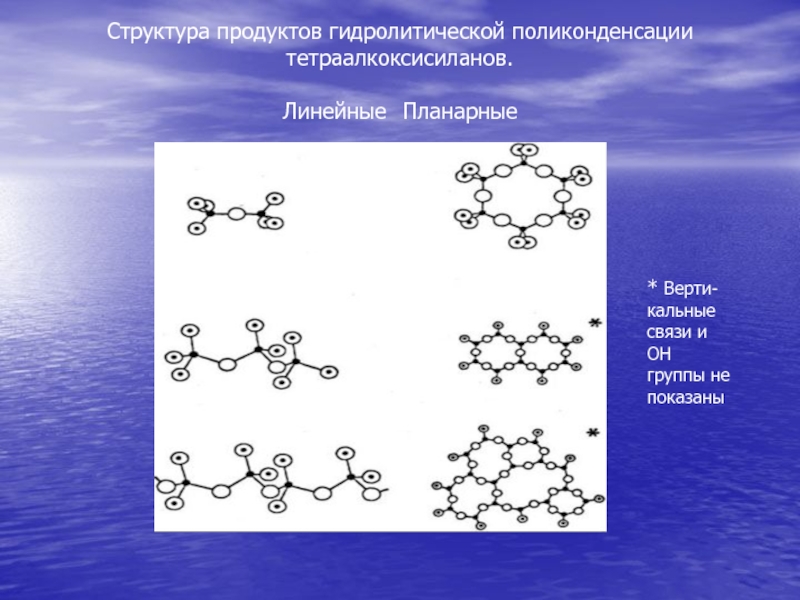
- 61. Структура продуктов гидролитической поликонденсации тетраалкоксисиланов. Линейные Планарные * Верти-кальные связи и ОН группы не показаны
- 62. Форма коллоидных частиц далеко не всегда шарообразна.
- 63. Фрактальные наночастицы оксида кремния
- 64. Микроэмульсии - это термодинамически стабильные изотропные дисперсии
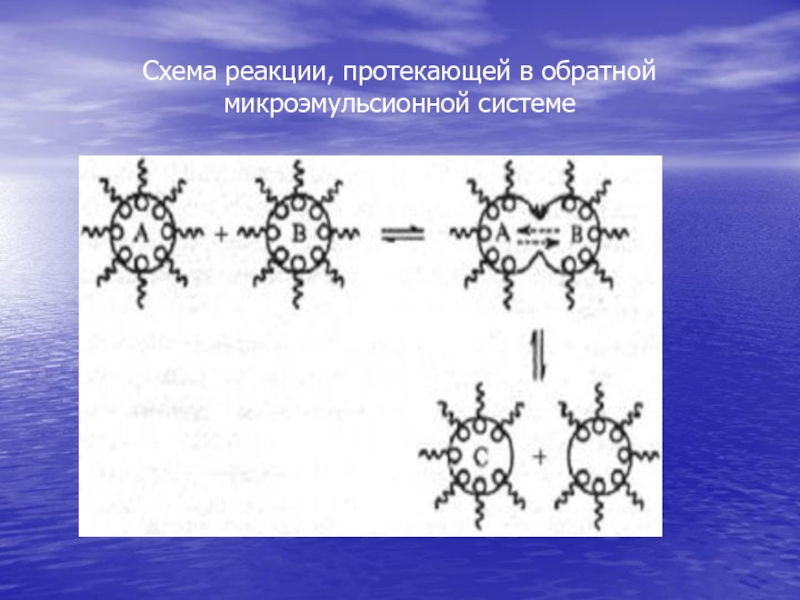
- 65. Схема реакции, протекающей в обратной микроэмульсионной системе
- 66. Тонкие возможности управления процессом зарождения золя и
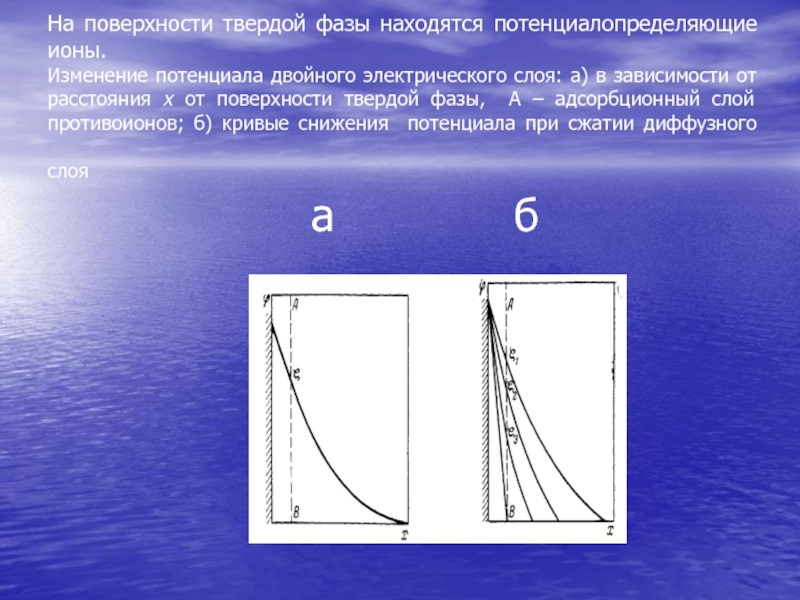
- 67. На поверхности твердой фазы находятся потенциалопределяющие ионы.
- 68. Наибольший интерес представляет потенциал на границе скольжения
- 69. Рассеяние света, окраска коллоидовКоллоидные растворы обладают оптическими
- 70. Эффект Тиндаля, рассеяние Тиндаля (англ. Tyndall effect) — оптический эффект, рассеяние света
- 71. Слайд 71
- 72. Задание на дом для всех: 1.
- 73. Электрические свойства коллоидных растворов 1. Электрофорез коллоидных
- 74. 2. Эффект Дорна (потенциал седиментации)Дорн в 1878 г. обнаружил,
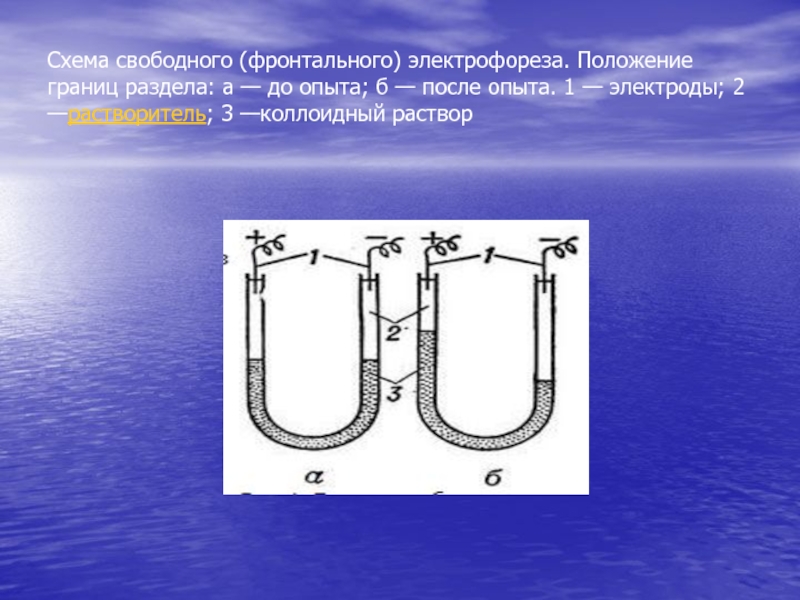
- 75. Схема свободного (фронтального) электрофореза. Положение границ раздела:
- 76. Различают следующие виды электрофореза. 1. Свободный
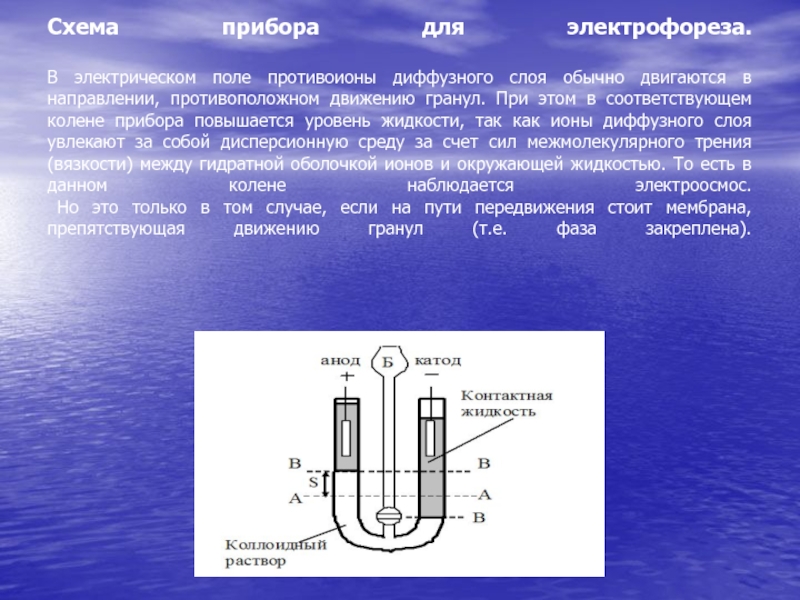
- 77. Схема прибора для электрофореза. В электрическом
- 78. При свободном передвижении диффузный слой удерживается гранулой
- 79. 4. Потенциал течения Если под действием давления заставить
- 80. Описанные четыре явления, в которых происходит передвижение
- 81. ЗАДАЧИВариант 11.Золь сернокислого бария получен смешением равных
- 82.
- 83. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Основы дизайна функциональных материалов
Лекция № 4
ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ И АДСОРБЦИЯ
Cвойства
Слайд 2Классификация дисперсных систем по размеру частиц
1. Грубодисперсные системы - 10-7
10-5 м, Тв/Ж – взвесь, суспензия (взмученная глина в воде);
Ж/Ж – эмульсия (капли масла в воде). Системы неустойчивы. Частицы видны в оптический микроскоп.2. Коллоидные системы - 10-8 10-7 м, Частицы в оптическом микроскопе не обнаруживаются. Системы относительно устойчивы, но со временем разрушаются.
Для получения коллоидных систем затрачивается внешняя энергия, т.е. не самопроизвольно.
3. Истинные растворы - < 10-9 м, Молекулярно-дисперсные, или ионно-дисперсные системы. Растворы устойчивы, не разрушаются, получаются самопроизвольно.
Слайд 3По размерам частиц дисперсной фазы выделяют высокодисперсные (ультрамикрогетерогенные), среднедисперсные (микрогетерогенные) и
грубодисперсные системы (10–9–10–7м, 10–7–10–5м и более 10–5м соответственно). В основе классификации
пористых систем размерам пор, лежит деление, предложенное М. М. Дубининым. Микропористыми называют пористые материалы с размерами пор до 2 нм, мезопористыми — от 2 до 50 нм, макропористыми — свыше 50 нм. Также дисперсные системы классифицируют по числу характерных размеров, по наличию частиц одникакового или разных размеров.Наиболее общая классификация дисперсных систем основана на различии в агрегатном состоянии дисперсионной среды и дисперсной фазы была предложена Вольфгангом Оствальдом и затем несколько упрощена Р. Зигмонди. По взаимодействию между частицами дисперсной фазы дисперсные системы делят на:связнодисперсные системы и свободнодисперсные системы.
По характеру взаимодействия коллоидных частиц с дисперсионной средой дисперсные системы делят на лиофильные и лиофобные. Впервые эта классификация была предложена немецким ученым Фрейндлихоми затем развита П.А. Ребиндером.
Слайд 4Частицы, расположенные на поверхности, находятся в другом окружении по сравнению
с частицами, находящимися в объеме фазы, т.е. взаимодействуют как с
однородными частицами, так и с частицами другого рода.Следствием этого является то, что средняя энергия gs частицы, находящейся на поверхности раздела фаз, отличается от средней. Поэтому важнейшей характеристикой поверхностной фазы является повеpxноcmнaя энергия GS - разность средней энергии частицы, находящейся на поверхности, и частицы, находящейся в объеме фазы, умноженная на число частиц на поверхности N:
Слайд 5Общая величина поверхностной энергии фазы будет определяться величиной её поверхности
S.
Для характеристики поверхности раздела, отделяющей данную фазу от другой,
вводится понятие поверхностного натяжения σ - отношение поверхностной энергии к площади поверхности раздела фаз; величина поверхностного натяжения зависит только от природы обеих фаз. Слайд 6Поверхностная энергия фазы и поверхностное натяжение может иметь как положительное,
так и отрицательное значение.
1. Поверхностное натяжение положительно, если находящиеся
на поверхности частицы взаимодействуют с частицами этой же фазы сильнее, чемсчастицами другой фазы (и, следовательно, gs > gv). Согласно принципу минимума свободной энергии ,любая фаза будет стремиться самопроизвольно уменьшить свою поверхностную энергию; поэтому в случае положительного поверхностного натяжения (σ > 0) фаза стремится уменьшить свою поверхность. Слайд 7Свободную энергию фазы G можно представить как сумму поверхностной Gs
и объемной Gv энергий, пропорциональных соответственно площади поверхности и объему
фазы:Разделив это выражение на объем фазы, получаем:
Слайд 8Из уравнения (IV.4) следует, что при одном и том же
количестве фазы (т.е. неизменном объеме) вклад поверхностной энергии в общую
энергию фазы возрастает с увеличением удельной поверхности (степени дисперсности (раздробленности) фазы). В случае, когда степень дисперсности фазы невелика (удельная поверхность незначительна), вкладом поверхностной энергии в полную энергию фазы обычно пренебрегают.Вклад поверхностного слоя в свойства
фазы и системы в целом учитывают при изучении
дисперсных систем -
гетерогенных систем, одна из фаз которой является сплошной (дисперсионная среда), а другая - раздробленной (дисперсная фаза).
Слайд 9На границе конденсированной (т.е. твердой или жидкой) фазы с газом
поверхностное натяжение всегда положительно, поскольку частицы конденсированной фазы взаимодействуют друг
с другом сильнее, чем с молекулами газа. Согласно принципу минимума свободной энергии, конденсированная фаза будет стремиться самопроизвольно уменьшить свою поверхностную энергию.Это может быть результатом либо уменьшения площади поверхности фазы (именно поэтому капля жидкости в невесомости принимает форму сферы), либо уменьшения поверхностного натяжения при появлении на поверхности раздела фаз новых частиц - молекул газа либо растворенного вещества. Процесс самопроизвольного изменения концентрации какого-либо вещества у поверхности раздела двух фаз называется адсорбцией.
Слайд 10Адсорбция на границе
раствор - пар
В жидких растворах поверхностное
натяжение σ является функцией от концентрации растворенного вещества. Вещества, добавление
которых к растворителю уменьшает поверхностное натяжение, называют поверхностно-активными (ПАВ), вещества, добавление которых увеличивает или не изменяет поверхностное натяжение - поверхностно-инактивными (ПИАВ).Слайд 12Уменьшение поверхностного натяжения и, следовательно, поверхностной энергии происходит в результате
адсорбции ПАВ на поверхности раздела жидкость - пар, т.е. того,
что концентрация поверхностно-активного вещества в поверхностном слое раствора оказывается больше, чем в глубине раствора.Слайд 13 Структуры , возникающие в растворах ПАВ: 1 - мономеры, 2 -
мицелла, 3 - цилиндрическая мицелла, 4 - гексагонально упакованные цилиндрические
мицеллы, 5 - ламинарная мицелла, 6 - гексагонально упакованные капли воды в обратной мицеллярной системеСлайд 14Количественной мерой адсорбции на границе раствор-пар является поверхностный избыток Г
(гамма), равный числу молей растворенного вещества в поверхностном слое.
Количественное соотношение
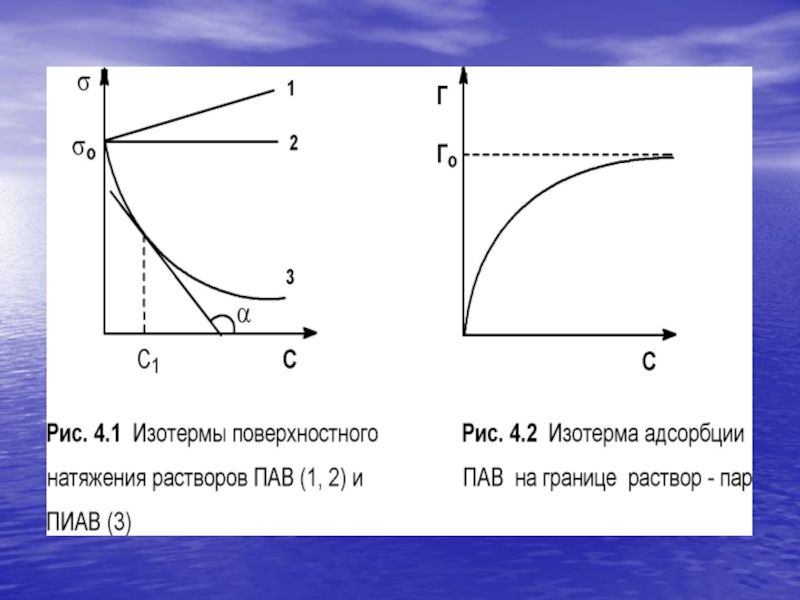
между адсорбцией (поверхностным избытком) растворенного вещества и изменением поверхностного натяжения раствора с ростом концентрации раствора определяет изотерма адсорбции Гиббса:Г = - С/RT dσ/dC(IV.5)
График изотермы адсорбции ПАВ представлен на рис. 4.2. Из уравнения (IV.5) следует, что направление процесса - концентрирование вещества в поверхностном слое или, наоборот, нахождение его в объеме жидкой фазы - определяется знаком производной dσ/dC.
Слайд 15Поверхностную активность ПАВ при некоторой концентрации C1 определяют графически, проводя
касательную к изотерме поверхностного натяжения в точке С = C1;
при этом поверхностная активность численно равна тангенсу угла наклона касательной к оси концентраций:g = - dσ/ dC = tgα (IV.6)
Поверхностную активность вещества обычно определяют при бесконечно малой концентрации раствора; в этом случае величина g0 зависит только от природы ПАВ и растворителя.
Слайд 16Для водных растворов органических веществ, Траубе и Дюкло установили, что
для гомологических рядов поверхностно-активных веществ эмпирическое правило:
В любом гомологическом ряду
при малых концентрациях удлинение углеродной цепи на одну группу CH2 увеличивает поверхностную активность в 3 - 3.5 раза.Слайд 17При малой концентрации раствора тепловое движение нарушает ориентацию молекул ПАВ;
при повышении концентрации происходит насыщение адсорбционного слоя и на поверхности
раздела фаз образуется слой "вертикально" ориентированных молекул ПАВ (рис. 4.3).Образование такого мономолекулярного слоя соответствует минимальной величине поверхностного натяжения раствора ПАВ и максимальному значению адсорбции Г (рис. 4.1-4.2); при дальнейшем увеличении концентрации ПАВ в растворе поверхностное натяжение и адсорбция не изменяются.
Слайд 18Адсорбция на границе твердое тело - газ
При адсорбции газов на
твердых телах описание взаимодействия молекул адсорбата и адсорбента представляет собой весьма
сложную задачу, поскольку характер их взаимодействия, определяющий характер адсорбции, может быть различным. Задачу упрощают, рассматривая два крайних случая, когда адсорбция вызывается физическими или химическими силами - физическую и химическую адсорбцию.Слайд 19Физическая адсорбция возникает за счет ван-дер-ваальсовых взаимодействий. Она характеризуется обратимостью
и уменьшением адсорбции при повышении температуры, т.е. экзотермичностью, причем тепловой
эффект физической адсорбции обычно близок к теплоте сжижения адсорбата (10 - 80 кДж/моль). Пример - адсорбция инертных газов на угле.Химическая адсорбция (хемосорбция) осуществляется путем химического взаимодействия молекул адсорбента и адсорбата. Хемосорбция обычно необратима; химическая адсорбция, в отличие от физической, является локализованной, т.е. молекулы адсорбата не могут перемещаться по поверхности адсорбента. Так как хемосорбция является химическим процессом, требующим энергии активации порядка 40 - 120 кДж/моль, повышение температуры способствует её протеканию. Т.е. это процесс – эндотермический.
Примером химической адсорбции является адсорбция кислорода на вольфраме или серебре при высоких температурах.
Слайд 20Явления физической и химической адсорбции четко различаются в очень редких
случаях. Обычно осуществляются промежуточные варианты, когда основная масса адсорбированного вещества
связывается сравнительно слабо и лишь небольшая часть - прочно. Например, кислород на металлах или водород на никеле при низких температурах адсорбируются по законам физической адсорбции, но при повышении температуры начинает протекать химическая адсорбция. При повышении температуры увеличение химической адсорбции с некоторой температуры начинает перекрывать падение физической адсорбции, поэтому температурная зависимость адсорбции в этом случае имеет четко выраженный минимум (рис. 4.4).Слайд 21Теории адсорбции
Теория мономолекулярной адсорбции Лэнгмюра
1. Адсорбция является локализованной и вызывается
силами, близкими к химическим.
2. Адсорбция происходит не на всей поверхности адсорбента,
а на активных центрах, которыми являются выступы либо впадины на поверхности адсорбента, характеризующиеся наличием т.н. свободных валентностей. Активные центры считаются независимыми (т.е. один активный центр не влияет на адсорбционную способность других), и тождественными.3. Каждый активный центр способен взаимодействовать только с одной молекулой адсорбата; в результате на поверхности может образоваться только один слой адсорбированных молекул.
4. Процесс адсорбции является обратимым и равновесным - адсорбированная молекула удерживается активным центром некоторое время, после чего десорбируется; через некоторое время между процессами адсорбции и десорбции устанавливается динамическое равновесие. В равновесии скорость адсорбции равна скорости десорбции.
Слайд 22Скорость десорбции прямо пропорциональна доле занятых активных центров (х), а
скорость адсорбции прямо пропорциональна произведению концентрации адсорбата на долю свободных
активных центров (1 - х):VD=kDx (IV.7);
VA=kAC(1-x) (IV.8);
kAC(1-x) = kDx (IV.9);
X = kAC/kD + kAC (IV.10)
Разделим числитель и знаменатель правой части уравнения (IV.10) на kA получаем:
Х = С / kD/ kA + С = C / b + C (IV.11)
Максимально возможная величина адсорбции Г0 достигается при условии, что все активные центры заняты молекулами адсорбата, т.е. x = 1. Отсюда следует, что x = Г / Г0.
Слайд 23Так как Х = Г / Г0 = C /
C + b (IV.12) Г = Г0 C / C +
b (IV.13)Уравнение (IV. 13) - есть изотерма мономолекулярной адсорбции, связывающая величину адсорбции Г с концентрацией адсорбата С. Здесь b - некоторая постоянная для данной пары адсорбент - адсорбат величина (отношение констант скоростей десорбции и адсорбции), численно равная концентрации адсорбата, при которой занята половина активных центров. График изотермы адсорбции Лэнгмюра приведен на рис. 4.5. Константу b можно определить графически, проведя касательную к изотерме адсорбции в точке С = 0.
Слайд 24При описании процесса адсорбции газов в уравнении (IV. 13) концентрация
может быть заменена пропорциональной величиной парциального давления газа: Г = Г0
Р/ (Р + b) (IV.14)Теория мономолекулярной адсорбции Лэнгмюра применима для описания некоторых процессов адсорбции газов и растворенных веществ при небольших давлениях (концентрациях) адсорбата.
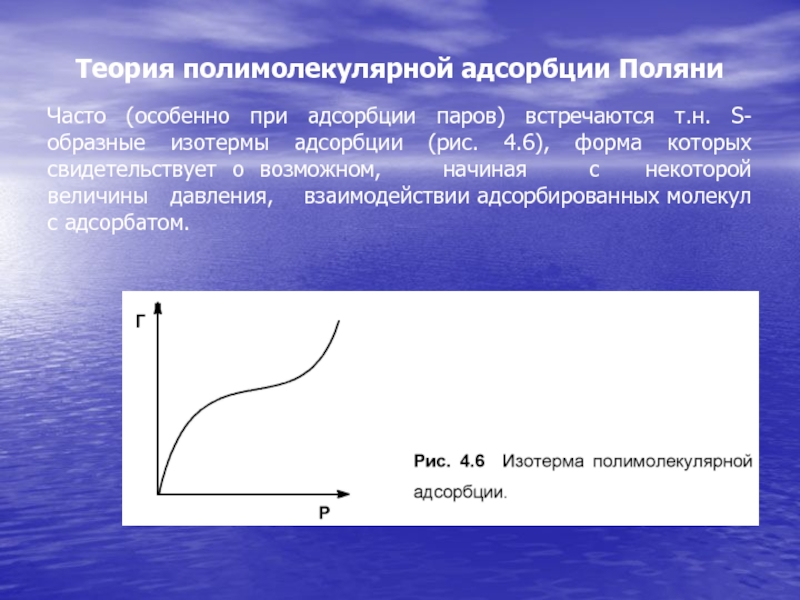
Слайд 25Теория полимолекулярной адсорбции Поляни
Часто (особенно при адсорбции паров) встречаются т.н.
S-образные изотермы адсорбции (рис. 4.6), форма которых свидетельствует о возможном,
начиная с некоторой величины давления, взаимодействии адсорбированных молекул с адсорбатом.Слайд 26Основные положения теории Поляни:
1. Адсорбция вызвана чисто физическими силами.
2. Поверхность адсорбента однородна,
т.е. на ней нет активных центров; адсорбционные силы образуют непрерывное
силовое поле вблизи поверхности адсорбента.3. Адсорбционные силы действуют на расстоянии, большем размера молекулы адсорбата. Иначе говоря, у поверхности адсорбента существует некоторый адсорбционный объем, который при адсорбции заполняется молекулами адсорбата.
4. Притяжение молекулы адсорбата поверхностью адсорбента не зависит от наличия в адсорбционном объеме других молекул, вследствие чего возможна полимолекулярная адсорбция.
5. Адсорбционные силы не зависят от температуры и, следовательно, с изменением температуры адсорбционный слой не изменяется.
Слайд 27Теория Фрейндлиха
1. Поверхность адсорбента неоднородна,
2. Между адсорбированными частицами
имеет место взаимодействие, активные центры не являются полностью независимыми друг
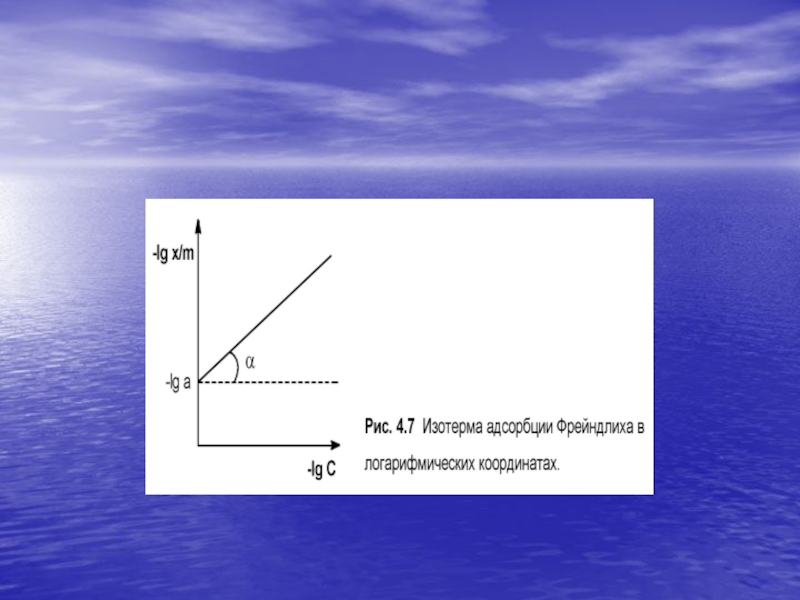
от друга и т.д Это усложняет вид уравнения изотермы.Г.Фрейндлих предположил, что число молей адсорбированного газа или растворенного вещества, приходящееся на единицу массы адсорбента (т.н. удельная адсорбция x/m) должна быть пропорциональна равновесному давлению (для газа) или равновесной концентрации (для веществ, адсорбируемых из раствора) адсорбента, возведенной в некоторую степень, которая всегда меньше единицы:
Слайд 28Показатель степени n и коэффициент пропорциональности а в уравнении Фрейндлиха
определяются экспериментально. lg x/m = nlgP + lga
(IV.17) lg x/m = nlgC + lga (IV.18)зависимость логарифма удельной адсорбции от логарифма концентрации (давления) графически выражается прямой линией, отсекающей на оси ординат отрезок, равный lg а, тангенс угла наклона которой к оси абсцисс равен по величине показателю степени при давлении или концентрации (рис. 4.7):
tga = n
Слайд 30Адсорбция на границе твердое тело - раствор
Молекулярная адсорбция из растворов
Для
разбавленных растворов изотермы адсорбции из растворов хорошо описываются уравнениями Фрейндлиха
или Лэнгмюра, если в них подставить равновесную концентрацию растворенного вещества.Молекулы многих органических веществ состоят из полярной (гидрофильной) и неполярной(гидрофобной) группировок, т.е. являются поверхностно-активными веществами.
Молекулы ПАВ при адсорбции на твердом адсорбенте ориентируются на его поверхности таким образом, чтобы полярная часть молекулы была обращена к полярной фазе, а неполярная - к неполярной.
Например, при адсорбции алифатических карбоновых кислот из водных растворов на неполярном адсорбенте - активированном угле - молекулы ориентируются углеводородными радикалами к адсорбенту; при адсорбции из бензола (неполярный растворитель) на полярном адсорбенте - силикагеле - ориентация молекул кислоты будет обратной (рис. 4.8).
Слайд 32Адсорбция из растворов электролитов
Адсорбция из водных растворов электролитов происходит, как
правило, таким образом, что на твердом адсорбента из раствора адсорбируются
преимущественно ионы одного вида.Преимущественная адсорбция из раствора или аниона, или катиона определяется природой адсорбента и ионов.
Механизм адсорбции ионов из растворов электролитов может быть различным; выделяют обменную и специфическую адсорбцию ионов.
Слайд 33Обменная адсорбция представляет собой процесс обмена ионов между раствором и твердой
фазой, при котором твердая фаза поглощает из раствора ионы какого-либо
знака (катионы либо анионы) и вместо них выделяет в раствор эквивалентное число других ионов того же знака. Обменная адсорбция всегда специфична, т.е. для данного адсорбента к обмену способны только определенные ионы; обменная адсорбция обычно необратима.При специфической адсорбции адсорбция на поверхности твердой фазы ионов какого-либо вида не сопровождается выделением в раствор эквивалентного числа других ионов того же знака; твердая фаза при этом приобретает электрический заряд. Это приводит к тому, что вблизи поверхности под действием сил электростатического притяжения группируется эквивалентное число ионов с противоположным зарядом, т.е. образуется двойной электрический слой. Взаимодействие концентрирующихся на поверхности зарядов приводит к понижению поверхностной энергии системы.
Для случая специфической адсорбции электролита Песковым и Фаянсом было сформулировано следующее эмпирическое правило:
«На поверхности кристаллического твердого тела из раствора электролита специфически адсорбируется ион, который способен достраивать его кристаллическую решетку или может образовывать с одним из ионов, входящим в состав кристалла, малорастворимое соединение».
Слайд 34КОЛЛОИДНЫЕ СИСТЕМЫ
Коллоидные частицы имеют весьма малые размеры и поэтому
участвуют в броуновском движении, в то же время они обладают
заметной скоростью диффузии (10-1 10-3 см2/с), что способствует выравниванию концентрации частиц по объему. Кроме того, если раздробить 1 см3 вещества до размера коллоидной частицы, то суммарная площадь всех граней дисперсной фазы составит от 60 до 600 м2. В этом случае частицы приобретают избыточную энергию, вследствие чего увеличивается адсорбция.Коллоидные растворы – принципиально неустойчивые системы. Они стремятся к самопроизвольному уменьшению межфазной поверхности, то есть к снижению дисперсности.
Слайд 35Коллоидные системы подразделяются на две группы, резко отличные по характеру
взаимодействий между частицами дисперсной фазы и дисперсионной среды - лиофобные
коллоидные растворы (золи) и растворы высокомолекулярных соединений (ВМС), которые ранее называли лиофильными коллоидами.К лиофобным коллоидам относятся системы, в которых частицы дисперсной фазы слабо взаимодействуют с дисперсионной средой; эти системы могут быть получены только с затратой энергии и устойчивы лишь в присутствии стабилизаторов.
Растворы высокомолекулярных соединений (ВМС) образуются самопроизвольно благодаря сильному взаимодействию частиц дисперсной фазы с дисперсионной средой и способны сохранять устойчивость без стабилизаторов. Лиофобные коллоиды и растворы ВМС различаются также и структурой частиц, составляющих дисперсную фазу.
Слайд 36Лиофильные системы термодинамически устойчивы (Δ G ≤ 0) и характеризуются
самопроизвольным диспергированием. Так, мыла и многие глины (например, бентонитовая) самопроизвольно
«распускаются» в воде, а ВМС растворяются в «хорошем» растворителе до отдельных макромолекул и представляют собой истинные растворы.В лиофобных системах самопроизвольного диспергирования не происходит, но они могут быть лиофилизированы в той или иной степени.
Свойство коллоидных систем увеличивать размер частиц путем их агрегации называется агрегативной неустойчивостью. Агрегативная неустойчивость преодолевается путем адсорбции ионов или молекул на частицах дисперсной фазы, за счет чего на границе раздела фаз формируется скачок потенциала.
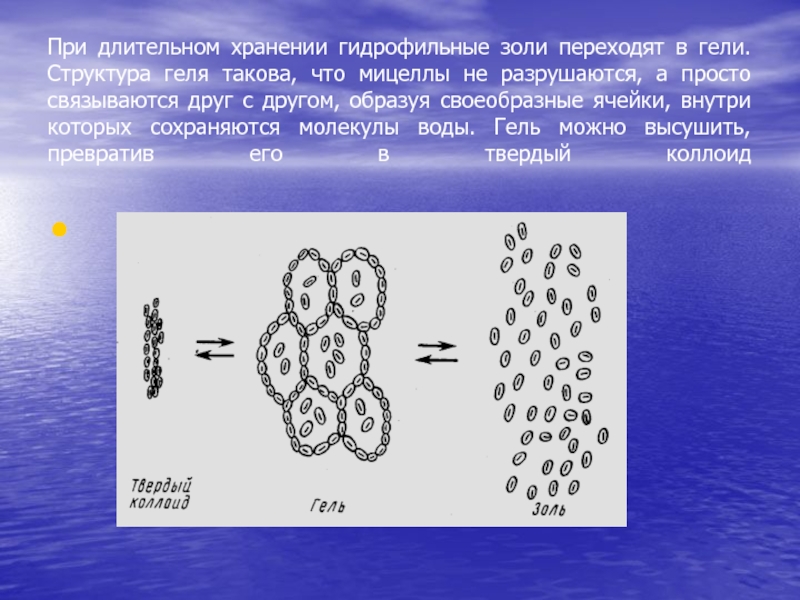
Слайд 37При длительном хранении гидрофильные золи переходят в гели. Структура геля
такова, что мицеллы не разрушаются, а просто связываются друг с
другом, образуя своеобразные ячейки, внутри которых сохраняются молекулы воды. Гель можно высушить, превратив его в твердый коллоид
Слайд 38Для лиофобных коллоидов единицей структуры является сложный многокомпонентный агрегат переменного
состава - мицелла, для растворов ВМС - макромолекула.
Методы получения лиофобных
коллоидов: коллоидные растворы могут быть получены:
1. путем ассоциации (конденсации) молекул и ионов истинных растворов,
2. дальнейшим раздроблением частиц дисперсной фазы грубодисперсных систем.
Методы получения коллоидных растворов также можно разделить на две группы: методы конденсации и диспергирования (в отдельную группу выделяется метод пептизации.
Еще одним необходимым для получения золей условием, помимо доведения размеров частиц до коллоидных, является наличие в системе стабилизаторов - веществ, препятствующих процессу самопроизвольного укрупнения колодных частиц.
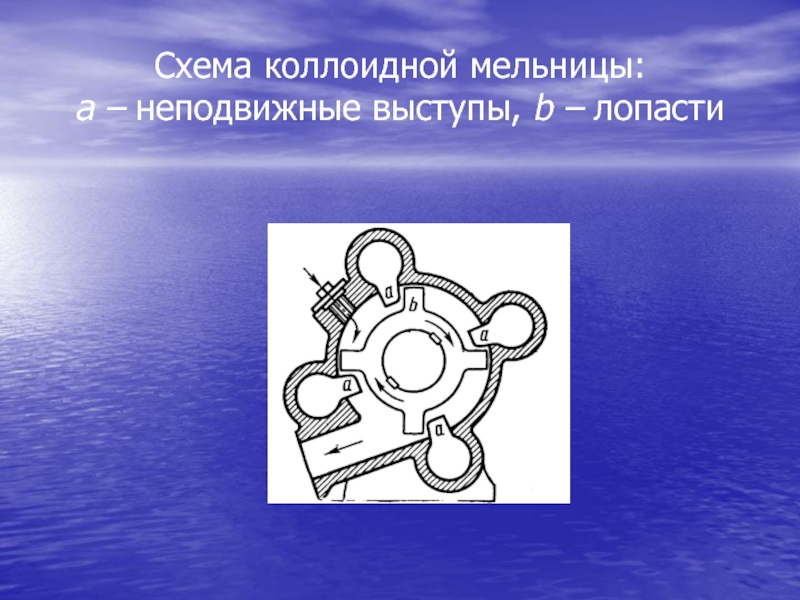
Слайд 39Дисперсионные методы
Процесс диспергирования осуществляется различными
методами: механическим размалыванием вещества в т.н. коллоидных
мельницах, электродуговым распылением металлов, дроблением вещества при помощи ультразвука.Частички вещества в коллоидных мельницах в предварительно измельченном виде смешиваются с соответствующей жидкостью, содержащей стабилизатор, и в виде взвеси подаются через загрузочное отверстие. При помощи быстро вращающихся лопастей взвесь приводится в быстрое вращение, в результате чего частицы вещества приобретают скорость и, ударяясь о неподвижные выступы, разбиваются на более мелкие частицы.
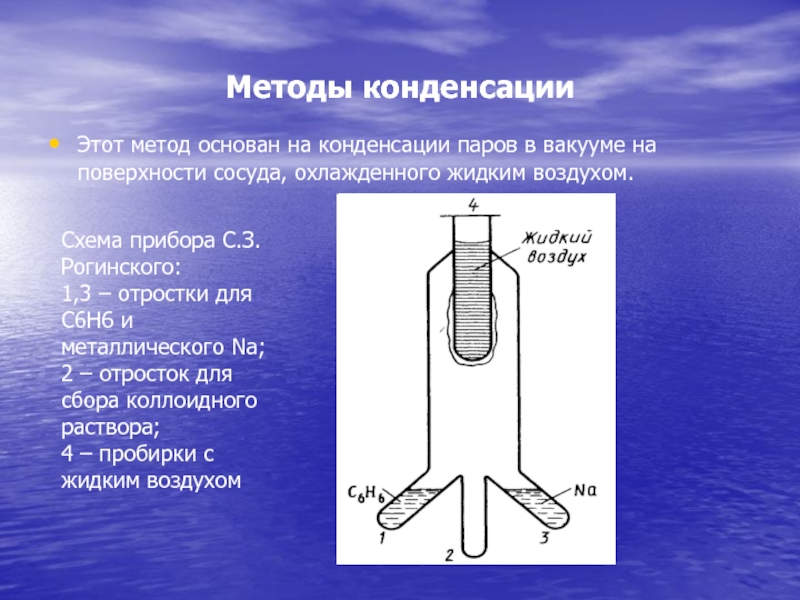
Слайд 41Методы конденсации
Этот метод основан на конденсации паров в вакууме на
поверхности сосуда, охлажденного жидким воздухом.
Схема прибора С.З. Рогинского:
1,3 – отростки
для С6Н6 и металлического Na;
2 – отросток для сбора коллоидного раствора;
4 – пробирки с жидким воздухомСлайд 42В 1 и 3 прибора подвергаются испарению одновременно диспергируемое вещество
(например, натрий) и дисперсионная среда (например, бензол) при температуре 673
К. Пары этих веществ конденсируются на поверхности сосуда 4, охлаждаемого жидким воздухом до 197 К., при этом охлажденный твердый бензол, намерзающий на стенках, содержит затвердевший натрий. После удаления из сосуда 4 жидкого воздуха температура постепенно повышается, оттаявшая смесь бензола с натрием попадает в 2, образуя коллоидный раствор натрия в бензоле.При замене одного растворителя другим можно перевести растворенное вещество, находящееся в молекулярно-дисперсном раздроблении в коллоидное раздробление. Для этого необходимо иметь два смешивающихся между собой растворителя, один из которых хорошо растворяет вещество, а другой – не растворяет. Так, мастика хорошо растворима в спирте и почти не растворима в воде. При добавлении спиртового раствора мастики в воде происходит резкое понижение растворимости мастики, в результате чего молекулы соединяются в коллоидные частицы. Также получают коллоидные растворы серы или канифоли.
Слайд 43Коллоидные растворы можно получать также и методом химической конденсации, основанном
на проведении химических реакций, сопровождающихся образованием нерастворимых или малорастворимых веществ.
Для этой цели спользуются различные типы реакций - разложения, гидролиза, окислительно-восстановительные и т.д. Так, красный золь золота получают восстановлением натриевой соли золото-водородной кислоты:NaAuO2+НСОН+Na2C03→Au+HCOONa+Н2O
Слайд 44СТРОЕНИЕ КОЛЛОИДНЫХ ЧАСТИЦ
образования частиц на примере образования коллоидной частицы AgI:
AgNO3
+ KI↔ AgI + KNO3.
Если AgNO3 и KI взяты в
эквивалентных количествах, то частицы-кристаллы растут, достигая значительной величины, превосходящей размеры коллоидных частиц, и быстро выпадают в осадок. Если же одно из исходных веществ взято в небольшом избытке, то оно служит стабилизатором, сообщающим устойчивость коллоидным частицам AgI.
Слайд 451. При избытке AgNO3 в растворе будут находиться ионы Ag+
и NO3–. Построение кристаллической решетки AgI, согласно правилу Панета-Фаянса, может
идти только за счет ионов, входящих в ее состав, в данном случае – за счет ионов Ag+. Ионы Ag+ будут продолжать достраивать кристаллическую решетку ядра, входя в его структуру и сообщая ему электрический заряд (рис.2-1), определяющий так называемый электротермодинамический потенциал.В связи с этим ионы, достроившие кристаллическую решетку ядра, называются потенциалопределяющими ионами (рис. 14.2-IIб).
Величина электротермодинамического потенциала (φ или E-потенциала) у многих коллоидных частиц достигает 1 В. Частицы с таким высоким зарядом будут притягивать оставшиеся в растворе противоположно заряженные ионы NO3- (противоионы) (рис. 14.2-IIa).
Слайд 46В процесс адсорбции противоионов устанавливается динамическое равновесие между адсорбированными и
свободными ионами. Основная часть всех противоионов, адсорбированная на ядре коллоидной
частицы, образует вместе с потенциалопределяющими ионами адсорбционный слой или плотную часть двойного электрического слоя. Ядро и адсорбционный слой вместе составляют гранулу. Гранула вместе с диффузным слоем образует мицеллу (рис. 2-III).Слайд 47Образование мицеллы AgI в избытке AgNO3: I – образование ядра по
типу кристаллической решетки; II – образование адсорбционного слоя; IIa –
адсорбция противоионов: 3 – адсорбционный слой; 4 – противоионы адсорбционного слоя; IIб – присоединение к ядру потенциалопределяющих ионов, достраивающих кристаллическую решетку, где: 1 – электронейтральное ядро; 2 – зона достройки ядра потенциалопределяющими ионами; III – завершение построения коллоидной мицеллы, где: 5 – диффузный слой, состоящий из противоионов, не вошедших в адсорбционный слой гранулыСлайд 48Процесс адсорбции противоионов, в результате которого установится динамическое равновесие между
адсорбированными и свободными ионами. Основная часть всех противоионов, адсорбированная на
ядре коллоидной частицы, образует вместе с потенциалопределяющими ионами адсорбционный слой или плотную часть двойного электрического слоя. Ядро и адсорбционный слой вместе составляют гранулу. Гранула вместе с диффузным слоем образует мицеллу (рис. 2-III).Слайд 49Строение двойного электрического слоя: 1 – потенциалопределяющие ионы; 2 – адсорбционный
слой противоионов; 3 – диффузный слой противоионов;
АВ – плоскость скольжения
На поверхности твердой фазы находятся потенциалопределяющие ионы
1- Противоионы распределяются между двумя слоями: часть противоионов входит в адсорбционный слой 2, толщина его очень невелика и противоионы распределяются в нем в плоскости параллельной поверхности твердой фазы, другая часть противоионов образует диффузный слой - 3 с закономерно убывающей концентрацией ионов.
Слайд 50Строение мицеллы золя коллоидного золота можно представить следующей схемой:
{[Au]m∙
n AuO2- · (n-x) Na+}x- · x Na+
Реакция NaAuO2+НСОН+Na2C03→Au+HCOONa+Н2O
Слайд 51Золь серы может быть получен окислением сероводорода кислородом в водном
растворе, действием на сероводород сернистого газа либо
разложением тиосерной кислоты:
H2S +
02 → S + H2O
H2S + S02 → S + Н20
H2S2O3 → Н2O + SO2 + SСтроение мицеллы
{[S]m · n HS - · (n-x) H+}x- · x H+
Слайд 52Процесс гидролиза различных солей может приводить к образованию коллоидных растворов
нерастворимых гидроксидов или кислот; так получают, например, золь гидроксида железа
(III). Гидроокись железа образуется при гидролизе хлорного железа:FeCl3+3H2O=Fe(OH)3+3HCl
Продукты реакции взаимодействуют: Fe(OH)3+HCl=FeOCl+2H2O
Образующая хлорокись железа является стабилизатором: FeOCl= (FeO+) + (Cl-)
Золь гидроксида железа (III), имеет следующее строение:
{[Fe(OH)3]m•nFeO+• (n-x) Cl-}x•nCl-
Слайд 53Избирательное поглощение и рассеяние света объясняют окраску многих минералов, в
том числе драгоценных камней. Такие разновидности кварца, как сапфир, аметист,
дымчатый кварц, имеют свойственную им окраску благодаря диспергированию в кристаллическом кварце марганца, железа и других металлов на коллоидном уровне. Окраска рубина также связана с присутствием в А12О3 коллоидных частиц хрома или золота. Ломоносов предложил окрашивать стекла в красный (рубинового оттенка) цвет путем введения в расплавленное стекло Аu(III) с последующим его восстановлением до золота металлического с частицами коллоидной дисперсии.Интенсивность окраски золей намного превышает интенсивность окраски истинных растворов той же концентрации. Это можно продемонстрировать на примере коллоидных растворов железа (III):
-если ввести по нескольку капель раствора FeCI3 в два одинаковых сосуда с одинаковым количеством холодной и горячей воды, то окраска раствора FeCl3 в холодной воде будет едва заметна. Напротив, горячая вода окрасится в интенсивный буро-красный цвет из-за более глубокого протекания гидролиза FeCl3 в горячем растворе. Образовавшаяся Fe(OH)3 подвергается полимеризации вследствие процесса оляции с образованием частиц коллоидной дисперсии. Они обусловливают ярко-красную окраску горячего раствора, содержащего железо (III)
Слайд 55ОЛЯЦИЯ
ГИДРОКСОКОМПЛЕКСЫ, координац. соед., содержащие в кач-ве лигандов одну или неск.
монодентатных групп ОН-. Эти группы связаны с центральным атомом металла
через атом кислорода. Соединения, в которых группы ОН связаны одновременно с двумя атомами металла, наз. олевыми, напр. соед. ф-лы I,где R = NH2 (CH2)2NH2. Процесс образования таких соединений наз. оляцией, а сами мостиковые ОН- группы - ол-группами.
Различают гидроксокомплексы катионного типа, анионного типа и комплексы-неэлектролиты.
Гидроксокомплексы первых двух типов наз. гидроксосолями или основными солями. Гидроксокомплексы могут быть амфотерными. Для них характерны след. реакции:
1.оксоляция, напр. [W(OH)FS] [WOF5]- + Н+ ;
2. протонирование, напр. [Сr(Н2О)5(ОН)]2+ + Н3О= [Сr(Н2О)6]3+ + Н2О; замещение ОН-групп др. лигандами или молекулами растворителя;
3. полимеризация с образованием многоядерных оловых или оксосоединений.
Слайд 56Реакции гидролиза и конденсации
Si(OC2H5)4 + xH2O → Si(OC2H5)4-x(OH)x + xC2H5OH(6)
(в
присутствии раствора аммиака (катализатор) и этилового спирта) NH3 (0.1-0.5 M),
C2H5OH (1-7 M), T= 50 Cмеханизм реакции:
≡Si−OC2H5 + HO−Si≡ → ≡Si−O−Si≡ + C2H5OH; (7)
≡Si−OH + HO−Si≡ → ≡Si−O−Si≡ + H2O. (8)
Заключительная стадия Si(OH)4 → SiO2+2H2O (9)
Слайд 57Коллоидные растворы SiO2 в воде, полученные золь – гель методом.
Влияние размера частиц на седиментационную устойчивость.
Слайд 60По мере протекания гидролиза ТЭОС равновесие сильно смещается вправо. Для
сдвига равновесия влево и замедления скорости реакции гидролиз ТЭОС обычно
осуществляют в присутствии этанола. Однако процесс гидролиза ТЭОС, особенно при pH < 7 не происходит до конца. К. А. Андрианов [11] отмечал, что процесс гидролиза не завершается полностью ни при 20 °С, ни при 500 °С. Особенности золь-гель-систем, которые наиболее интересны для применения в микроэлектронике, состоят в том, что золи на основе ТЭОС, гидролизованного в кислой среде, могут быть допированы алкоксидами металлов или неорганическими соединениями (кислотами, солями металлов). Допант (dopant) в переводе с английского - легирующая примесь. Впоследствии эти допанты легируют силикатную матрицу образуемого нанокомпозита, придавая ей необходимые свойства - каталитические, электрические и др.Слайд 61Структура продуктов гидролитической поликонденсации тетраалкоксисиланов.
Линейные Планарные
* Верти-кальные связи и ОН
группы не показаны
Слайд 62Форма коллоидных частиц далеко не всегда шарообразна. Они могут иметь
форму листочков (золото, оксид кремния) и палочек.
Микрочастицы SiO2, полученные методом
золь – гель технологииСлайд 64Микроэмульсии - это термодинамически стабильные изотропные дисперсии двух несмешивающихся жидкостей.
Термин "микроэмульсии" был введён в 1943 году Шульманом, который первым
получил подобные системы при добавлении ПАВ к макроэмульсиям. Микроэмульсии относятся к лиофильным дисперсным системам и могут быть получены либо путём самопроизвольного диспергирования двух несмешивающихся жидкостей в результате сильного снижения межфазного натяжения, либо в процессе солюбилизации. В зависимости от того, какая фаза является дисперсной, а какая непрерывной, микроэмульсии могут быть прямыми - масло в воде (м/в) - или обратными - вода в масле (в/м). Термин "масло" означает неполярную органическую жидкость. В обоих случаях дисперсная фаза состоит из капель, размер которых не превышает 100 нм.В микроэмульсионной системе частицы дисперсной фазы постоянно сталкиваются, коалесцируют и разрушаются вновь, что приводит к непрерывному обмену их содержимым. Процесс столкновения капель зависит от диффузии капель в масляной фазе (для обратной микроэмульсионной системы), тогда как процесс обмена определяется взаимодействием адсорбционных слоёв ПАВ и гибкостью межфазной поверхности (последнее обстоятельство является чрезвычайно важным при проведении химических реакций в таких системах).
Слайд 66Тонкие возможности управления процессом зарождения золя и форм разрастания исходных
структур открываются в рамках темплатного синтеза. На рис. 10.4, 10.5
приведены примеры возможной вариации форм разрастрающихся частиц в нанокомпозитах системы SnO2-SiO2-CuO . В золь-гель процессах при зарождении нанофаз на молекулярном уровне возможно контролировать форму растущих частиц до микрометровых размеров.Слайд 67На поверхности твердой фазы находятся потенциалопределяющие ионы. Изменение потенциала двойного
электрического слоя: а) в зависимости от расстояния х от поверхности
твердой фазы, А – адсорбционный слой противоионов; б) кривые снижения потенциала при сжатии диффузного слоя а бСлайд 68Наибольший интерес представляет потенциал на границе скольжения АВ. При движении
дисперсной фазы в электрическом поле (электрофорезе) часть жидкости вместе с
адсорбционным слоем противоионов перемещается вместе с ней. Потенциал на границе скольжения определяет скорость перемещения фаз при наложении электрического поля, т.е. является причиной всех электрокинетических явлений. Этот потенциал получил название электрокинетического или (дзетта) ζ – потенциала. Величина потенциала характеризует устойчивость коллоидного раствора.Слайд 69Рассеяние света, окраска коллоидов
Коллоидные растворы обладают оптическими свойствами, отличными от
истинных растворов и грубодисперсных систем. Проходя через дисперсную систему, свет
может поглощаться, отражаться и рассеиваться. 1. Отражение света происходит в тех случаях, когда размер частиц больше, чем длина волны падающего света, таким образом, отражать свет могут только грубодисперсные системы. 2. Коллоидные системы содержат частицы с диаметром намного меньшим, чем длина волны падающего света, поэтому в коллоидных системах происходит только рассеяние света. При освещении сбоку возникает голубоватое «переливчатое» свечение — опалесценция (от названия минерала «опал», имеющего сходную голубовато-белую неравномерную окраску). Впервые опалесценцию коллоидных растворов обнаружил Тиндаль (1886 г.). Его именем назван метод идентификации коллоидных растворов. «Конус Тиндаля» — конус рассеянного света — виден в темноте, если на коллоидный раствор в стеклянном сосуде направить узкий луч света какого-либо источника. Истинные растворы такого эффекта не дают: луч, проходящий через него, невидим из-за отсутствия рассеяния. Опалесценция (в отличие от флуоресценции, которая имеет иную физико-химическую природу) возбуждается светом любой длины волны. Размер коллоидных частиц все же влияет на характер светорассеяния: чем меньше диаметр мицелл, тем сильнее максимум поглощения света сдвигается в сторону коротких волн. Примером могут быть золи золота: золь с радиусом частиц 20 нм поглощает зеленый свет, и поэтому рассеяние света придает коллоиду красную окраску (дополнительный цвет); золь с радиусом частиц 50 нм окрашен в синий цвет в проходящем свете и в буро-лиловый при боковом освещении. Если дисперсность частиц золота особенно высока (радиус <20 нм), окраска золя желтая, сходная с цветом истинного раствора АuС13.Слайд 70Эффект Тиндаля, рассеяние Тиндаля (англ. Tyndall effect) — оптический эффект, рассеяние света при прохождении светового
пучка через оптически неоднородную среду. Обычно наблюдается в виде светящегося
конуса (конус Тиндаля), видимого на тёмном фоне. Характерен для растворов коллоидных систем (например, золей, металлов, разбавленных латексов, табачного дыма), в которых частицы и окружающая их среда различаются по показателю преломления. На эффекте Тиндаля основан ряд оптических методов определения размеров, формы и концентрации коллоидных частиц и макромолекул. Слева – коллоидный раствор, справа – истинный растворСлайд 72Задание на дом для всех:
1. Назовите два характерных признака коллоидных
систем. 2. По каким признакам можно провести классификацию дисперсных систем? Каковы
общие и частные признаки классификации? 3. Что такое коллоидная мицелла? Назовите принципы построения коллоидной мицеллы. 4. Назовите три типа потенциалопределяющих ионов.Слайд 73Электрические свойства коллоидных растворов
1. Электрофорез коллоидных растворов
1808 г Ф.Ф.Рейс установил,
что при наложении разности электрического потенциала на электроды, опущенные в
заполненные водой стеклянные трубки, воткнутые в кусок сырой глины, жидкость в трубке с положительным полюсом мутнела за счет появления там частиц глины. Это указывало на то, что частицы глины переносятся в электрическом поле к положительному полюсу. Перенос частиц в электрическом поле получил название электрофореза. Процесс протекает с постоянной скоростью, зависящей от величины разности потенциалов и характеристик среды:Слайд 742. Эффект Дорна (потенциал седиментации)
Дорн в 1878 г. обнаружил, что при оседании
каких-либо частиц в жидкости, например песка в воде, возникает электродвижущая
сила между двумя электродами, введенными в разные места столба жидкости, в которой оседают частицы. Это явление, противоположное электрофорезу, получило название эффект Дорна (потенциал седиментации). 3. Электроосмос. Ф.Ф. Рейс открыл явление электроосмоса, заключающееся в том, что если тонкий порошок кварца поместить в среднюю часть U-образной трубки так, чтобы он образовал род пористой диафрагмы, заполнить трубку водой и приложить электрический ток к электродам, помещенным в оба колена трубки, то уровень воды в колене с отрицательным электродом будет повышаться до тех пор, пока разность уровней в обоих коленах не достигнет определенной величины. Процесс идет с постоянной скоростью, которую можно рассчитать по следующей формуле:Слайд 75Схема свободного (фронтального) электрофореза. Положение границ раздела: а — до
опыта; б — после опыта. 1 — электроды; 2 —растворитель;
3 —коллоидный растворСлайд 76Различают следующие виды электрофореза. 1. Свободный (фронтальный) электрофорез. В этом
случае электрофорез проводят в приборах, существенной частью которых является U-образная
трубка (Рис.). Нижнюю часть трубки заполняют испытуемым объектом. 2. Электрофорез на носителях (зональный электрофорез). В качестве носителей используют бумагу, гели крахмала, агара, полиуретанов и др.Метод электрофореза позволяет определить знак заряда частиц золя, а также величину -потенциала. Наблюдать электрофорез коллоидных растворов можно с помощью прибора, изображенного на рис.36. Прибор представляет собой U–образную трубку, в колена которой вставлены электроды. Коллоидный раствор вводят через трубочку Б до уровня А – А. На поверхность раствора налита контактная жидкость, которая является дисперсионной средой золя или имеет одинаковую с ней электропроводность. На электроды подают напряжение. Через некоторое время уровень золя изменится в обоих коленах (В – В).
Слайд 77Схема прибора для электрофореза. В электрическом поле противоионы диффузного слоя обычно
двигаются в направлении, противоположном движению гранул. При этом в соответствующем
колене прибора повышается уровень жидкости, так как ионы диффузного слоя увлекают за собой дисперсионную среду за счет сил межмолекулярного трения (вязкости) между гидратной оболочкой ионов и окружающей жидкостью. То есть в данном колене наблюдается электроосмос. Но это только в том случае, если на пути передвижения стоит мембрана, препятствующая движению гранул (т.е. фаза закреплена).Слайд 78При свободном передвижении диффузный слой удерживается гранулой и в виде
отстающего «хвоста» следует вместе с ней. Поэтому уровень золя будет
повышается в электродном пространстве, имеющим знак заряда, противоположный заряду частиц. Следовательно, в нашем случае частицы золя заряжены отрицательно, так как уровень жидкости повысился в анодном пространстве. Зная величину смещения уровня (S) за определенный промежуток времени (t), можно экспериментально рассчитать скорость электроосмоса (электрофореза): V = S/t, м/с. С другой стороны, скорость движения частиц дисперсной фазы в электрическом поле по уравнению Гельмгольца – Смолуховского равна: где V – линейная скорость перемещения частиц (или границы золя), м/с; ε – относительная диэлектрическая проницаемость среды; Н – напряженность электрического поля (градиент потенциала), В/м; k – коэффициент, зависящий от формы частиц (k = 4 – для сферических частиц, k = 6 – для цилиндрических); η – вязкость среды, Нс/м2; – электрокинетический потенциал, В. Последнее уравнение позволяет рассчитать величину -потенциала:Слайд 794. Потенциал течения
Если под действием давления заставить проводящую жидкость двигаться через
пористое тело, то возникает разность потенциалов, называемая потенциалом течения (Е).
Это явление противоположно электроосмосу.Скорость электроосмоса и потенциал течения зависят от одних и тех же величин:
Слайд 80Описанные четыре явления, в которых происходит передвижение частиц или жидкости
при наложении разности потенциалов или, наоборот, возникает разность потенциалов при
движении частиц или жидкости, получили название электрокинетических явлений. Причиной всех этих явлений является наличие заряда на поверхности коллоидных частиц.Слайд 81ЗАДАЧИ
Вариант 1
1.Золь сернокислого бария получен смешением равных объемов растворов Ва(NО3)2
и Н2SО4. Написать формулу мицеллы. Одинаковы ли исходные концентрации растворов,
если частицы золя перемещаются к аноду?2. Для получения золя АgCl смешали 10х10-6 м3 0,02 н раствора КCl и 100х10-6 м 3 0,05 н раствора AgNO3. Написать формулу мицеллы этого золя и указать направление движения частиц при электрофорезе.
Вариант 2
1. Золь Аl(ОН)3 получен смешением равных объемов растворов АlCl3 и NaОН. Написать формулу мицеллы золя. Одинаковы ли исходные концентрации электролитов, если при электрофорезе частицы движутся к катоду?
2. Золь Fe(OH)3 получен методом гидролиза FeCl3. Напишите формулу мицеллы, если считать, что стабилизатором золя является раствор оксихлорида железа (FeOCl).
Слайд 82
Использованные источники информации:
1. Максимов А.И., Мошников В. А., Таиров Ю.
М., Шилова О.А. Основы золь-гель-технологии нанокомпозитов: Монография. СПб.: Изд-во СПбГЭТУ
"ЛЭТИ", 2007. 156 с. 2. Левченков С.В. Коллоидная химия. Конспект лекций по коллоидной химии. Ростовский государственный университет, 2004., 28 с. 3.КособудскийИ.Д.,НикитинаЛ.В.,Ушаков Н.М.,Горшков Н.В. Химия и физика полимеров. Из – во СГТУ, 2010., 211 с. 4. Кособудский И.Д., Симаков В.В., Ушаков Н.М., Юрков Г.Ю. Физическая химия наноразмерных объектов: композиционные материалы // Монография. Издание переработанное и дополненное. - Саратов: Саратовский государственный технический университет, 2009, 229 с.5. Архипова Н.В.,Кособудский И.Д., Ефанова В.В. Физическая химия гетерогенных наносистем. - Саратов: Саратовский государственный технический университет, 2011, 102 с. 6. ШпакИ.Е., Кособудский И. Д., Третьяченко Е.В. ДИСПЕРСНЫЕ СИСТЕМЫ КОЛЛОИДНЫЕ РАСТВОРЫ. Методические указания к выполнению лабораторных работ по курсу «Химия воды» - Саратов: Саратовский государственный технический университет, 2002, 24 с.











































![Основы дизайна функциональных материалов Лекция № 4 ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ И Строение мицеллы золя коллоидного золота можно представить следующей схемой: {[Au]m∙ Строение мицеллы золя коллоидного золота можно представить следующей схемой: {[Au]m∙ n AuO2- · (n-x) Na+}x-](/img/thumbs/55e83f9178b2557fedd899443d3da54e-800x.jpg)