Слайд 1Основы химической термодинамики
Лекция
Слайд 2Термодинамика –это наука о превращениях различных видов энергии друг в
друга.
Все химические реакции сопровождаются энергетическими эффектами.
Термодинамика позволяет определить:
Количество поглощенной или
выделенной энергии в ходе химической реакции;
Возможность самопроизвольного протекания химической реакции без эксперимента.
Слайд 3Первый закон термодинамики. Основные понятия
Теплота Q, подводимая к термодинамической системе,
расходуется на изменение внутренней энергии ∆U
и на совершение
работы А
Q = ∆U + А
Слайд 4Внутренняя энергия U – это энергия частиц, составляющих данную систему.
Внутренняя
энергия идеального газа зависит только от его температуры, поэтому с
ростом температуры внутренняя энергия растет.
Абсолютное значение U определить невозможно, но можно рассчитать ∆U.
Работа А – это работа против всех внешних сил, но обычно это работа изменения объема.
Теплота Q и работа А – две формы передачи энергии.
Слайд 5В зависимости от условий протекания различают 4 типа процессов:
изохорный –
протекает при постоянном объеме (V=const);
изобарный – протекает при постоянном давлении
(p=const);
изотермический – протекает при постоянной температуре (T=const);
адиабатный – протекает без теплообмена с окружающей средой (∆Q=0).
Слайд 6Химические процессы протекают либо при постоянном объеме (V=const),
либо при
постоянном давлении (p=const).
а) V=const
dV=0, A=0
QV=∆U
Вся теплота, подводимая в изохорных условиях,
идет на изменение внутренней энергии.
б) p=const
Слайд 7QP =∆U + А = ( U2 –U1 ) +
p ∙ ( V2 – V1 ) =
= (U2
+ pV2 ) – (U1 + pV1 )
H – энтальпия, теплосодержание.
QP = H2 – H1 = ∆H
Вся теплота, подводимая в изобарных условиях, идет на изменение энтальпии.
Слайд 8Тепловой эффект реакции – количество выделенной или поглощенной в ходе
реакции теплоты.
По знаку теплового эффекта все реакции делятся на 2
типа.
Экзотермические реакции –это реакции, сопровождающиеся выделением теплоты.
При этом энтальпия уменьшается, т.к. энергия из системы уходит, выделяется.
∆ H < 0 – экзо.
2) Эндотермические реакции – это реакции, сопровождающиеся поглощением теплоты.
В результате этого теплосодержание системы возрастает.
∆ H > 0 – эндо.
Слайд 9Термохимические уравнения – это химические уравнения, в которых указывается тепловой
эффект реакции ∆ H и состояние веществ:
(к) – кристаллическое,
(ж) –
жидкое,
(г) – газообразное,
(р) – растворенное.
Как правило, ∆ H приводится для стандартной температуры 250С (298,15 К) и стандартного давления 1 атм.
Если температура не равна 298,15К, она должна быть указана в нижнем индексе.
∆Н0298 = - 221 кДж.
(графит) (г)
(г)
В термохимии приняты дробные коэффициенты,
при этом число атомов должно быть целым.
С + ½ О2 = СО;
(графит) (г) (г)
∆Н0298 = - 110,5 кДж.
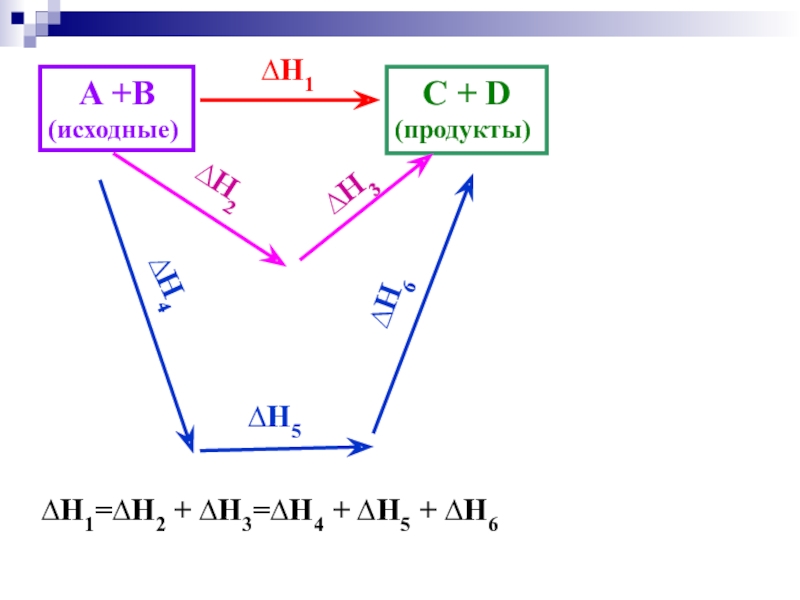
Слайд 112. Закон Гесса
Тепловой эффект процесса зависит только от вида и
состояния исходных веществ и продуктов реакции
и не
зависит от пути перехода от исходных веществ к продуктам реакции.
Слайд 12A +B
(исходные)
C + D
(продукты)
∆Н1
∆Н2
∆Н3
∆Н4
∆Н5
∆Н6
∆Н1=∆Н2 + ∆Н3=∆Н4 + ∆Н5 + ∆Н6
Слайд 13Следствие из закона Гесса
Тепловой эффект реакции равен сумме теплот образования
продуктов реакции минус сумма теплот образования исходных веществ.
Теплота (энтальпия) образования
∆Н –
тепловой эффект реакции образования 1 моля вещества из простых веществ,
устойчивых при Т=298,15 К (250С) и р=1 атм,
т. е. в стандартных условиях.
Это справочная величина.
Теплота образования простых веществ, устойчивых при стандартных условиях, равна 0.
∆Н0(О2)=0; ∆Н0(О3)≠0 ; ∆Н0(Zn) ≠ 0 .
(г) (г) (тв)
[∆Н0]=кДж/моль.
Слайд 14∆Н0=∑ ∆Н0(прод) - ∑ ∆Н0(исх)
Суммирование ведется по каждому молю,
т.е. с учетом коэффициентов:
если в уравнении реакции есть коэффициенты,
не равные 1, то ∆Н0 такого вещества надо умножить на коэффициент.
aA + bB = dD + eE
∆Н0=∑ ∆Н0(прод) -∑ ∆Н0(исх) =
(d ∆Н0(D) +e ∆Н0(E)) - (a ∆Н0(A) +b ∆Н0(B))
Слайд 15Второй закон термодинамики
Самопроизвольно в изолированной системе могут протекать только те
процессы, которые сопровождаются повышением энтропии.
Энтропия S – мера беспорядка системы,
мера хаотичности.
Слайд 16Она растет при:
- повышении температуры,
- плавлении,
- кипении,
- сублимации (возгонке),
- расширении и т.п.
Процессы, связанные с повышением
порядка, -
- охлаждение,
- кристаллизация,
- конденсация,
- сжатие – сопровождаются уменьшением энтропии.
Слайд 17[S0]=Дж/моль·К,
это справочная величина.
∆S0=∑ S0(прод) - ∑ S0(исх)
Суммирование ведется по
каждому молю, т.е. с учетом коэффициентов.
Слайд 18Критерий направленности процесса
Существует потенциал, характеризующий химические процессы, протекающие при
p, T=const,
он называется изобарно-изотермический потенциал,
или,
ради краткости, изобарный потенциал.
Чаще всего его называют энергия Гиббса G.
Слайд 19∆G0
Возможность самопроизвольного протекания реакции в прямом направлении.
∆Gпрямой= - ∆Gобратной
Невозможность самопроизвольного протекания реакции в прямом направлении.
Равновесие,
протекает и прямая, и обратная реакции одновременно.
Чем ∆G<0, тем дальше система от состояния равновесия и тем более она реакционноспособна.
Слайд 20Существует 2 способа расчета Δ G.
Аналогично расчету Δ H и
Δ S
aA + bB = dD + eE
∆G0=∑ ∆G0(прод) -
∑ ∆G0(исх)=
=(d ∆G0(D) +e ∆G0(E)) - (a ∆G0(A) +b ∆G0(B)).
∆G0, как и ∆H0, для простых веществ, устойчивых при стандартных условиях, равно 0.
∆G0(О2)=0; ∆G0(О3)≠0 .
(г) (г)
[∆G0]=кДж/моль,
∆G0 – это справочная величина.
Слайд 21
2) Расчет по уравнению Гиббса
∆G0 = ∆Н0 - T
∆S0
Реакция, не идущая самопроизвольно при стандартных условиях, может пойти при
других p и T.
Слайд 22Задача
CH4 + CO2 = 2 CO + 2 H2
(г) (г) (г) (г)
Определить тепловой эффект реакции ∆Н0
∆Н0=∑ ∆Н0(прод) - ∑ ∆Н0(исх)=
=(2 ∆Н0(СO) +2 ∆Н0(Н2)) - (∆Н0(CH4) + ∆Н0(CO2)) =
=(2·(-110,52) + 2·0) – (-74,85 + (-393,51)) =
= 247,32 (кДж).
∆Н0>0, - реакция эндотермическая.
Слайд 232) Определить изменение энтропии ∆S0
∆S0=∑ S0(прод) - ∑ S0(исх)=
=(2
·S0(СO) +2 · S0(Н2)) - (S0(CH4) + S0(CO2)) =
=(2 ·197,91
+ 2 ·130,59) – (186,19 + 213,65) =
=257,16 (Дж/К)
Слайд 243) Определить изменение энергии Гиббса ∆G0
∆G0 = ∆Н0
- T ∆S0 =
=247,32 кДж – 298,15 К·257,16 ·10-3
кДж/K ≈
≈ 170,65 кДж.
∆G0>0, - процесс самопроизвольно не идет при Т=298,15 К и р=1 атм.
Слайд 254) При какой температуре процесс пойдет самопроизвольно
Любой процесс идет самопроизвольно
при температуре равновесия.
В этом случае ∆G0 = 0,
тогда правая часть
уравнения Гиббса равна нулю:
∆Н0 - T ∆S0 =0,
∆Н0 = Tравн· ∆S0 , отсюда















![Основы химической термодинамики [S0]=Дж/моль·К, это справочная величина.∆S0=∑ S0(прод) - ∑ S0(исх)Суммирование ведется по каждому молю, т.е. с учетом коэффициентов. [S0]=Дж/моль·К, это справочная величина.∆S0=∑ S0(прод) - ∑ S0(исх)Суммирование ведется по каждому молю, т.е. с учетом коэффициентов.](/img/tmb/7/616409/16653e8a91b0cc0bf47b3e5c5ca94377-800x.jpg)




























