Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Особенности окислительно-восстановительных реакций в организме
Содержание
- 1. Особенности окислительно-восстановительных реакций в организме
- 2. ОСОБЕННОСТИ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ В ОРГАНИЗМЕ. ФИЗИКО-ХИМИЧЕСКИЕ ПРИНЦИПЫ
- 3. Особенности ОВР в организмеДля характеристики свойств природных
- 4. Особенности ОВР в организмеПри биоокислении органических соединений
- 5. Особенности ОВР в организмеСтепень окисления любого атома
- 6. −Типы биологических ОВРВнутримолекулярная дисмутация − возможна при
- 7. Типы биологических ОВРВывод: ферменты, под действием которых
- 8. Типы биологических ОВРМежмолекулярные ОВР с участием ферментов,
- 9. Типы биологических ОВРОВР с участием НАД+ описывается
- 10. Витамин РРВитамин РР участвует в синтезе НАД+
- 11. Электроннотранспортная цепь (ЭТЦ) митохондрийЭТЦ − пример действия
- 12. Электроннотранспортная цепь (ЭТЦ) митохондрийCyt (Fe3+) + ē
- 13. Электроннотранспортная цепь (ЭТЦ) митохондрийПеренос ē осуществляется вдоль
- 14. Электроннотранспортная цепь (ЭТЦ) митохондрийHēOx1(Fe 3+)Red1(Fe 2+)Ox2(Fe 3+)Red2(Fe 2+)Ox3(Fe 3+)Red3(Fe 2+)H+H+ēO2
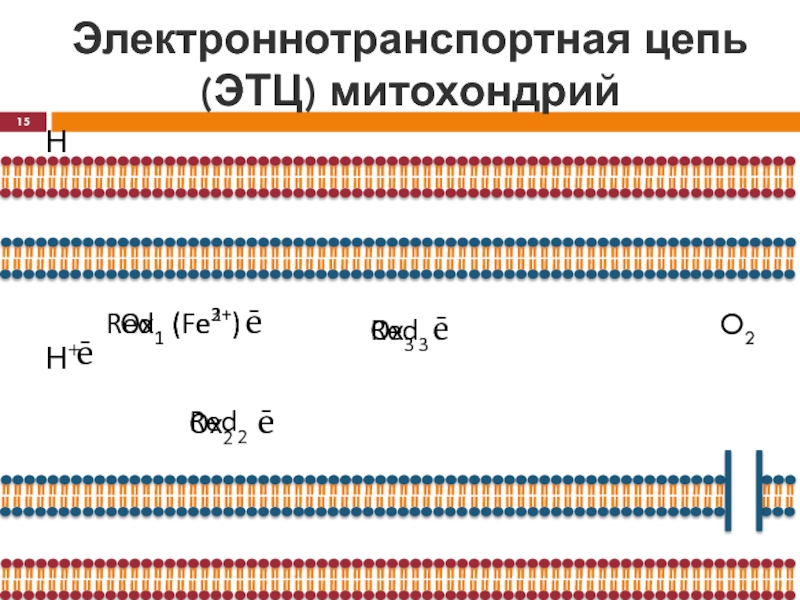
- 15. Электроннотранспортная цепь (ЭТЦ) митохондрийНН+ēOx1 (Fe3+)Red1 (Fe2+)ēOx2Red2ēOx3Red3ēO2
- 16. Red → Ox процессы при патологииПатологические Red→Ox
- 17. Red → Ox процессы при патологииAnemia
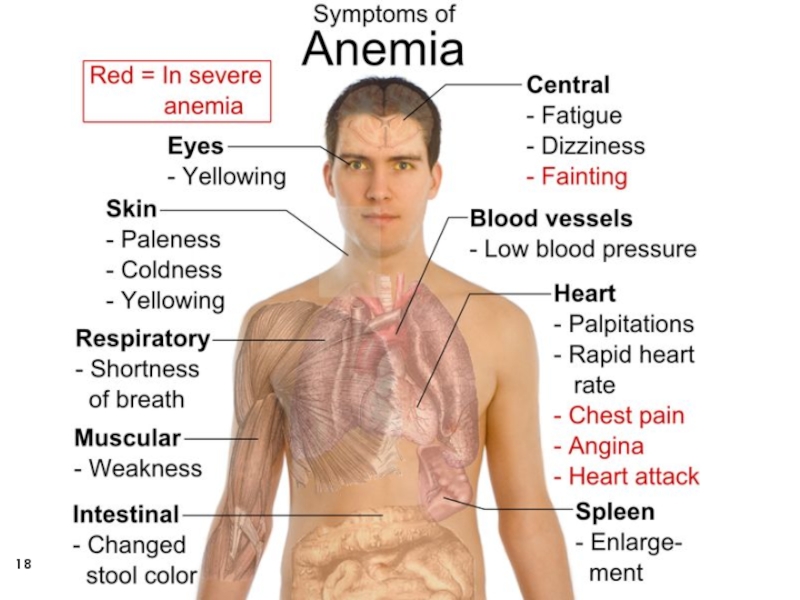
- 18. Слайд 18
- 19. Red → Ox процессы при патологииNO3− +
- 20. Скачать презентанцию
ОСОБЕННОСТИ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ В ОРГАНИЗМЕ. ФИЗИКО-ХИМИЧЕСКИЕ ПРИНЦИПЫ ТРАНСПОРТА ЭЛЕКТРОНОВ В ЭТЦ МИТОХОНДРИЙЛекция №14 курса«Общая химия» Лектор: Профессор Иванова Надежда Семёновна
Слайды и текст этой презентации
Слайд 2ОСОБЕННОСТИ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ В ОРГАНИЗМЕ. ФИЗИКО-ХИМИЧЕСКИЕ ПРИНЦИПЫ ТРАНСПОРТА ЭЛЕКТРОНОВ В
ЭТЦ МИТОХОНДРИЙ
Профессор Иванова Надежда СемёновнаСлайд 3Особенности ОВР в организме
Для характеристики свойств природных ОВ пар вместо
Е° используют величины формальных (mid-point) потенциалов Е°′ при Сox =
Сred = 1 моль/л, Т=310К, рН=7,4;Реакции биоокисления − экзэргонические и, поэтому, часто сопряжены с получением АТФ из АДФ. Возможно сопряжение и с эндэргоническими реакциями восстановления.
Слайд 4Особенности ОВР в организме
При биоокислении органических соединений меняется только степень
окисления атома углерода.
Реакции биоокисления−восстановления многоступенчатые и на каждой стадии действуют
свои ферменты.В природных органических соединениях степени окисления атомов элементов-органогенов равны: Н+1, N-3, O-2, S-2, P+5, Cот-4 до+4.
Слайд 5Особенности ОВР в организме
Степень окисления любого атома углерода равна Σ
числа всех его связей с атомами более электроотрицательных элементов (S,
N, O), учитываемых со знаком «+», и числа связей с атомами Н, учитываемых со знаком «-», а все его связи с соседними атомами углерода не учитываются.СН3−СН2−ОН
-3
-1
Слайд 6−
Типы биологических ОВР
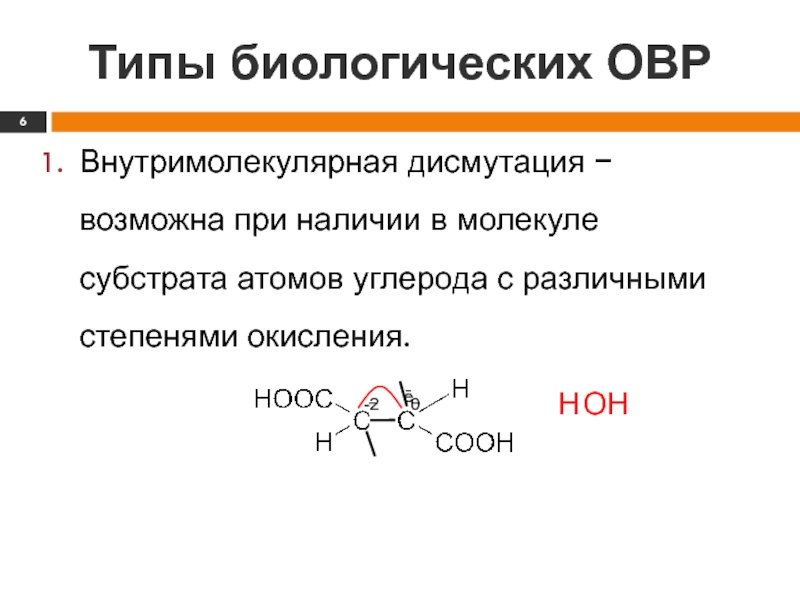
Внутримолекулярная дисмутация − возможна при наличии в молекуле
субстрата атомов углерода с различными степенями окисления.
ē
−
-2
0
Н
ОН
Слайд 7Типы биологических ОВР
Вывод: ферменты, под действием которых происходят разобранные ОВР
реакции в передаче и приёме электронов не участвуют.
0
-2
ē
-1
-1
NH2
H
NH4
Слайд 8Типы биологических ОВР
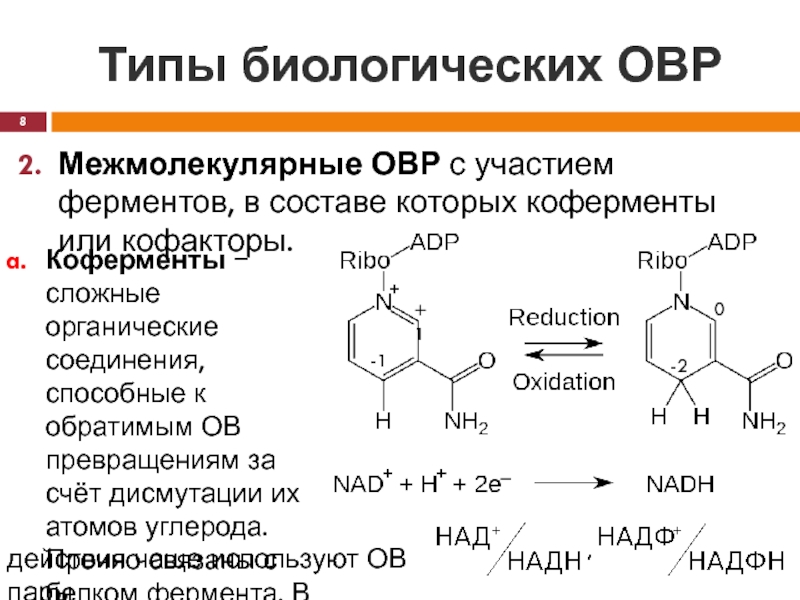
Межмолекулярные ОВР с участием ферментов, в составе которых
коферменты или кофакторы.
Коферменты − сложные органические соединения, способные к обратимым
ОВ превращениям за счёт дисмутации их атомов углерода. Прочно связаны с белком фермента. В качестве кофермента ОВдействия чаще используют ОВ пары
+1
-1
-2
0
Слайд 9Типы биологических ОВР
ОВР с участием НАД+ описывается уравнением:
ОВ свойства коферментов
в организме зависят от того, концентрация какой из форм преобладает.
Так, в гепатоцитах: , а , поэтому, НАД+ ведёт себя как окислитель, а НАДФН как восстановитель .
НАД+ + Н-субстрат-Н ↔ НАДН + субстрат + Н+aq
Ox 1
Red 2
c. Red 1
c. Ox 2
Слайд 10Витамин РР
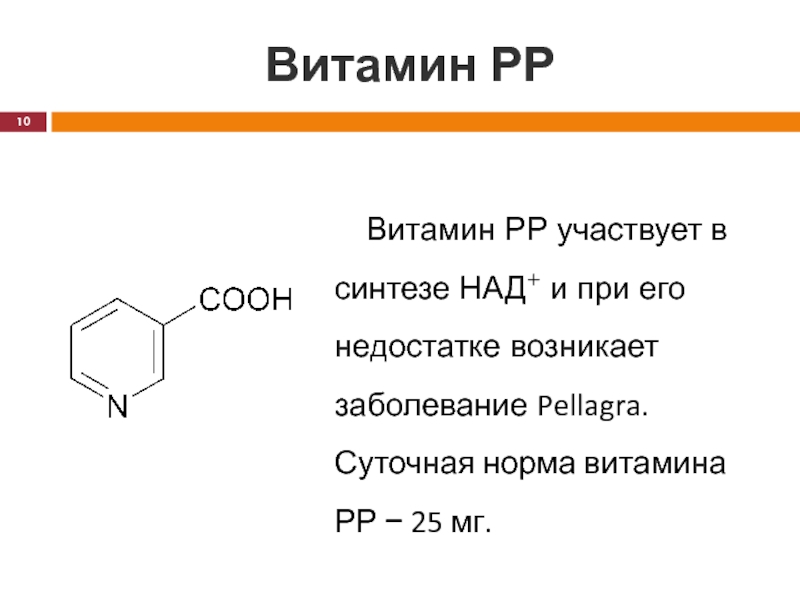
Витамин РР участвует в синтезе НАД+ и при его
недостатке возникает заболевание Pellagra. Суточная норма витамина РР − 25
мг.Слайд 11Электроннотранспортная цепь (ЭТЦ) митохондрий
ЭТЦ − пример действия ферментов с кофакторами.
Фермент в этом случае является комплексом, в котором белок связан
с КО − катионом переходного металла, выполняющим роль кофактора (чаще Fe, Cu, реже Mn, Mo). Кофакторы проявляют переменную Val, отдавая и принимая ē.Митохондрии (электронограмма)
Слайд 12Электроннотранспортная цепь (ЭТЦ) митохондрий
Cyt (Fe3+) + ē ↔ Cyt (Fe2+)
В
митохондрии идёт реакция:
½О2 + 2Н+ + 2ē → Н2О
Особенности
этой реакции:В ЭТЦ задействован комплекс ферментов для постепенного переноса ē от субстрата к О2;
Роль доноров и акцепторов ē выполняют кофакторы, которые окисляются и восстанавливаются в осциллирующем режиме;
Слайд 13Электроннотранспортная цепь (ЭТЦ) митохондрий
Перенос ē осуществляется вдоль membrana interna митохондрии,
а перенос протонов − из memb. Interna в межмембранное пространство.
Перенос
Н+ − эндэргонический процесс. Обратный процесс поступления Н+ в митохондрию через протонные каналы − экзэргонический процесс. Высвобождающаяся при этом Е расходуется на синтез АТФ из АДФ и НРО32- .Слайд 14Электроннотранспортная цепь (ЭТЦ) митохондрий
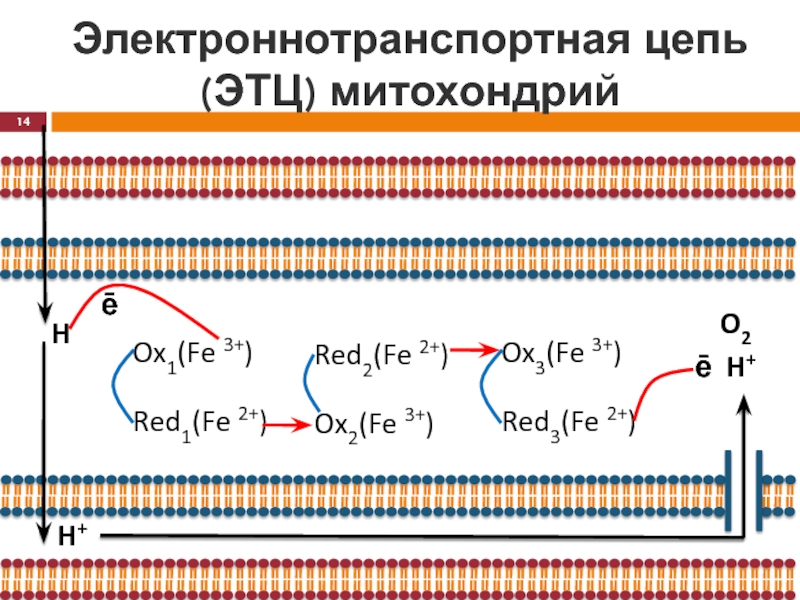
H
ē
Ox1(Fe 3+)
Red1(Fe 2+)
Ox2(Fe 3+)
Red2(Fe 2+)
Ox3(Fe 3+)
Red3(Fe 2+)
H+
H+
ē
O2
Слайд 16Red → Ox процессы при патологии
Патологические Red→Ox процессы вызваны попаданием
в организм сильных окислителей:
перманганатов, нитратов, хроматов, оксидов азота и т.д.
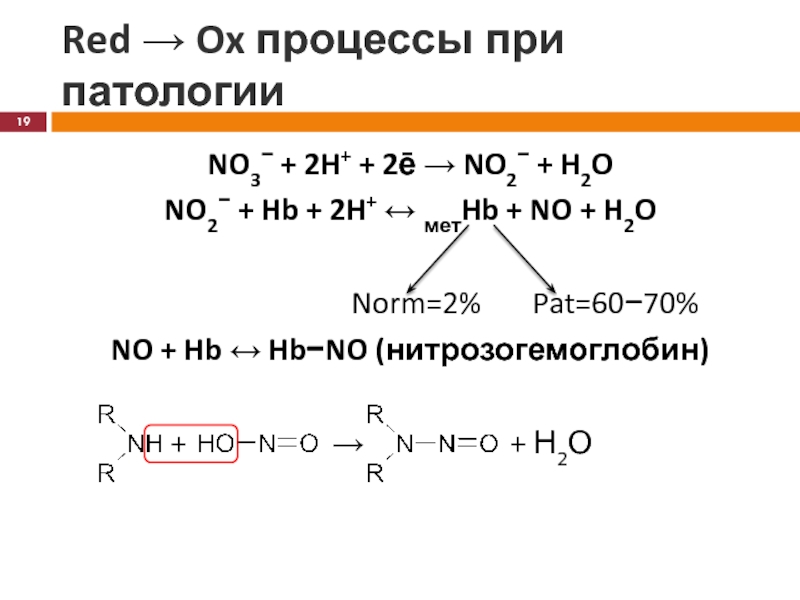
Слайд 19Red → Ox процессы при патологии
NO3− + 2H+ + 2ē
→ NO2− + H2O
NO2− + Hb + 2H+ ↔ метHb
+ NO + H2ONorm=2% Pat=60−70%
NO + Hb ↔ Hb−NO (нитрозогемоглобин)
+ → + Н2О