Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Отработка решения заданий ЕГЭ повышенного уровня на уроках химии
Содержание
- 1. Отработка решения заданий ЕГЭ повышенного уровня на уроках химии
- 2. «Чтобы избегать ошибок, надо набираться опыта; чтобы набираться опыта, надо делать ошибки…».
- 3. № 36(С1). Используя метод электронного баланса, составьте уравнение реакции. Определите окислитель и восстановитель.
- 4. Шкала оценивания выполнения таких
- 5. ОВР- это такие реакции, при которых происходит
- 6. Слайд 6
- 7. Na2O2 + KMnO4 + … → MnSO4
- 8. 1. Степень окисления элемента в простом веществе
- 9. Одно из уравнений в задании 38 решается
- 10. Необходимые навыкиРасстановка степеней окисленияЗадавать себе главный вопрос:
- 11. № 40(С 5). Вывод молекулярной формулы вещества
- 12. Слайд 12
- 13. Часть 2. Задание 40. Задачи на определение
- 14. Некоторый углеводород содержит 12,19% водорода по массе.
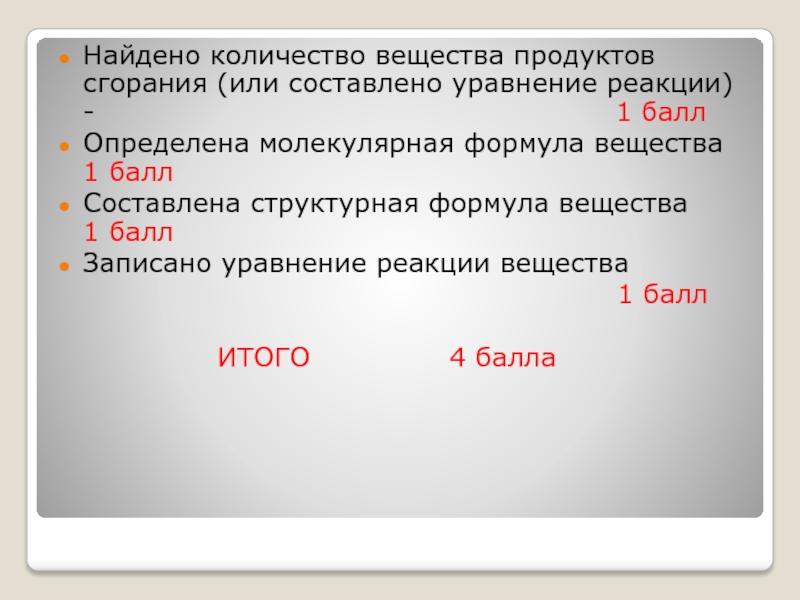
- 15. Найдено количество вещества продуктов сгорания (или составлено
- 16. Отработка решений заданий части С егэ в
- 17. Отработка решений заданий части С егэ в
- 18. Отработка решений заданий части С егэ в рамках уроков химии.Учитель Самсонова Л.В.2015-2016 учебный год.
- 19. Слайд 19
- 20. Слайд 20
- 21. Слайд 21
- 22. Слайд 22
- 23. Скачать презентанцию
«Чтобы избегать ошибок, надо набираться опыта; чтобы набираться опыта, надо делать ошибки…».
Слайды и текст этой презентации
Слайд 3№ 36(С1). Используя метод электронного баланса, составьте уравнение реакции. Определите
окислитель и восстановитель.
Слайд 4 Шкала оценивания выполнения таких заданий включает в
себя следующие
элементы:составлен электронный баланс – 1 балл
составлено общее уравнение окислительно-восстановительной реакции – 1 балл
определены окислитель и восстановитель
– 1 балл
ИТОГО 3 балла
Слайд 5ОВР- это такие реакции, при которых происходит изменение степеней окисления
атомов химических элементов или ионов, образующих реагирующие вещества.
Слайд 6 Давайте сравним? Задание
20 из варианта ОГЭ по химии 9 класс и задание
36 из ЕГЭ 11 классKMnO4+Na2SO3+H2SO4→MnSO4 +Na2SO4+K2SO4+H2O
Na2O2 + KMnO4 + ….→ MnSO4+… + …+ K2SO4 + H2O
Слайд 7Na2O2 + KMnO4 + … → MnSO4 + … +
… + K2SO4 + … Na2O2–1 + KMn+7O4 + H2SO4
→ Mn+2SO4 + Na2SO4 + O20 + K2SO4 + H2O2O–1 – 2e → O20 5
Mn+7 + 5e → Mn+2 2
5Na2O2+2KMnO4 + 8H2SO4=2MnSO4 + 5Na2SO4+ 5O2+K2SO4+8H2O
KMnO4 (за счет Mn+7) – окислитель
Na2O2 (за счет O–1) – восстановитель
Слайд 8 1. Степень окисления элемента в простом веществе равна
1) нулю
2) числу
электронов во внешнем электронном слое
3) числу неспаренных электронов
4) номеру группы
2.
Высшую степень окисления марганец проявляет в соединении1) КМnО4 2) МnО2 3) К2MnО4 4) MnSO4
3. Наибольшую степень окисления марганец проявляет в соединении
1) МnСl2 2) МnО 3) К2МnО4 4) МnСO3
4. Наибольшую степень окисления марганец имеет в соединении
1) MnSO4 2) МnО2 3) К2МnО4 4) Мn2О3
5. Степень окисления - 3 фосфор проявляет в соединении
1) РН3 2) Р2О3 3) NaH2PO4 4) Н3РО4
6. Наименьшую степень окисления сера проявляет в соединении
1) Na2S 2) Na2SO3 3) Na2SO4 4) SO3
7. Одинаковую степень окисления азот проявляет в веществах, указанных в ряду:
1) N2O5, HNO3, NaNO3
2) NО2, HNO3, KNO3
3) NO, NO2, N2O3
4) HNO3, HNO2, NO2
Слайд 9Одно из уравнений в задании 38 решается как ОВР
CH3CHO +
2KMnO4 + 3KOH = CH3COOK + 2K2MnO4 + 2H2O
5C2H5OH +4KMnO4 +6H2SO4 =5CH3COOH +4MnSO4 +2K2SO4+
11H2OСлайд 10Необходимые навыки
Расстановка степеней окисления
Задавать себе главный вопрос: кто в этой
реакции отдаёт электроны, а кто их принимает?
Определите, в какой среде
(кислой, нейтральной или щелочной) протекает реакция. если в продуктах мы видим кислоту, кислотный оксид — значит, это точно не щелочная среда, а если выпадает гидроксид металла — точно не кислая.Проверьте, чтобы в реакции был и окислитель, и восстановитель
Если оба вещества могут проявлять свойства и восстановителя, и окислителя — надо продумать, какое из них более активный окислитель. Тогда второй будет восстановителем.
Слайд 12 Типы задач
в задании 40.
Определение формулы вещества по массовым долям химических элементов
или по общей формуле вещества;Определение формулы вещества по продуктам сгорания;
Определение формулы вещества по
химическим свойствам.
Слайд 13Часть 2. Задание 40.
Задачи на определение формулы органического вещества
бывают нескольких видов. Обычно решение этих задач не представляет особых
сложностей, однако часто выпускники теряют баллы на этой задаче.Причин бывает несколько:
Некорректное оформление;
Решение не математическим путем, а методом перебора;
Неверно составленная общая формула вещества;
Ошибки в уравнении реакции с участием вещества, записанного в общем виде.
Слайд 14Некоторый углеводород содержит 12,19% водорода по массе. Молекула этого углеводорода
содержит один четвертичный атом углерода. Установлено, что этот углеводород может
взаимодействовать с аммиачным раствором оксида серебра с образованием бурого осадка.На основании этих данных:
1) установите простейшую формулу углеводорода,
2) составьте его структурную формулу,
3) приведите уравнение реакции его взаимодействия с аммиачным раствором оксида серебра.
Слайд 15Найдено количество вещества продуктов сгорания (или составлено уравнение реакции) -
1 балл
Определена молекулярная формула вещества 1 балл
Составлена структурная формула вещества 1 балл
Записано уравнение реакции вещества
1 балл
ИТОГО 4 балла
Слайд 16Отработка решений заданий части С егэ в рамках уроков химии.
Учитель
Самсонова Л.В.
2015-2016 учебный год.
Из официальных публикаций ФИПИ: «Особо отмечаем, что
задания части С могут быть выполнены разными способами. В критериях, в качестве образца, приведён один из возможных вариантов решения. Возможны и другие варианты решения. Решение задачи способом, не соответствующим критериям, не может служить основанием для снижения оценки. Правильность нестандартного решения должны определить эксперты-экзаменаторы на месте при проверке экзаменационных работ».Слайд 17Отработка решений заданий части С егэ в рамках уроков химии.
Учитель
Самсонова Л.В.
2015-2016 учебный год.
Алгоритм решения задач на вывод формулы органического
вещества по массовым долям элементов:Найти мольное отношение атомов в веществе
(отношение индексов есть отношение частных от деления массовой доли элемента на его относительную атомную массу);
Используя молярную массу вещества, определить формулу.
Алгоритм решения задач по продуктам сгорания:
Найти количество вещества элементов в продуктах сгорания
(C, H, O, N, S и других);
Их отношение есть отношение индексов.
Алгоритм решения задач по химическому уравнению:
-Составить общие формулы веществ;
- Молярные массы выразить через n( количество вещества)
-Приравнять количества веществ с учётом коэффициентов
Слайд 18Отработка решений заданий части С егэ в рамках уроков химии.
Учитель
Самсонова Л.В.
2015-2016 учебный год.
Теги