Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
План занятия. Теория А1, А2
Содержание
- 1. План занятия. Теория А1, А2
- 2. 1. Периодический закон (ПЗ) Свойства химических
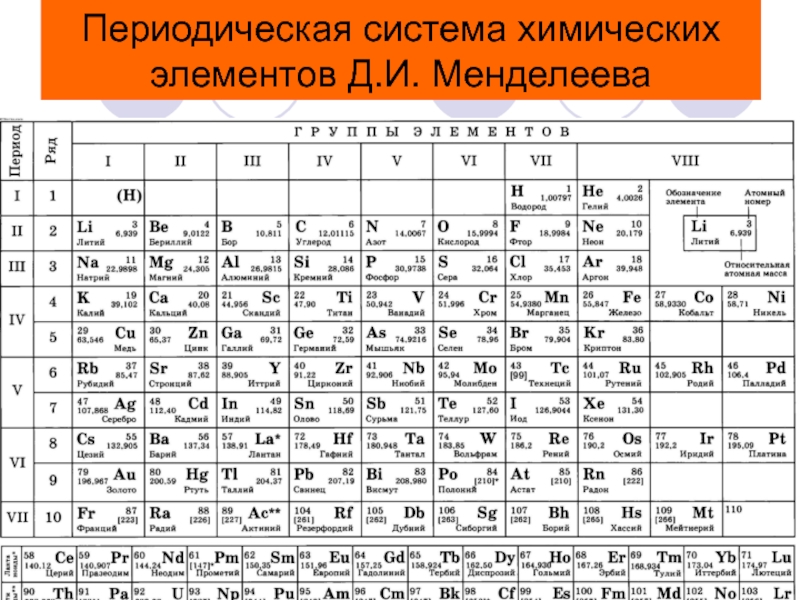
- 3. Периодическая система химических элементов Д.И. Менделеева
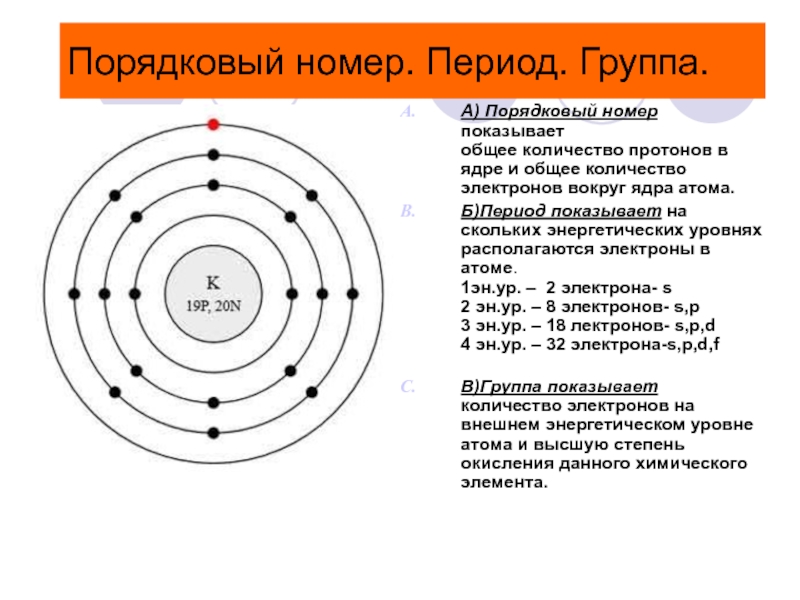
- 4. Порядковый номер. Период. Группа.А) Порядковый номер показывает
- 5. Слайд 5
- 6. Практика по первому блоку1. Охарактеризуйте элементы номер
- 7. 2.Закономерности устанавливаемые ПЗ. а) Металлические свойства –
- 8. Слайд 8
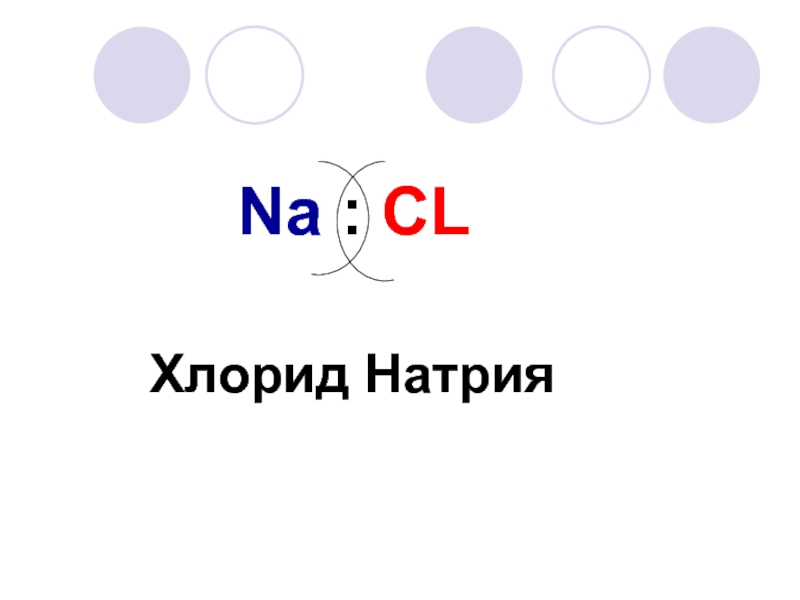
- 9. Na : CLХлорид Натрия
- 10. – способность принимать электроны. Синоним Неметаллических
- 11. По периодам – с увеличением заряда
- 12. г) Окислительно-восстановительные свойства химических элементовВосстановительные свойства –
- 13. Практика по второму блоку1.Mg,Si,P,Sr,Mn,Cu,Na - В предсталенном
- 14. Как это применить????1.
- 15. Задания ЕГЭ. А1.А2.
- 16. Слайд 16
- 17. Слайд 17
- 18. Слайд 18
- 19. Скачать презентанцию
1. Периодический закон (ПЗ) Свойства химических элементов, а также формы и свойства образуемых ими простых веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов
Слайды и текст этой презентации
Слайд 1План занятия.
Теория А1, А2.
1.Что такое Периодический Закон (ПЗ) и периодическая
система Д.И. Менделеева ? Что означают: а) Порядковый номер б) Период в) Группа
Какие закономерности ПЗ устанавливает для: а) Металлических и Неметаллических свойств химических элементов в периодической таблице Д.И. Менделеева? б) Электроотрицательности (ЭО) элементов? в) Радиус атома? г) Окислительных и восстановительных свойств химических элементов?Слайд 21. Периодический закон (ПЗ)
Свойства химических элементов, а также
формы и свойства образуемых ими простых веществ и соединений находятся
в периодической зависимости от величины зарядов ядер их атомовСлайд 4Порядковый номер. Период. Группа.
А) Порядковый номер показывает
общее количество протонов в
ядре и общее количество электронов вокруг ядра атома.
Б)Период показывает на
скольких энергетических уровнях располагаются электроны в атоме.
1эн.ур. – 2 электрона- s
2 эн.ур. – 8 электронов- s,p
3 эн.ур. – 18 лектронов- s,p,d
4 эн.ур. – 32 электрона-s,p,d,f
В)Группа показывает количество электронов на внешнем энергетическом уровне атома и высшую степень окисления данного химического элемента.
Слайд 6Практика по первому блоку
1. Охарактеризуйте элементы номер 11,13, 20 по
положению в периодической системе. 2. У каких элементов на внешнем энергетическом
уровне 3 электрона? Назовите их. 3.Составьте электронно-графические формулы атомов элементов: азот, углерод, магний. Определите количество электронов на внешнем энергетическом уровне. 4. Какие из приведенных химических элементов в основном состоянии имеют на внешнем уровне 2 электрона: В,Mg,P,He ? Напишите электронно графические формулы данных элементов. 5. Какие из приведенных химических элементов в основном состоянии имеют на внешнем уровне 2 электрона: O,F,Si,Cl? Напишите электронно графические формулы данных элементовСлайд 72.Закономерности устанавливаемые ПЗ.
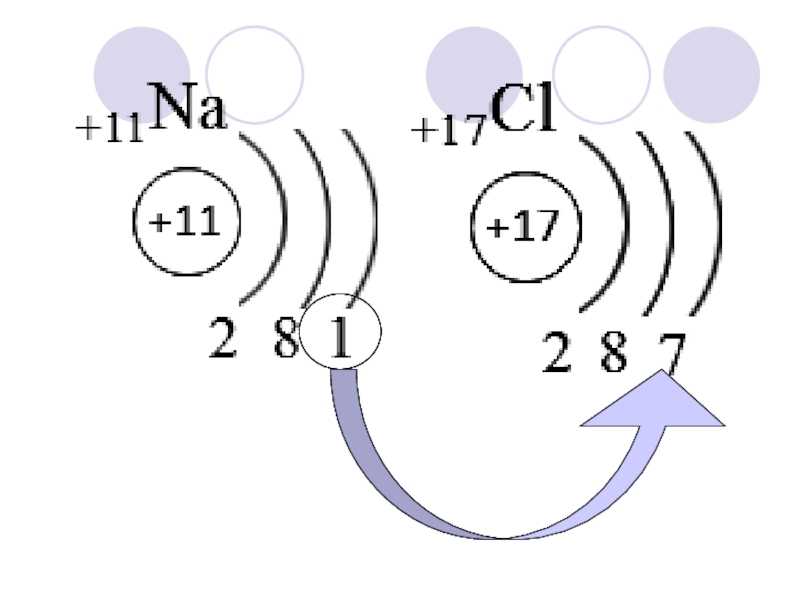
а) Металлические свойства – способность химического элемента
отдавать электроны с внешнего уровня на образование связи, для завершения
энергитического уровня (8 или 2электрона). Элементы I – III групп (исключая бор). НеМеталлические свойства - способность химического элемента присоединять электроны от другого элемента для образования связи, таким образом завершая свой энергетический уровень (8 или 2электрона). Элементы I V– VII групп и бор. По периодам с возрастанием заряда ядра (увеличением порядкового номера) Металлические свойства ослабевают, Неметаллические свойства усиливаются. По группам сверху вниз металлические свойства усиливаются, неметаллические ослабевают.Слайд 10
– способность принимать электроны. Синоним Неметаллических свойств. Следовательно изменяется
также, как Неметаллические свойства элементов в периодической системе. Самый электроотрицательный
элемент – фтор.б) Электроотрицательность (ЭО)
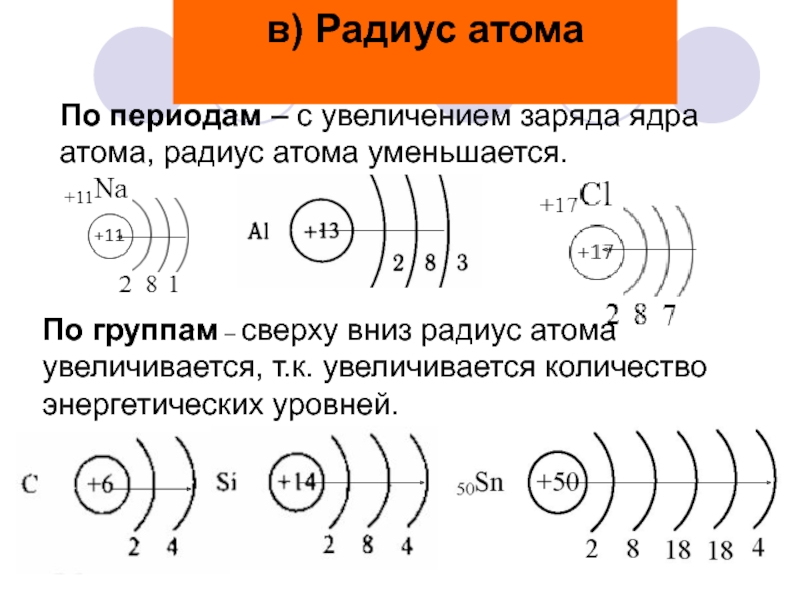
Слайд 11 По периодам – с увеличением заряда ядра атома, радиус атома
уменьшается.
По группам – сверху вниз радиус атома увеличивается, т.к. увеличивается
количество энергетических уровней.в) Радиус атома
Слайд 12г) Окислительно-восстановительные свойства химических элементов
Восстановительные свойства – способность химического элемента
отдавать электроны в ходе химической реакции, для завершения внешнего энерго
уровня. Синоним Металлических свойств. Изменяются также, как Металлические свойства. Окислительные свойства – способность химического элемента присоединять электроны в ходе химической реакции, для завершения внешнего энерго уровня. Синоним Неметаллических свойств. Изменяются также, как Неметаллические свойства.Слайд 13Практика по второму блоку
1.Mg,Si,P,Sr,Mn,Cu,Na - В предсталенном ряду веществ какие
из них Ме, а какие НеМе?
2.Расположите в порядке увеличения неметаллических
свойств:Cl,Mg,Si,Al.3.Расположите в порядке усиления восстановительных свойств: Ca,Mg,Ba.
4.Расположите в порядке увеличения атомного радиуса: B,Ga,Al,In.
5.Расположите в порядке уменьшения атомного радиуса: Be, N,O,C,B.
6.Назовите понятия-синонимы Металлических и Неметаллических свойств.