Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Предмет органической химии
Содержание
- 1. Предмет органической химии
- 2. Берцелиус (Berzelius) Йенс Якоб (20 августа 1779,
- 3. Немецкий химик. Родился в Эшерсхейме (близ Франкфурта-на-Майне)
- 4. Слайд 4
- 5. Слайд 5
- 6. Слайд 6
- 7. ВеществаОрганическиеПолучены из продуктовжизнедеятельности рас-тительных и животныхорганизмов (сахар,
- 8. Раздел химии, который изучает органические вещества, стали
- 9. Круговорот углерода в природеЕжегодно в процесс фотосинтеза
- 10. Слайд 10
- 11. Слайд 11
- 12. Органические вещества имеют ряд особенностей:их гораздо больше,
- 13. Если исчезнут органические вещества?
- 14. Слайд 14
- 15. Слайд 15
- 16. Слайд 16
- 17. Слайд 17
- 18. Слайд 18
- 19. Теория химического строения Для
- 20. Основное положение ТХС: Порядок соединения атомов химических
- 21. Например, химическое строение метана:
- 22. Слайд 22
- 23. Строение молекулы пропана С3 Н8 отражают формулы:
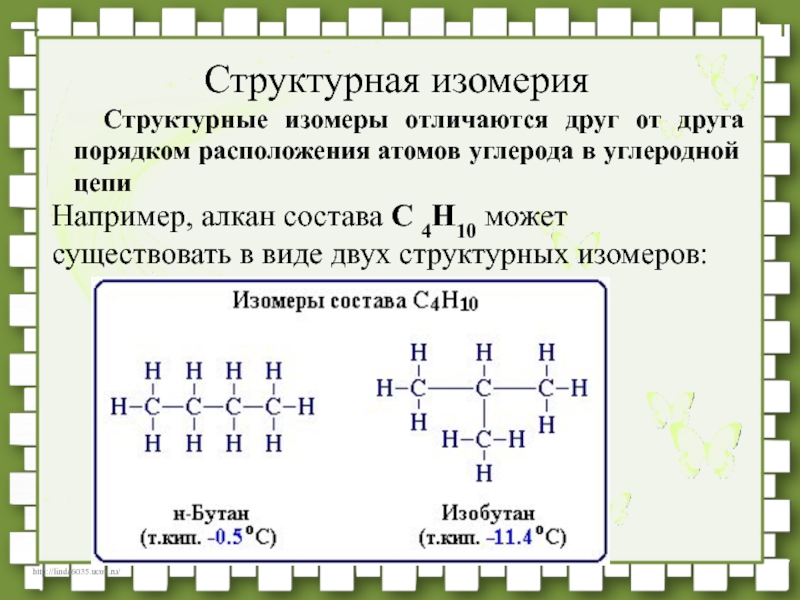
- 24. Основное положение ТХС: Изомерия – явление существования
- 25. Слайд 25
- 26. Основное положение ТХС: Вывод: свойства вещества определяются
- 27. Алканы – предельные углеводороды, в молекулах которых все атомы связаны одинарными связями.CnH2n + 2 Алканы
- 28. Для атомов углерода в насыщенных углеводородах (алканах)
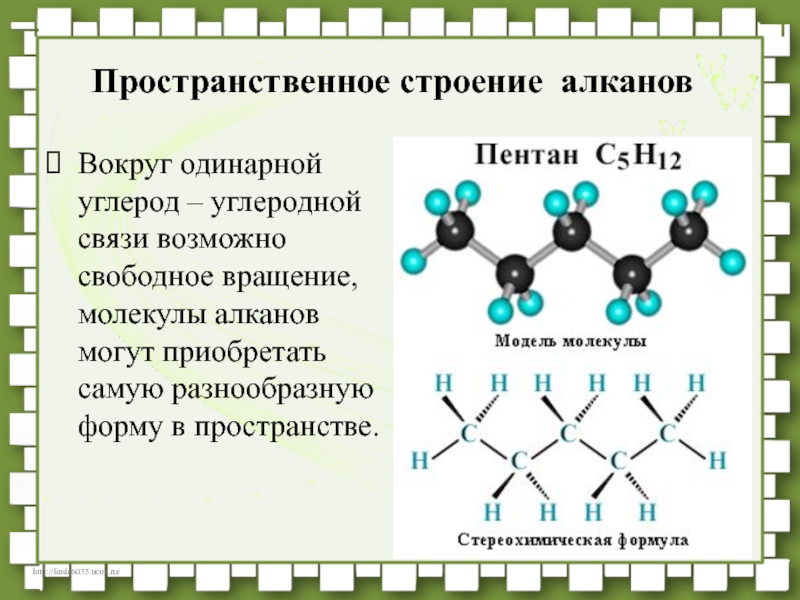
- 29. Вокруг одинарной углерод – углеродной связи возможно
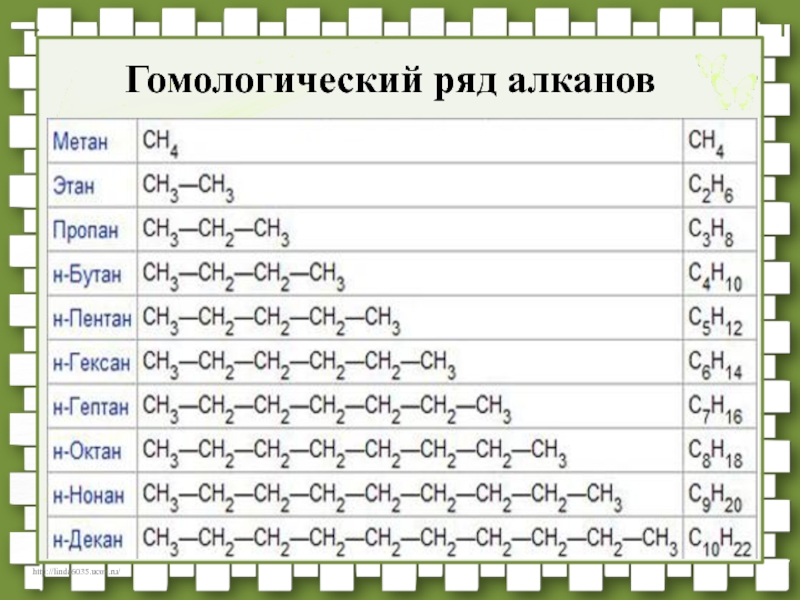
- 30. Гомологи – сходное строение и свойства,
- 31. Гомологический ряд алканов
- 32. Структурные изомеры отличаются друг от друга порядком
- 33. Номенклатура органических соединений –
- 34. Правила построения названий алканов по систематической международной номенклатуре ИЮПАК
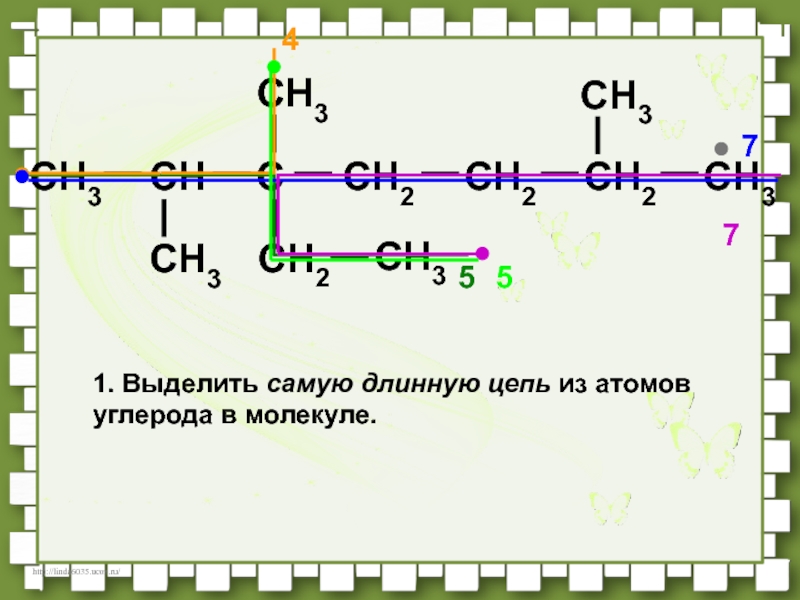
- 35. CH3CHCCH2CH2CH3CH3CH3CH2CH3CH3CH254771. Выделить самую длинную цепь из атомов углерода в молекуле.5
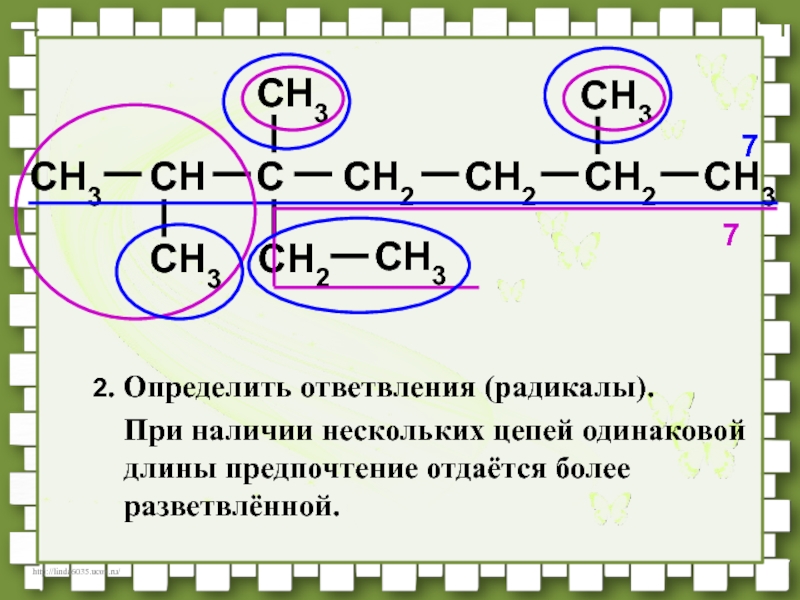
- 36. CH3CHCCH2CH2CH3CH3CH3CH2CH3CH3CH2772. Определить ответвления (радикалы).При наличии нескольких цепей одинаковой длины предпочтение отдаётся более разветвлённой.
- 37. CH3CHCCH2CH2CH3CH3CH3CH2CH3CH3CH2723165417236542,5,5,62,3,3,63. Пронумеровать атомы углерода в цепи с
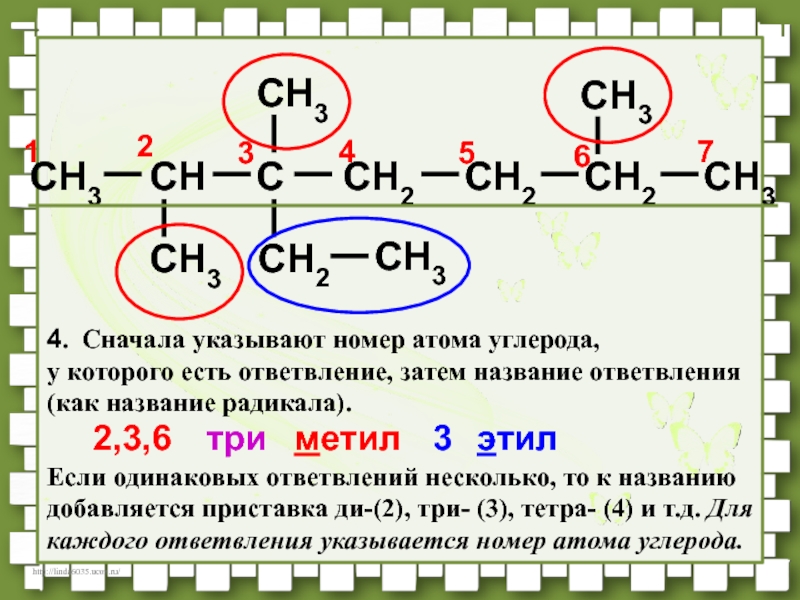
- 38. CH3CHCCH2CH2CH3CH3CH3CH2CH3CH3CH276541232,3,63метилэтилтри4. Сначала указывают номер атома углерода,
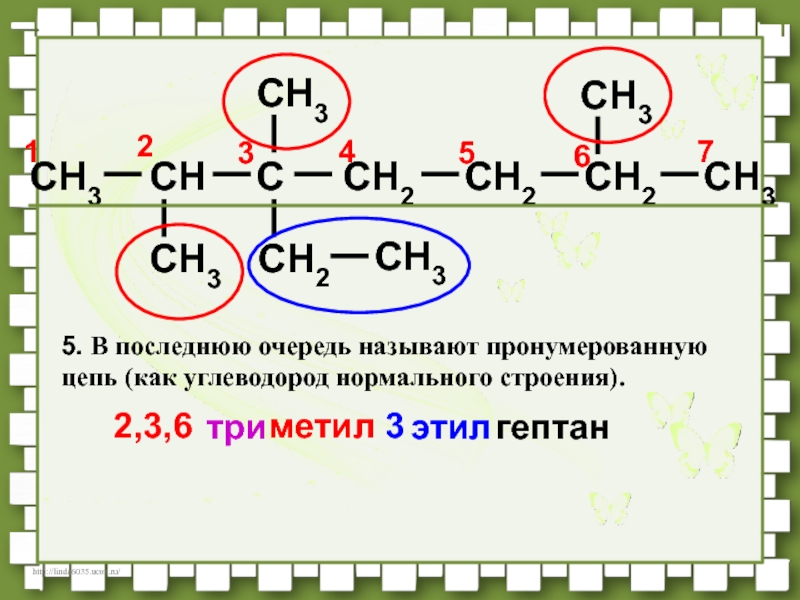
- 39. CH3CHCCH2CH2CH3CH3CH3CH2CH3CH3CH276541232,3,63метилэтилтригептан5. В последнюю очередь называют пронумерованную цепь (как углеводород нормального строения).
- 40. ДОМАШНЕЕ ЗАДАНИЕ:§31, 32 до стр. 158; № 4 стр.160, табл. 9 стр. 157.
- 41. Слайд 41
- 42. Слайд 42
- 43. Скачать презентанцию
Слайды и текст этой презентации
Слайд 3Немецкий химик. Родился в Эшерсхейме (близ Франкфурта-на-Майне) в 1800 г.
Окончил медицинский факультет Гейдельбергского университета (1823 г.). Специализировался по химии
под руководством Л. Гмелина в Гейдельбергском и Я.Я. Берцелиуса в Стокгольмском университетах. В 1825-1835 гг. работал в Технической школе в Касселе (с 1831 г. – профессор). С 1836 г. - профессор Гёттингенского университета.Научные исследования посвящены как неорганической, так и органической химии. Еще в студенческие годы самостоятельно приготовил йодистый цианат и тиоцианат ртути. Открыл (1822 г.) циановую кислоту. Наряду с Ю. Либихом установил (1823 г.) наличие изомерии фульминатов (солей гремучей ртути). Доказал (1828 г.) возможность получения мочевины упариванием водного раствора цианата аммония, что считается первым синтезом природного органического вещества из неорганического!
Фридрих Вёлер (Wöhler)
Слайд 7Вещества
Органические
Получены из продуктов
жизнедеятельности рас-
тительных и животных
организмов (сахар, жи-
ры, масла, красители
и
др.), а также синтети-
ческие вещества (поли-
этилен, капрон и др.).
Известно
около 27млн. Неорганические
Минеральные (вещества неживой природы: глина, песок, металлы и др.).
Таких веществ около 1 млн.
Слайд 8Раздел химии, который изучает органические вещества, стали называть «органической химией»
Так
как в состав каждого органического вещества входит элемент углерод, то
Органическая химия - это химия соединений углерода ( кроме оксидов углерода, угольной кислоты и её солей).Слайд 9Круговорот углерода в природе
Ежегодно в процесс фотосинтеза вовлекается 170 млрд
т углекислого газа, 68 млрд т воды, а также около
6 млрд т азота, 2 млрд т фосфора, миллионы тонн калия, кальция, магния, серы, железа и др. элементовСлайд 12Органические вещества имеют ряд особенностей:
их гораздо больше, чем неорганических веществ;
орг.
вещества имеют более сложное строение, чем неорганические;
многие орг. вещества обладают
огромной молекулярной массой
например белки , углеводы, нуклеи-
новые кислоты и др.)
при горении органических веществ
обычно образуются углекислый газ и
вода.
ДНК
Слайд 19Теория химического строения
Для органической химии основополагающей
стала теория химического строения (ТХС) органических веществ А.М. Бутлерова, подобно
тому, как для неорганической химии основополагающим является периодический закон и периодическая система химических элементов Д.И.Менделеева.А.М. Бутлеров
Слайд 20Основное положение ТХС:
Порядок соединения атомов химических элементов в молекуле
согласно их валентности называется химическим строением.
Запомни! Углерод в органических
соединениях всегда четырёхвалентен.C (IV), H (I), O (II), N (III), S(II), Cl (I).
1. Атомы химических элементов в молекулах соединены в строгой последовательности в соответствии с их валентностями.
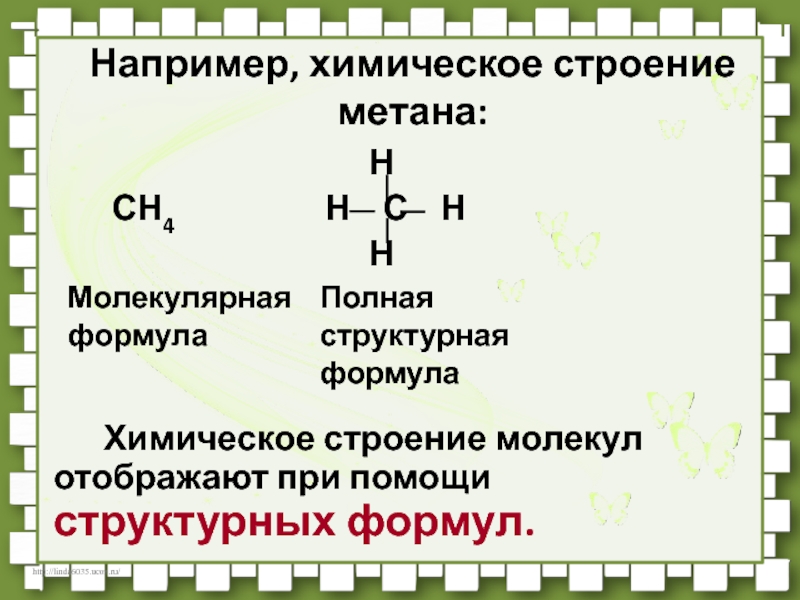
Слайд 21Например, химическое строение метана:
Н
СН4 Н С Н
Н
Химическое строение молекул отображают при помощи структурных формул.
Молекулярная формула
Полная структурная формула
Слайд 23Строение молекулы пропана С3 Н8 отражают формулы:
Н Н Н
Н С С С НН Н Н
СН3 СН2 СН3
Как показывают формулы пропана, атомы
углерода в этом веществе соединены не только с атомами водорода, но и друг с другом.
Полная структурная формула
Сокращённая структурная формула
Слайд 24Основное положение ТХС:
Изомерия – явление существования разных веществ с
одинаковым качественным и количественным составом, но имеющих разное строение и
свойства.Изомеры – вещества, имеющие одинаковую молекулярную форму, но разное строение и свойства.
2. Свойства вещества зависят не только от того, какие атомы и в каком количестве входят в состав его молекулы, но и от того, в каком порядке они соединены. То есть от химического строения. (следствием является изомерия).
Слайд 26Основное положение ТХС:
Вывод: свойства вещества определяются химическим, пространственным и
электрическим строением.
3. Атомы или группы атомов, образующие молекулы взаимно
влияют друг на друга, от чего зависят свойства вещества и его реакционная способность.Слайд 27Алканы – предельные углеводороды, в молекулах которых все атомы связаны
одинарными связями.
CnH2n + 2
Алканы
Слайд 28Для атомов углерода в насыщенных углеводородах (алканах) характерна sp3- гибридизация.
Атом углерода в молекуле метана расположен в центре тетраэдра, атомы
водорода – в его вершинах, все валентные углы между направлениями связей равны между собой и составляют угол 109°28‘. СТРОЕНИЕ МЕТАНА
Схема электронного строения молекулы метана