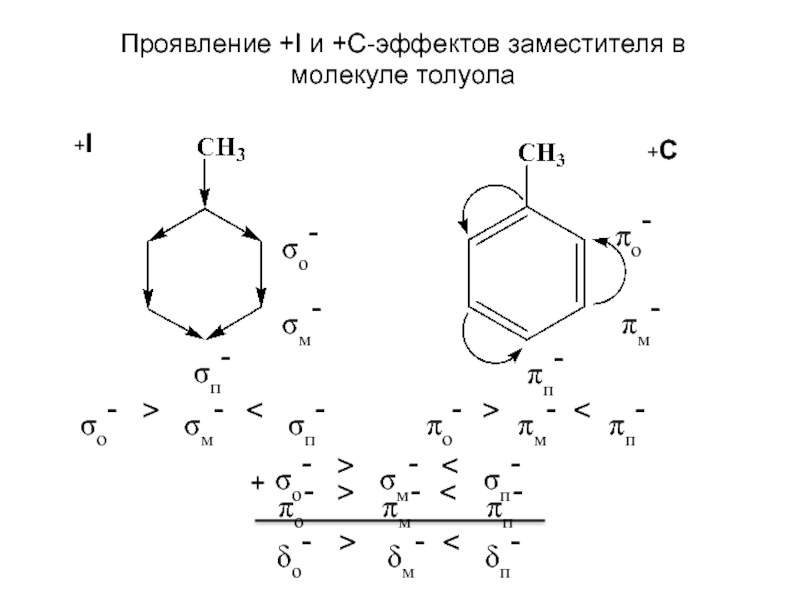
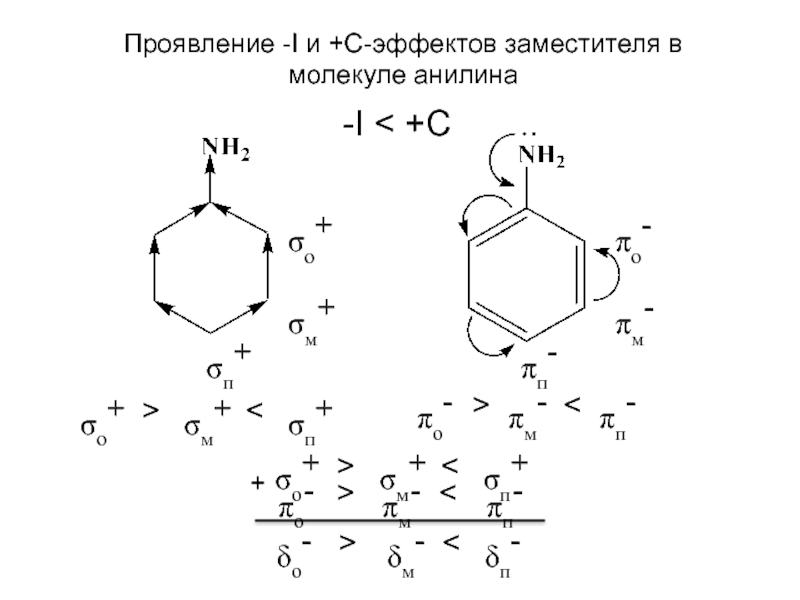
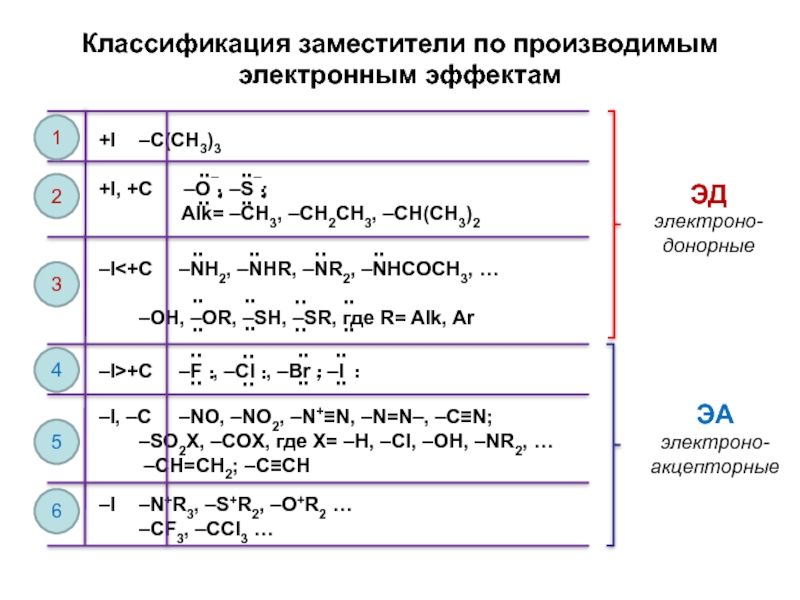
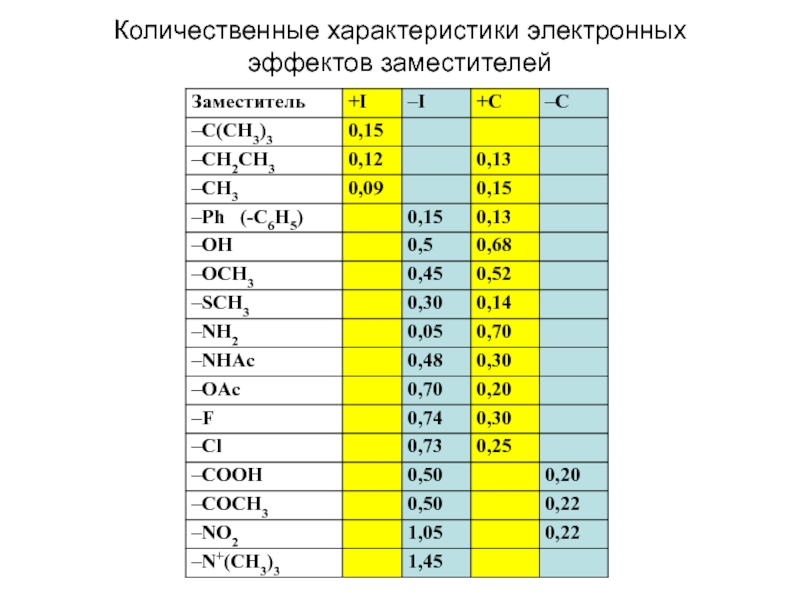
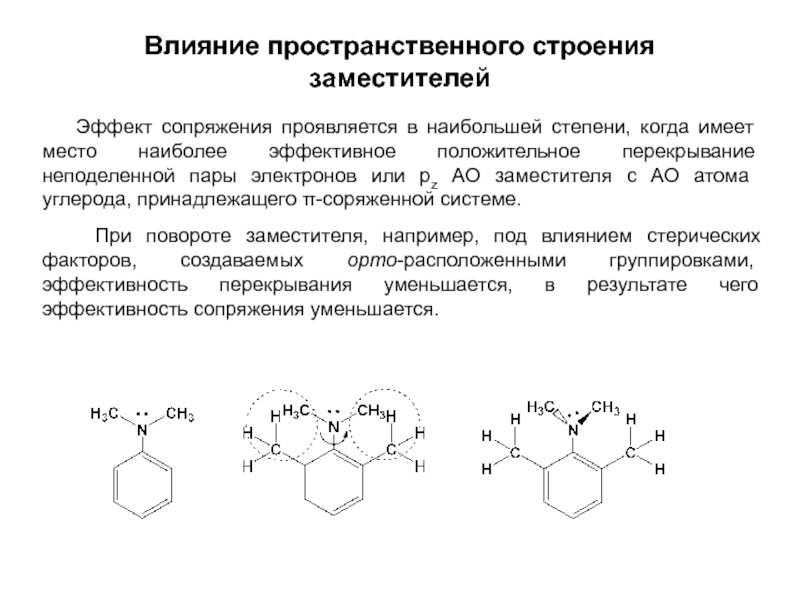
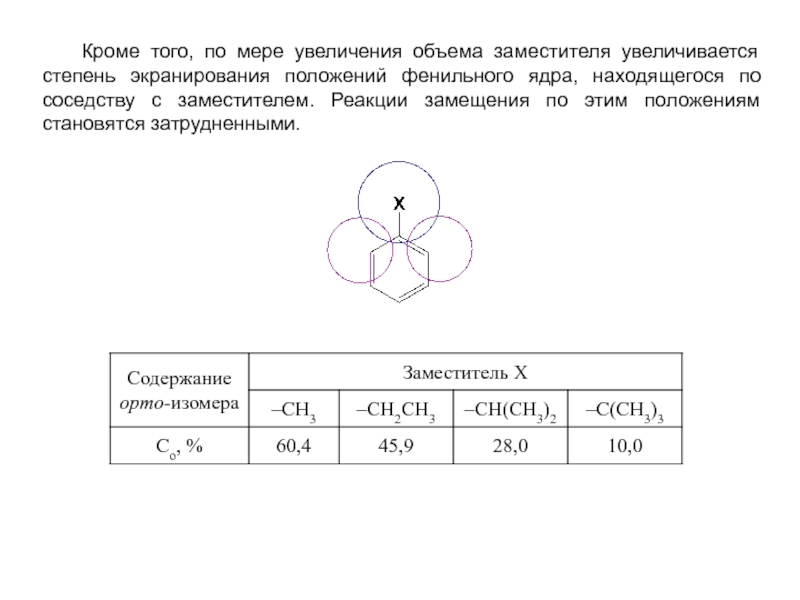
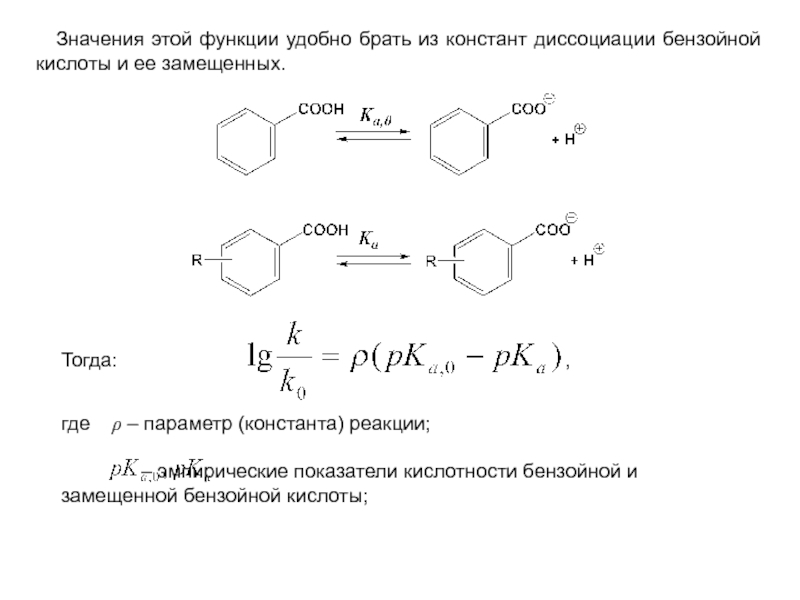
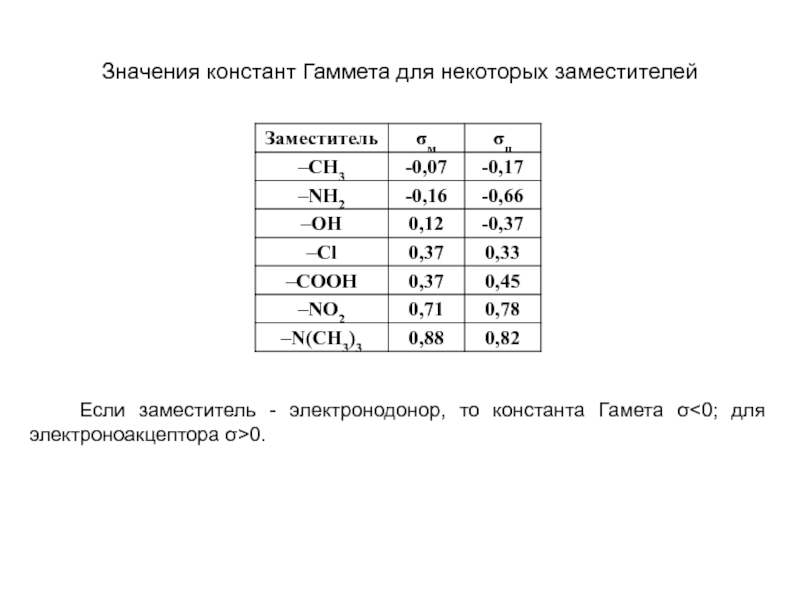
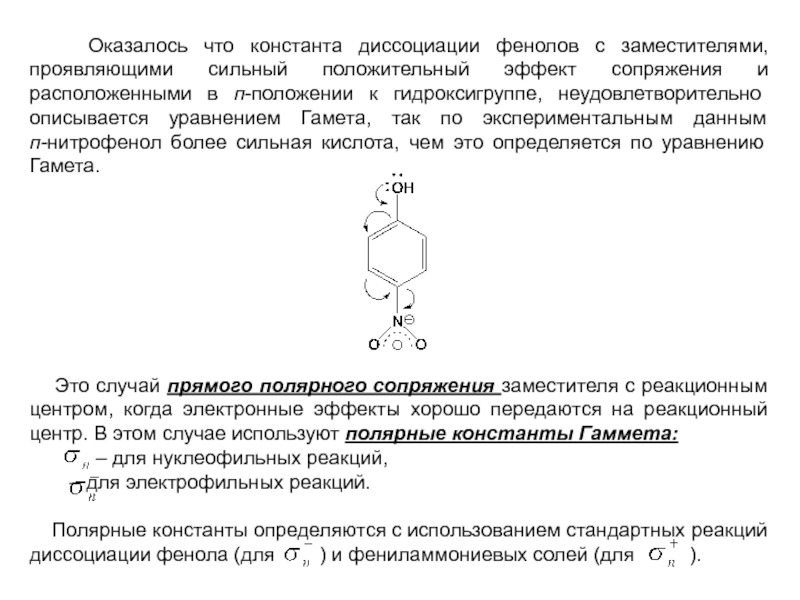
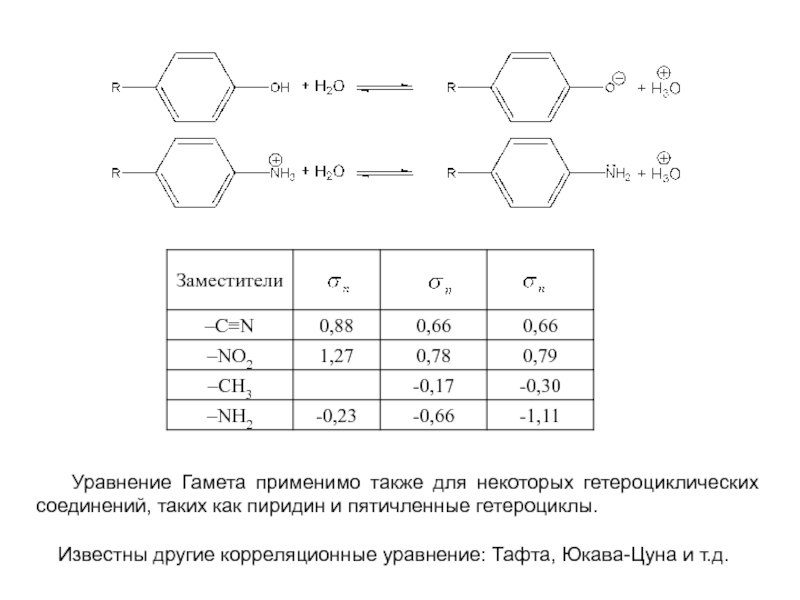
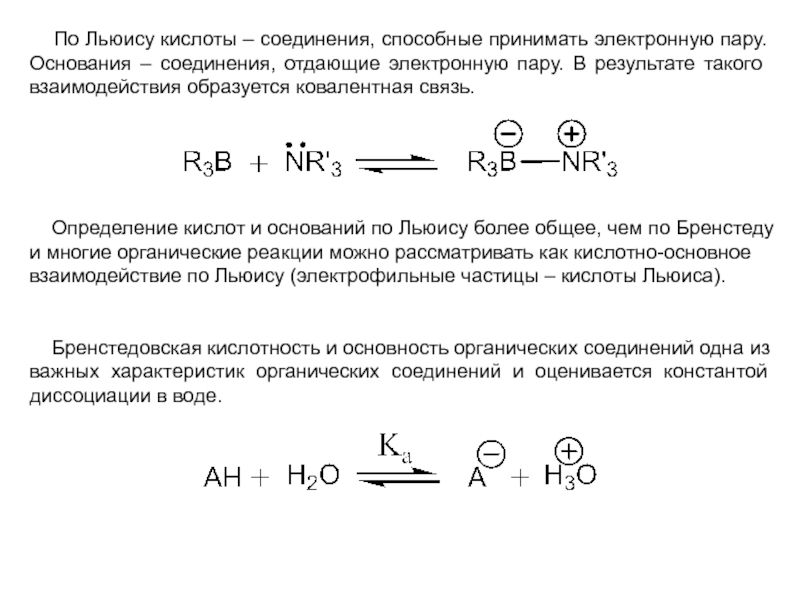
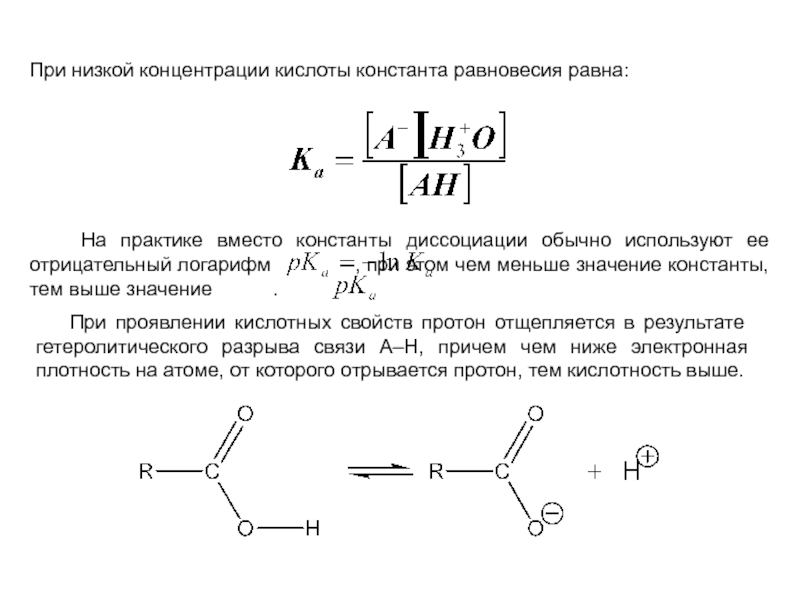
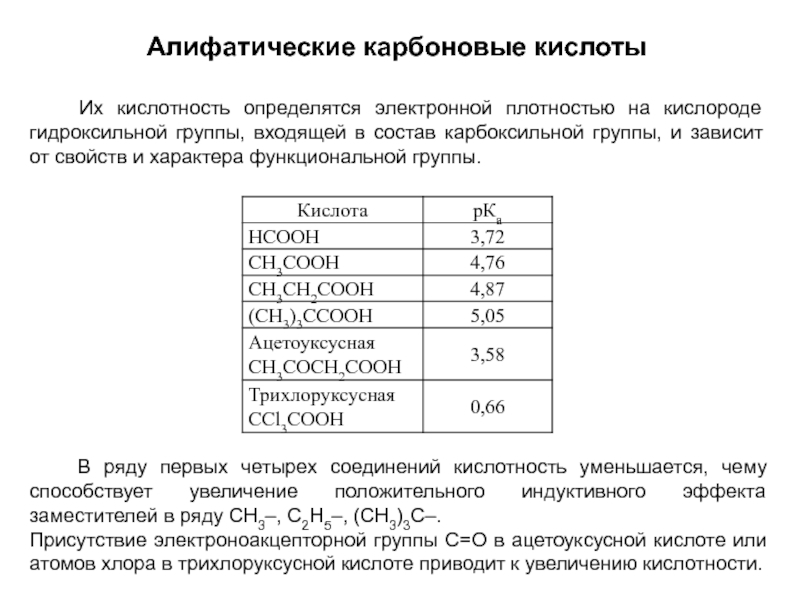
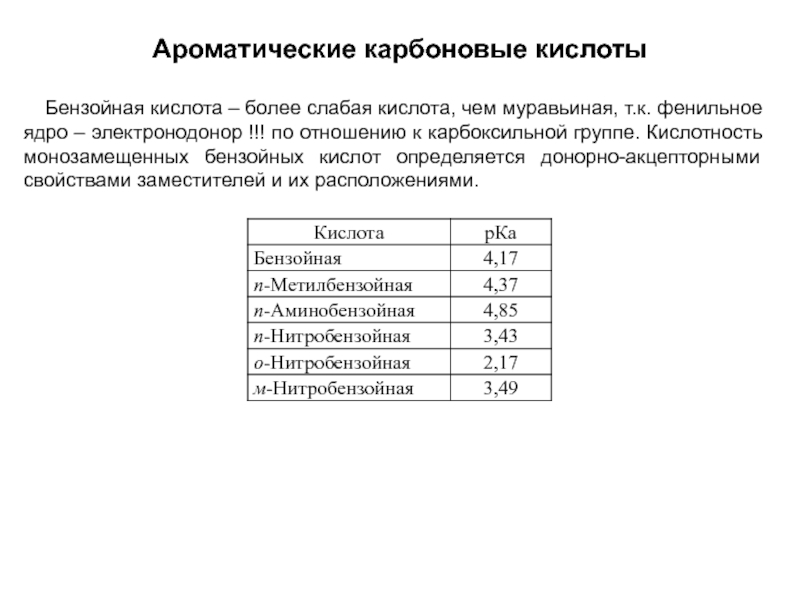
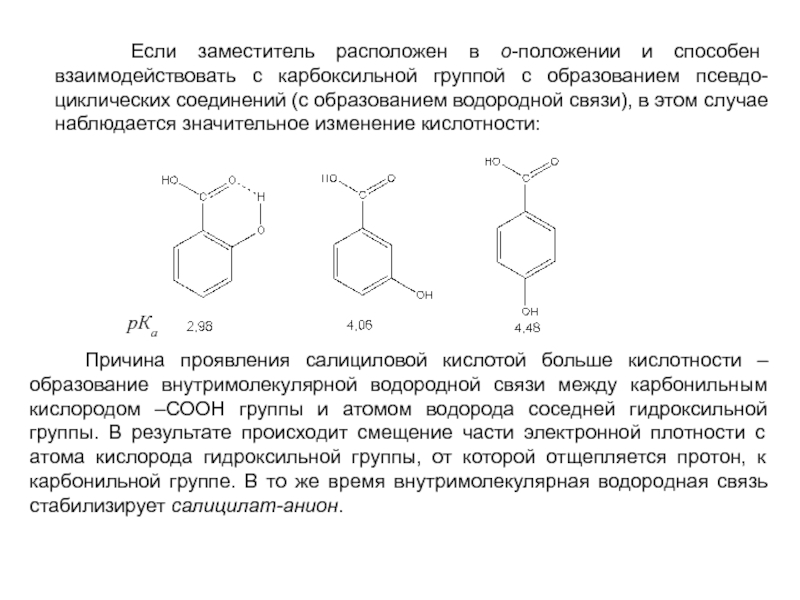
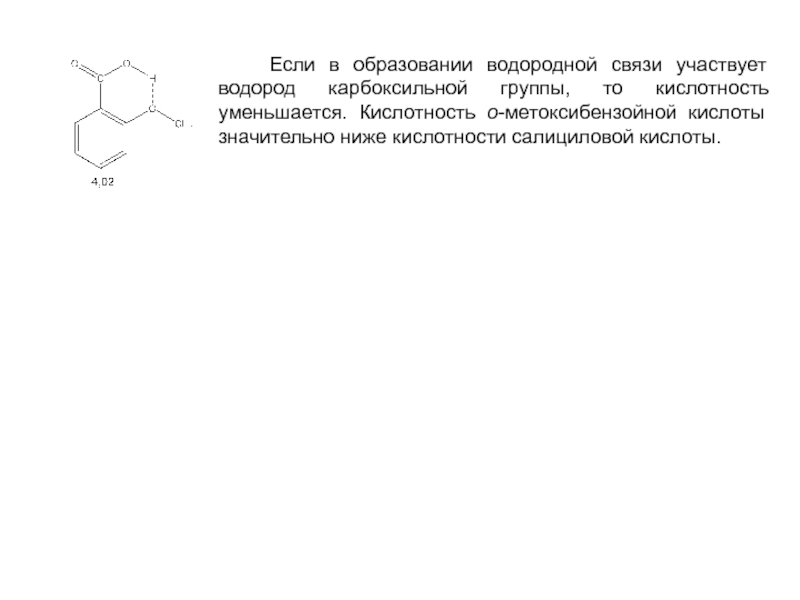
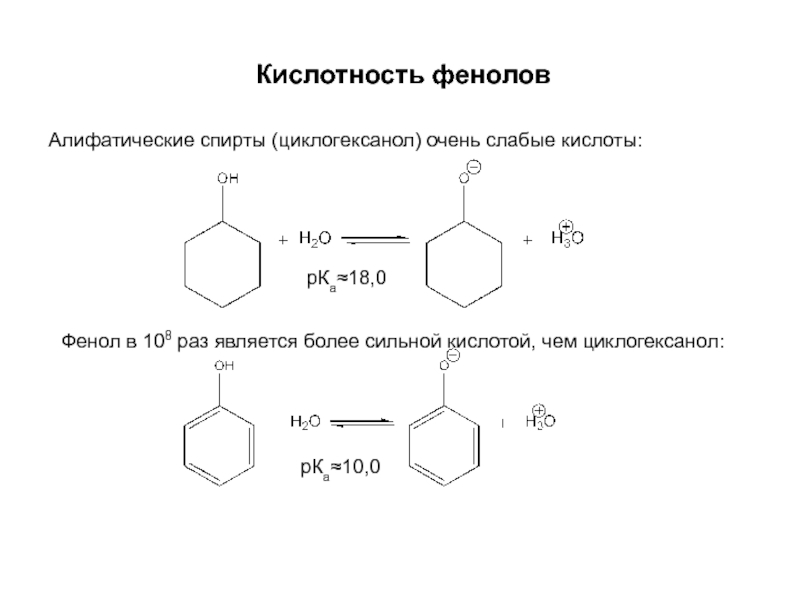
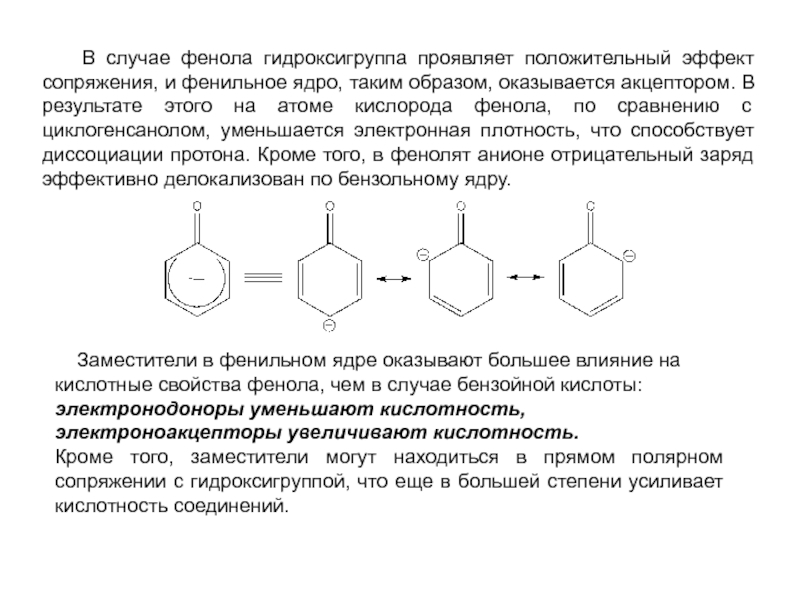
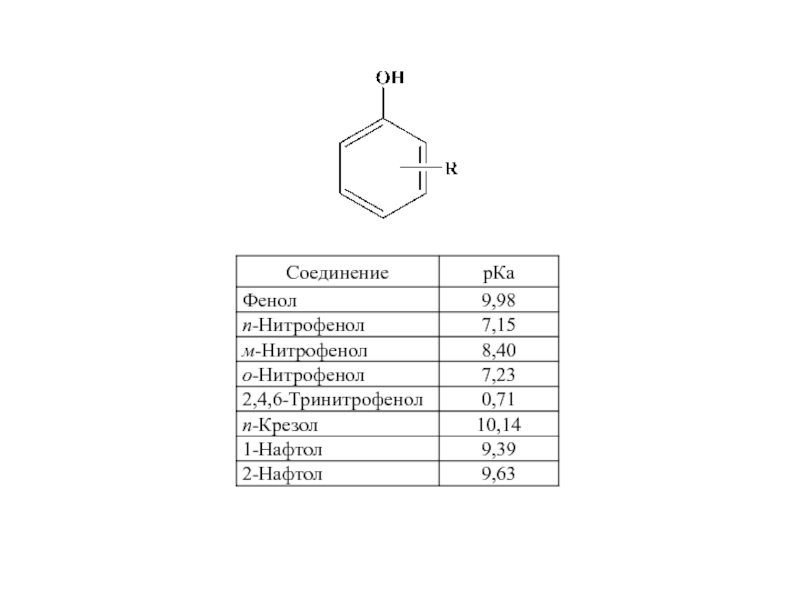
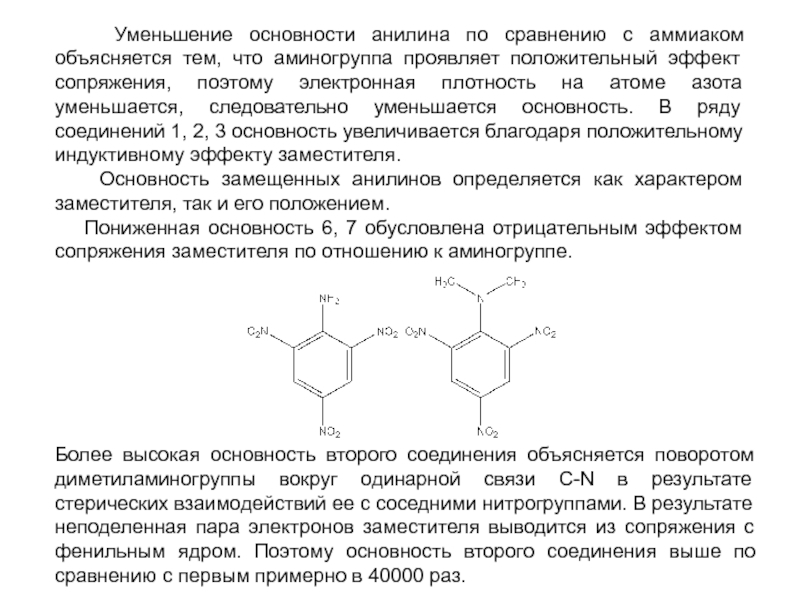
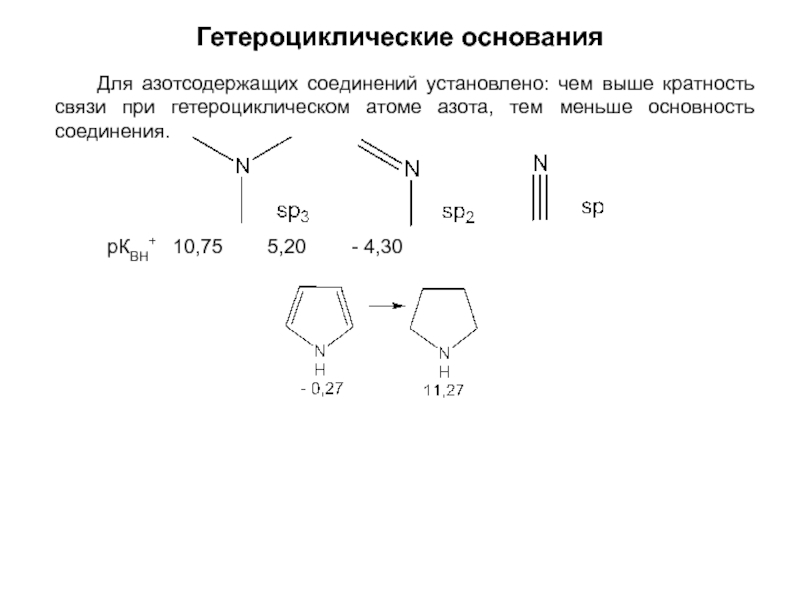
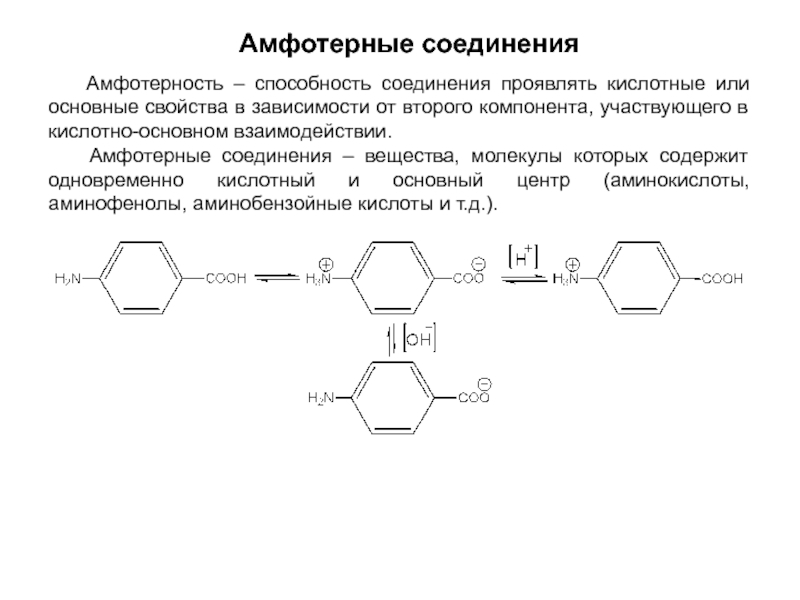
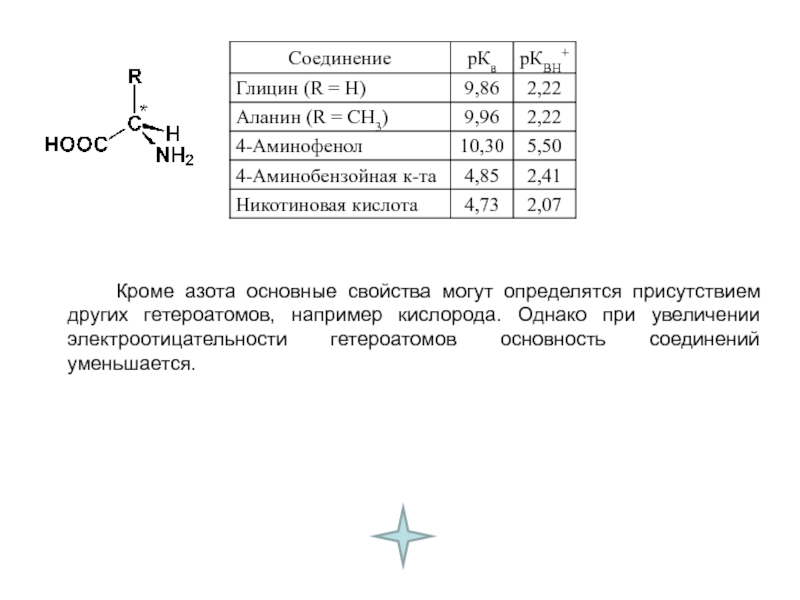
и эффект сопряжения, их относительные величины, можно качественно представить распределение
электронной плотности в замещенных бензолах. При этом ароматичное бензольное ядро условно представляют как систему с фиксированными двойными связями и рассматривают ее поляризацию за счет проявления индуктивного эффекта и эффекта сопряжения. Такой подход позволяет выявить наиболее богатые электронной плотностью положения и сделать предсказания относительно реакционной способности замещенных соединений. В молекуле толуола связь –CH3 проявляет +I и +С эффекты, таким образом является электронодонорным заместителем, т.е. увеличивает электронную плотность на бензольном ядре. Причем атомы углерода орто- и пара-положений имеют большую электронную плотность по сравнению с атомами углерода в мета-положениях. Поэтому реакция электрофильного замещения идет преимущественно в о- и п-положения.