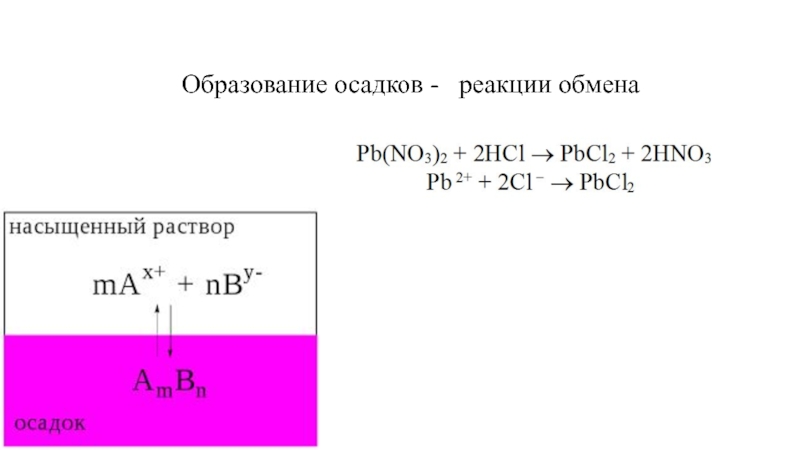
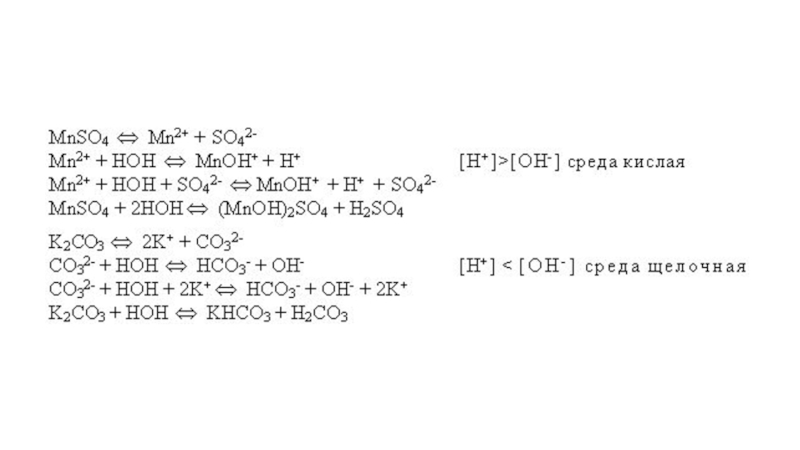
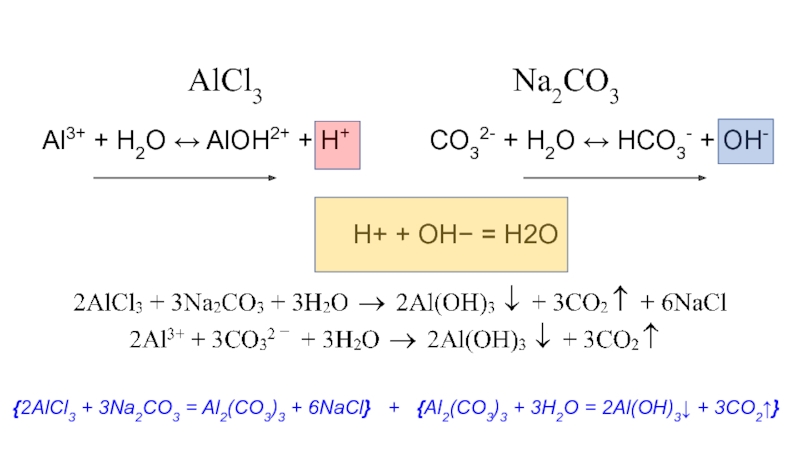
в растворе;
[CaCO3] - концентрация вещества в осадке (в твердой фазе),
она постоянна.Произведение растворимости – это произведение концентраций ионов малорастворимого вещества в его насыщенном растворе в степенях их стехиометрических коэффициентов.

![РАСТВОРЫ Гетерогенные равновесия растворов с осадком[Ca2+], [CO32] - равновесные концентрации ионов в Гетерогенные равновесия растворов с осадком[Ca2+], [CO32] - равновесные концентрации ионов в растворе;[CaCO3] - концентрация вещества в осадке](/img/thumbs/5d81f62125881239d6649abe0c1d5209-800x.jpg)