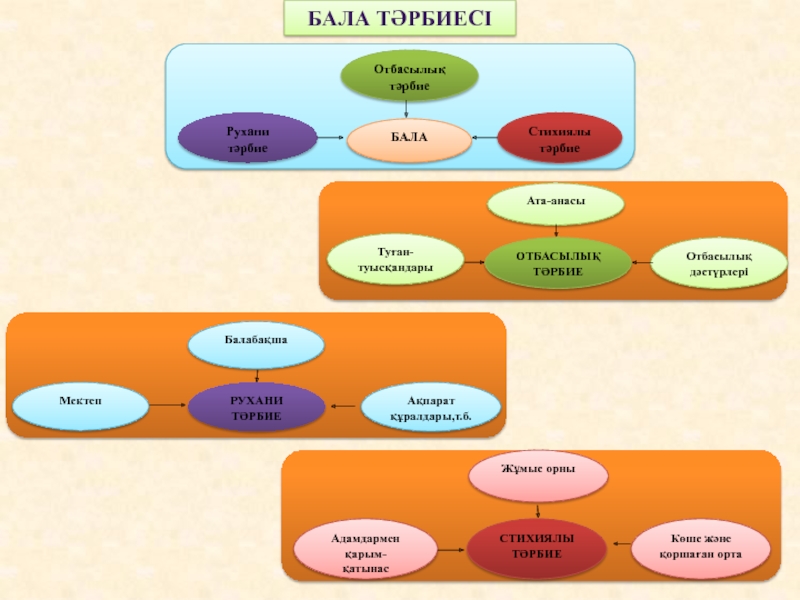
Слайд 2Классификация растворов
По агрегатному состоянию (Т, Ж, Г).
По соотношению растворенное
вещество-растворитель (насыщенные, ненасыщенные, пересыщенные).
По электропроводности (молекулярные, ионные).
Истинные растворы представляют собой
гомогенные системы, содержащие не менее двух веществ.
Вещество, взятое в избытке относительно другого компонента или не меняющее агрегатное состояние, называют растворителем.
Слайд 3Способы выражения концентрации растворов
Массовая доля (процентная концентрация
Молярная концентрация
С(Х), моль/л)
Моляльная концентрация b(X)
4. Мольная доля N(X):
Слайд 4Растворимость – наибольшая масса (количество) вещества, способная(ое) раствориться в 100
г растворителя при данной температуре.
В зависимости от растворимости вещества
делятся на хорошо растворимые (Р), мало растворимые (М) и практически нерастворимые (Н). Растворы бывают разбавленные (50%) и концентрированные (>50%); ненасыщенные, насыщенные и пересыщенные.
Концентрированные ≠ насыщенные
Слайд 5Тепловой эффект растворения
Процесс растворения – физико-химический процесс.
В зависимости
от природы растворяемых веществ включает в себя несколько стадий:
Разрушение кристаллической
решетки
(H1>0); физический процесс
2. Гидратация (сольватация) – взаимодействие вещества с растворителем (H20); химический
3. Самодиффузия (H30); процесс физический.
Суммарный тепловой эффект растворения H:
H= H1+ H2 + H3
Слайд 6Растворение твердых веществ чаще - процесс эндотермический (H>0); Ж и
Г веществ- экзотермический (H0). Энтропия при растворении твердых веществ, как
правило, увеличивается (S>0), а при растворении газов уменьшается (S0).
Факторы, влияющие на растворимость твердых веществ:
1. Природа растворителя и растворяемого вещества (природа связи).
«Подобное растворяется в подобном»
2. Температура. С ростом Т растворимость большинства твердых веществ увеличивается (H1>0 , принцип Ле Шателье)
Растворимость газов:
1. Природа веществ (Н2 в воде и
в палладии).
2. Температура (при росте Т растворимость уменьшается)
3. Давление. При постоянной температуре растворимость газа в жидкости прямо пропорциональна его давлению над жидкостью (закон Генри).
Закон обосновывает процесс экстракции. Отношение концентраций вещества, растворяющегося в двух соприкасающихся жидкостях, есть величина постоянная, независимая от количества растворенного вещества (закон распределения).
Слайд 8Растворы неэлектролитов
1.Первый закон Рауля Относительное понижение парциаль-ного давления пара
растворителя над раствором НЭ равно молярной доле растворенного вещества
2.Второй закон
Рауля
Повышение темпе-ратуры кипения или понижения темпера-туры отвердевания растворов НЭ пропорционально числу частиц растворенного вещества и не зависит от его природы
Слайд 93. Осмотическое давление
Осмос- явление селективного проникновения частиц определенного
вида через полупроницаемую перегородку. Осмотическое давление - давление, которое необходимо
приложить к раствору для прекращения осмоса, т.е. самопроизвольного перехода молекул растворителя от чистого растворителя в раствор.
Слайд 10 Закон Вант-Гоффа:
Осмотическое давление раствора численно равно тому давлению, которое производило бы
растворенное вещество, если бы оно при той же температуре находилось в газообразном состоянии и занимало объем, равный объему раствора.
Данные используются для определения относительной молекулярной массы растворенного вещества, численно равной его молярной массе.
Слайд 11Растворы электролитов
Основы теории электролитической диссоциации
Электролитическая диссоциация (ионизация) – распад растворенного вещества на ионы
под действием молекул растворителя.
Диссоциации подвергаются вещества с ионной и ковалентной полярной связью Вещества, распадающиеся на «+» заряженные ионы (катионы) и «–» заряженные ионы (анионы), называются электролитами (кислоты, основания и соли).
В растворе ионы гидратированы (сольватированы), т.е. окружены молекулами воды (растворителя). Природа данной связи для катионов – донорно-акцепторная, для анионов – водородная или электростатическая.
Слайд 12 С точки зрения диссоциации:
1. Кислоты - это
соединения, диссоциирующие в водных растворах с образованием положительных ионов
водорода (ионов гидроксония Н3О+):
НСl + H2O Н3О++ Сl-
2. Основания - соединения, образующие в водных растворах - гидроксид-ионы ОН-:
Са(ОН)2 Са2+ + 20Н-
3 Средние соли образуют катионы металлов или комплексные катионы и одноатомные либо многоатомные анионы:
(NH4)2SO4 2NH4+ + SO4 2-
NaCl Na+ + Cl-
Процесс диссоциации – процесс обратимый:
Диссоциация Ассоциация
Слайд 13Количественные характеристики
Константа диссоциации К
Для диссоциации слабого бинарного
электролита КА: KA = K+ + A-
на основании закона действующих масс :
K = С (K+) ·С(A-)/ С(KA)
Константу равновесия К в константой диссоциации данном случае называют (константа ионизации).
2. Степень диссоциации =Ci / Co
Сi - концентрация молекул, распавшихся на ионы;
С0 - общая концентрация растворенных молекул.
По степени диссоциации в растворах электролиты подразделяют на сильные (>30%) средние (3%30%) и слабые(3%).
Слайд 14В слабых электролитах К связана с соотношением: K
= С2 /(1- )
С - исходная молярная
концентрация электролита (закон разбавления Оствальда). Уравнение выражает зависимость степени диссоциации от концентрации раствора. Если 1, то =(K/С)
Иными словами: с уменьшением концентрации раствора степень диссоциации слабого электролита увеличивается.
Слайд 15Введение в раствор слабого электролита одноименных ионов уменьшает степень его
диссоциации. При уменьшении концентрации одного из ионов диссоциация слабого электролита
усиливается.
Уравнения справедливы для разбавленных растворов слабых электролитов и не выполняются для сильных электролитов.
Более точное описание диссоциации на основе использования значения активности:
K= а(К+)а(А-)/а(КА)
Слайд 16Константа диссоциации зависит от природы электролита и растворителя, а также
от температуры.
Константы диссоциации кислот НА Kк, оснований КОН Кo, а
также рKo (десятичный логарифм константы диссоциации, взятый с обратным знаком) кислот рKк, оснований pKo, соответственно равные,
Kк = С(Н+)С(А-)/С (НА) рKк = - lgKк,
Ko= С(К+)С(ОН-)/с(КОН) рKо = - lgKо
служат количественной мерой их силы.
Слайд 17Чем больше константа диссоциации данной кислоты или основания и меньше
их рК, тем они сильнее.
Ступенчатая диссоциация кислот и оснований. Кислые
и основные соли. Амфотерные электролиты.
Слабые многоосновные кислоты диссоциируют ступенчато, каждая ступень имеет свое значение константы диссоциации:
H2SO3 = H+ + HSO3- (1 ступень)
K1 = С(HSO3-)С(H+ )/С(H2SO3) = 2 10-2
HSO3- = H+ + SO32- (2 ступень)
K2 = С(SO32-)С(H+ )/С(HSO3-) = 6 10-8
Слайд 18Первый ион Н+ отрывается от молекулы легче, чем последующие, К1
>К2.
В связи со ступенчатой диссоциацией
- многоосновные кислоты способны образовывать
кислые соли:
NaHSO4 = Na+ + HSO4-
HSO4- = H+ + SO42-
- Слабые основания:
Fe(ОH)2 = FeOH+ + OH- (1 ступень)
K1 = С(FeOH+)С(OH- )/С(Fe(OH)2)
FeOH+ = Fe2+ + OH- (2 ступень)
K2 = С(Fe2+)С(OH- )/ С(FeOH+), K1 > K2
Этим объясняется их способность образовывать основные соли при диссоциации.
FeOHCl = FeOH+ + Cl-
FeOH+ = Fe2+ + OH-
Слайд 19 Амфотерные электролиты [Zn(OH)2 , Al(OH)3,
Cr(OH)3, Pb(OH)2] диссоциируют в водном растворе как кислоты и основания:
2OH-+[Zn(H2O)4]2+ =Zn(OH)2+nH2O = [Zn(OH)4]2- + 2H+
Сила кислородсодержащих кислот ЭОm,(ОН)n возрастает с увеличением т и практически не зависит от n.
Кислоты состава:
Э(ОН )n - слабые (первая ступень диссоциации),
ЭО(ОН)n - средней силы,
ЭО2(ОН)n и ЭО3(ОН)n- сильные.
Слайд 20 Такая же зависимость наблюдается в ряду гидроксидов переходных
металлов с переменной степенью окисления. С увеличением степени окисления элемента
основные свойства его гидроксидов ослабевают, кислотные - усиливаются: Мn(ОН)2 - основание средней силы, Мn(ОН)3 -слабое основание, Mn(OH)4 - амфотерное с некоторым преобладанием кислотных свойств, H2МnО4 и НМnО4 - сильные кислоты.
Слайд 21Диссоциация воды, водородный показатель
H2O = H ++ OH -
H=57,5 кДж/моль,
К = С(Н+)С(ОН-) /С (Н20)=1,810-16
Kw =
K С(Н20) = С(Н+) С(ОН-)
При 25 С К = 10-14 моль2/ л2
При увеличении температуры K возрастает. В любом водном растворе одновременно присутствуют Н+ и ОН-. Кислотность и щелочность среды характеризуют концентрацией Н+ или водородным показателем рН – отрицательным десятичным логарифмом концентрации водородных ионов: рH = -lgС(H+); рОH = -lgС(ОH-)
рH + рОH =14
Слайд 22Произведение растворимости (ПР)
Применение закона действующих масс к
гетерогенной системе -насыщенному раствору малорастворимого электролита, находящемуся в равновесии со
своим осадком:
KnAm = nKm+ + mAn-
дает выражение константы равновесия:
K= Сn (Km+)·Сm (An-), которая в данном случае называется произведением растворимости (ПР) :
ПР= cn (Km+ ) cm (An-)
Слайд 23В насыщенном растворе малорастворимого электролита произведение концентраций его ионов, возведенных
в степень с показателем, равным стехиометрическому коэффициенту при данном ионе,
при данной температуре - величина постоянная.
ПР характеризует сравнительную растворимость однотипных веществ. Условие образования осадка:
Сn (Km+ ) Сm (An-)> ПР(KnAm)
Раствор, в котором соблюдается это условие, - пересыщенный относительно данного электролита, из него будет выпадать осадок ( достигается введением одноименного иона в систему).
Условие растворения осадка:
Сn (Km+ ) Сm (An-) ПР(KnAm)
Раствор в данном случае - ненасыщенный, при введении в него кристаллов малорастворимого электролита они будут растворяться.
Слайд 24 В растворах электролитов число частиц больше, чем в
растворах неэлектролитов. Для учета этого во все законы вводится поправочный
коэффициент (i,изотонический коэффициент), который связан со степенью диссоциации.
Слайд 25Обменные реакции в растворах, гидролиз
Слайд 26 Необходимым условием протекания обменных реакций в растворах
электролитов - удаление из него тех или иных ионов:
- Образование
малодиссоциирующих соединений:
1) HCI + NaOH = NaCl + H2O
Н++ОН- Н2О
2) СН3СОONа + HCI СН3СООН + NаСI
СН3СОО- + Н+ СН3СООН
- Образование малорастворимых веществ:
1) NaCI + AgNO3 AgCI + NaNO3.
Cl- + Ag+ AgCI
- Образование газов
1) Na2S+2HCI 2NaCl + H2S
S2- + 2H+ H2S
Слайд 27Гидролиз солей
Обменная реакция между водой и соединением называется
его гидролизом.
Гидролиз солей - реакция, обратная
реакции нейтрализации слабых кислот (оснований) сильными основаниями (кислотами) или слабых кислот слабыми основаниями.
Слайд 28Типы гидролиза
Гидролиз по катиону
Подвергаются соли, образованные катионом слабого основания и
анионом сильной кислоты (NH4Br, ZnCl2, Cu(NO3)2 и др.).
Среда при гидролизе
кислая (рН<7), процесс обратимый
Молекулярное уравнение 1 ступени гидролиза СuСl2 + НОН CuOHCI + НСI.
Гидролизом по второй ступени при обычных условиях можно пренебречь.
Слайд 292. Гидролиз по аниону.
Подвергаются соли, образованные катионом сильного основания
и анионом слабой кислоты (К2СО3, Na2S, Na2SO3, К3РО4 и др.).
При гидролизе создается щелочная среда (рН>7). СН3СОONa + HOH СН3СООН +NaОН
CH3COO+ + НОН СН3СООН + OH-
Процесс обратимый, равновесие гидролиза сильно смещено влево.
Слайд 303. Гидролиз по катиону и аниону.
По катиону и аниону
гидролизуются соли, образованные катионом слабого основания и анионом слабой кислоты.
Молекулярное уравнение:
CuF2 + НОН CuOHF + HF
Cu2+ + 2F- +H2O CuOH+ + HF
рН=7, процесс необратимый
Слайд 31Количественные характеристики
Степенью h и константа гидролиза Кг :
h = Сг/Сo,
Сг - концентрация гидролизованной части соли, Сo- общая концентрация растворенной соли.
Для гидролиза по аниону в общем виде
А- + НОН = НА + ОН-
С(НА) С(ОН-) Кw С(Н2О)/С(А-)= Кг,
используя соотношение С(ОН-)=Кw/С(H+), можно получить Кг= Кw/КНА или Кг= Кw/Кк
Слайд 32 Гидролиз по катиону:
К+ + НОН =КОН + Н+ аналогично:
С(КОН) С(Н+) /С(К+)= Кг =Кw/Ко
Гидролиз по катиону и по аниону
:
К+ +А- + НОН =КОН + НА
С(КОН)С(НА) /С(К+)С(А-)= Кг =Кw/Ко Кк
Связь Кг и h описывается выражением, подобным закону Оствальда:
Кг=Сh2 , h =(Кг/С)1/2
Слайд 33Современные представления о природе кислот и оснований
Протонная теория (Бренстед, Лоури)
Кислота
- донор протона,
СН3СООН СН3СОО- +Н+
Кислота
сопряженное основание
Основание – акцептор протона.
ОН-+Н+ Н2О
Основание сопряженная кислота
Электронная теория (Льюис)
Кислота - акцептор электронных пар
Основание – донор электронных пар
HCl + NH3 = NH4Cl
кислота основание продукт
Ag+ + 2NH3 = [Ag(NH3)2]+


















![РАСТВОРЫ Амфотерные электролиты [Zn(OH)2 , Al(OH)3, Cr(OH)3, Pb(OH)2] диссоциируют Амфотерные электролиты [Zn(OH)2 , Al(OH)3, Cr(OH)3, Pb(OH)2] диссоциируют в водном растворе как](/img/thumbs/e2a8c998927e351ec2a3dec384799835-800x.jpg)