Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Регуляция активности генов
Содержание
- 1. Регуляция активности генов
- 2. Стадии транскрипции. Структура и функция бактериальной РНК-полимеразы.
- 3. Транскрипция – синтез РНК на ДНК, то
- 4. РНК-полимераза — фермент, осуществляющий синтез молекул РНК.
- 5. Сопряжение транскрипции и трансляции у прокариотРНК-полимераза в процессе транскрипцииРНК-полимераза
- 6. У бактерий РНК-полимераза катализирует синтез трех типов
- 7. Бактериальная РНК-полимераза состоит из нескольких белковых-субъединиц: двух
- 8. Структура РНК-полимеразы
- 9. Структура РНК-полимеразы
- 10. За десять нуклеотидов до точки инициации находится
- 11. Участки промотора генов, связанных со стадией роста
- 12. 1 этап: термодинамически регулируемое узнавание и связывание
- 13. РНК наращивается на 3΄-конце. Присоединением каждого нуклеотида
- 14. После того, как σ-фактор диссоциирует с элонгирующей
- 15. Терминация транскрипции РНК может быть ρ-независимой либо
- 16. Оперон, группа функционально связанных между собой генов,
- 17. Для регуляции транскрипции используются как стадии инициации,
- 18. Фактор транскрипции: взаимодействие с РНК-полимеразойрепрессорыактиваторыЛиганд (кофактор):способствует/препятствует связыванию
- 19. Структурные гены кодируют три фермента, необходимые для
- 20. Предположим, что первоначально в клетке имеется только
- 21. Лактозный оперон
- 22. Триптофановый оперон
- 23. Транскрипция триптофанового оперона E. coli должна происходить
- 24. Наконец, самый простой способ стабилизировать одну из
- 25. Кроме стадии инициации, транскрипция может регулироваться также
- 26. Лучше всего процесс антитерминации изучен для бактериофага
- 27. Арабинозный оперон
- 28. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Регуляция активности генов
Лекция №3
Для студентов специальности «Микробиология»
по дисциплине «Генетика
микроорганизмов»
Слайд 2Стадии транскрипции.
Структура и функция бактериальной РНК-полимеразы.
Сайты инициации транскрипции
у бактерий.
Структура промоторов.
Механизмы узнавания промотора РНК-полимеразой.
Использование альтернативных
σ-факторов (на примере спорообразования у Bacillus subtilis). Терминация транскрипции.
Механизмы антитерминации.
Регуляция экспрессии генов на уровне транскрипции.
Классическая схема оперона по Жакобу и Моно.
Индукция и репрессия синтеза ферментов на примере лактозного оперона.
Катаболитная репрессия как пример позитивной регуляции транскрипции.
Явление аттенуации (на модели триптофанового оперона).
Организация регуляторной области арабинозного оперона.
"Строгий" контроль регуляции генной активности при аминокислотном голодании.
Системы регуляции транскрипции, определяемые ауторегуляторными факторами.
Механизм «эффекта кворума» у бактерий.
План лекции:
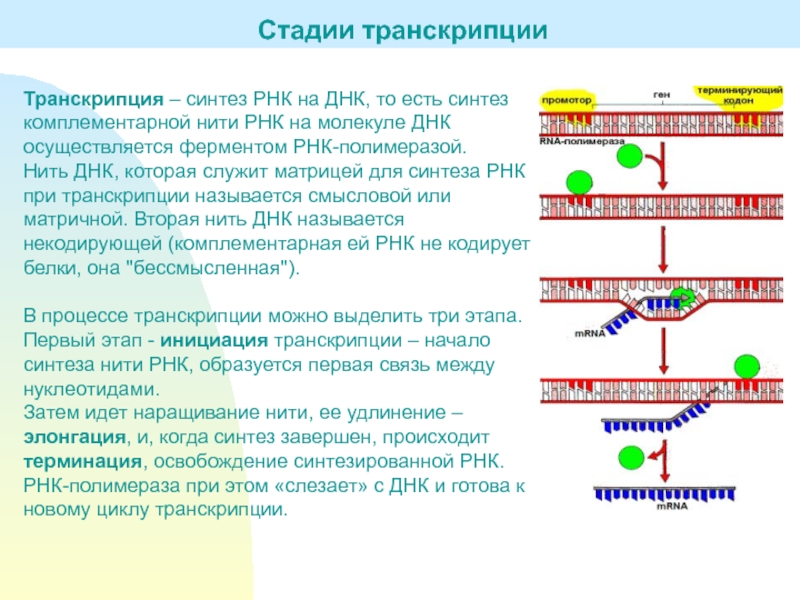
Слайд 3Транскрипция – синтез РНК на ДНК, то есть синтез комплементарной
нити РНК на молекуле ДНК осуществляется ферментом РНК-полимеразой.
Нить ДНК,
которая служит матрицей для синтеза РНК при транскрипции называется смысловой или матричной. Вторая нить ДНК называется некодирующей (комплементарная ей РНК не кодирует белки, она "бессмысленная").В процессе транскрипции можно выделить три этапа.
Первый этап - инициация транскрипции – начало синтеза нити РНК, образуется первая связь между нуклеотидами.
Затем идет наращивание нити, ее удлинение – элонгация, и, когда синтез завершен, происходит терминация, освобождение синтезированной РНК. РНК-полимераза при этом «слезает» с ДНК и готова к новому циклу транскрипции.
Стадии транскрипции
Слайд 4РНК-полимераза — фермент, осуществляющий синтез молекул РНК.
В широком смысле,
РНК-полимеразой обычно назвают ДНК-зависимые РНК-полимеразы. Химически РНК-полимеразы являются нуклеотидил-трансферазами, полимеризующими
рибонуклеотиды на 3'-конце цепи РНК.РНК-полимераза
История изучения
РНК-полимераза была открыта независимо Сэмом Вайссом и Джерардом Хурвицем в 1960. К этому моменту Нобелевская премия по медицине в 1959 году уже была присуждена Северо Охоа и Артуру Корнбергу за открытие вещества, которое считали РНК-полимеразой, впоследствии оказавшегося рибонуклеазой.
Нобелевская премия по химии в 2006 году была присуждена Роджеру Корнбергу за получение точных изображений молекул РНК-полимеразы в различные моменты процесса транскрипции.
Слайд 5Сопряжение транскрипции и трансляции у прокариот
РНК-полимераза в процессе транскрипции
РНК-полимераза
Слайд 6У бактерий РНК-полимераза катализирует синтез трех типов РНК: мРНК, рРНК
и тРНК.
РНК-полимераза — достаточно большая молекула. Основной фермент содержит 5
субъединиц (~400 кДа):α2: две α-субъединицы связывают остальные элементы фермента и распознают регулирующие факторы. Каждая субъединица состоит из двух доменов: αCКД (С-концевой домен) связывает первый элемент промотора, и αNКД (N-концевой домен) связывается с остальными компонентами полимеразы.
β: эта субъединица обладает собственно полимеразным действием, катализируя синтез РНК. Она осуществляет инициацию процесса и управляет элонгацией.
β': неспецифически связывается с ДНК.
ω: восстанавливает денатурированную РНК-полимеразу обратно в дееспособную форму in vitro. Также обнаружено ее защитное действие на β'-субъединицу.
Для связывания с промоторными областями ДНК, основной фермент нуждается в еще одной субъединице — сигма (σ). Сигма-фактор значительно снижает сродство РНК-полимеразы к неспецифичным областям ДНК, и в то же время повышает ее чувствительность к определенным промоторам, в зависимости от своей структуры. С его помощью транскрипция начинается с нужного участка ДНК.
Полный фермент таким образом состоит из 6 субъединиц: α2ββ'σω (~480 кДа). В структуре РНК-полимеразы присутствует канавка длиной 55 Å (5,5 нм) и шириной 25 Å (2,5 нм). Именно в эту канавку помещается двойная спираль ДНК, имеющая ширину 20 Å (2 нм). На длине канавки укладывается 16 нуклеотидов.
Распределение зарядов на поверхности РНК-полимеразы обеспечивает ее функции. Распределение очень логично. Молекула нуклеиновой кислоты заряжена отрицательно. Поэтому полость главного канала, где должна удерживаться отрицательно заряженная ДНК, выложена положительными зарядами. Поверхность РНК-полимеразы выполнена отрицательно заряженными аминокислотами, чтобы ДНК к ней не прилипала.
Молекулы РНК-полимеразы не растворены в цитоплазме. Когда РНК-полимераза не используется, она связывается с неспецифичными областями ДНК в ожидании открытия активного промотора.
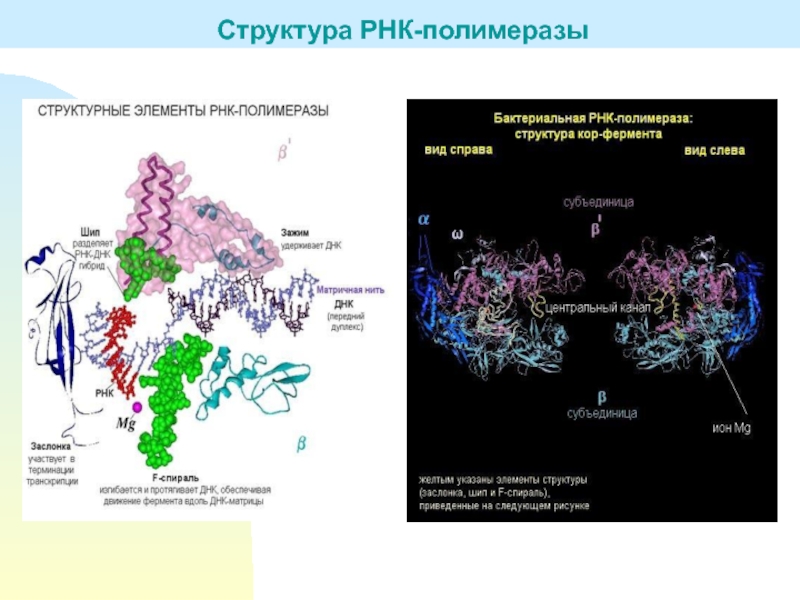
Структура РНК-полимеразы
Слайд 7Бактериальная РНК-полимераза состоит из нескольких белковых-субъединиц: двух α-субъединиц (это маленькие
субъединицы), β- и β΄-субъединиц (большие субъединицы) и ω-субъединицы. Вместе они
образуют так называемый минимальный фермент, или кор-фермент.К этому кор-ферменту может присоединяться σ-субъединица. σ-субъединица необходима для начала синтеза РНК, для инициации транскрипции. После того, как инициация осуществилась, σ-субъединица отсоединяется от комплекса, и дальнейшую работу (элонгацию цепи) ведет кор-фермент. При присоединении к ДНК σ-субъединица распознает участок, на котором должна начинаться транскрипция. Он называется промотор.
Промотор - это последовательность нуклеотидов, указывающих на начало синтеза РНК. Без σ-субъединицы кор-фермент промотор распознать не может. σ-субъединица вместе с кор-ферментом называется полным ферментом, или холоферментом.
Связавшись с ДНК, а именно с промотором, который распознала σ-субъединица, холофермент расплетает двунитевую спираль и начинает синтез РНК. Участок расплетенной ДНК – это точка инициации транскрипции, первый нуклеотид, к которому должен комплементарно быть присоединен рибонуклеотид. Инициируется транскрипция, σ-субъединица уходит, а кор-фермент продолжает элонгацию цепи РНК. Затем происходит терминация, кор-фермент освобождается и становится готов к новому циклу синтеза.
Структура РНК-полимеразы
Слайд 10За десять нуклеотидов до точки инициации находится ТАТА-бокс. Не обязательно
стоит именно такая последовательность, но она является "идеальной" последовательностью для
взаимодействия с σ-субъединицей, то есть такой, с которой транскрипция инициируется наиболее эффективно. Еще примерно за 35 нуклеотидов до него находится структура, называемая «-35». Эту последовательность также распознает σ-субъединица. Эту структуру (сочетание последовательностей "–10" и "–35") назвали классическим промотором, т.к. она была описана первой.Но оказалось, что устройство промотора может быть и другим. Этот вариант включает в себя тот же ТАТА-бокс, но нет последовательности «-35», однако есть дополнительно два нуклеотида, и этого достаточно, чтобы σ-субъединица распознала промотор. Эта структура называется расширенным промотором.
σ-субъединица РНК-полимеразы садится на промотор в ДНК и разными частями белковой молекулы взаимодействует с частями промотора. Распознает его σ-субъединица через большую бороздку ДНК. После того, как σ-субъединица в составе кор-фермента связалась с промотором, ДНК на этом участке начинает плавиться (расплетаются нити ДНК). Промотор содержит пары А-Т, поэтому плавится он достаточно легко. И затем начинается синтез РНК, растущая цепь РНК выталкивает σ-субъединицу и происходят еще другие изменения, которые вызывают диссоциацию σ-субъединицы от кор-фермента.
Структура промоторов. Инициация
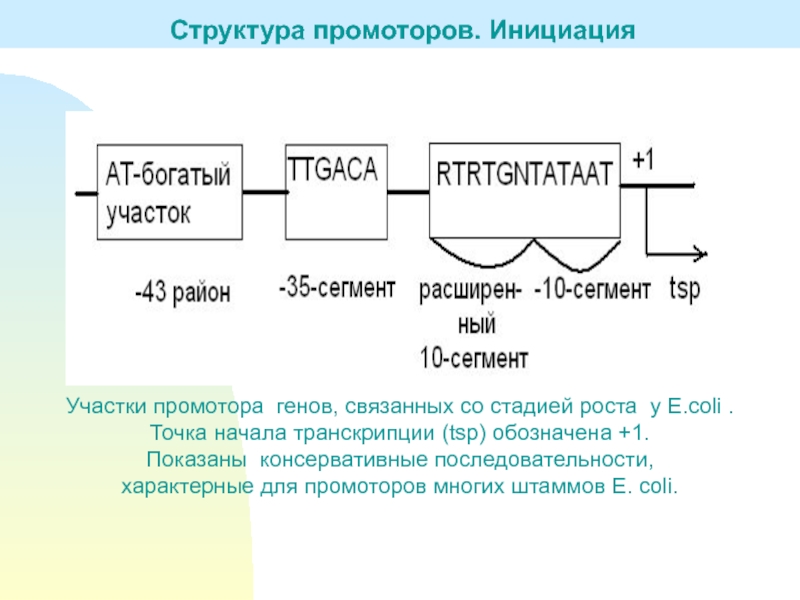
Слайд 11Участки промотора генов, связанных со стадией роста у E.coli .
Точка
начала транскрипции (tsp) обозначена +1.
Показаны консервативные последовательности,
характерные для
промоторов многих штаммов E. coli.Структура промоторов. Инициация
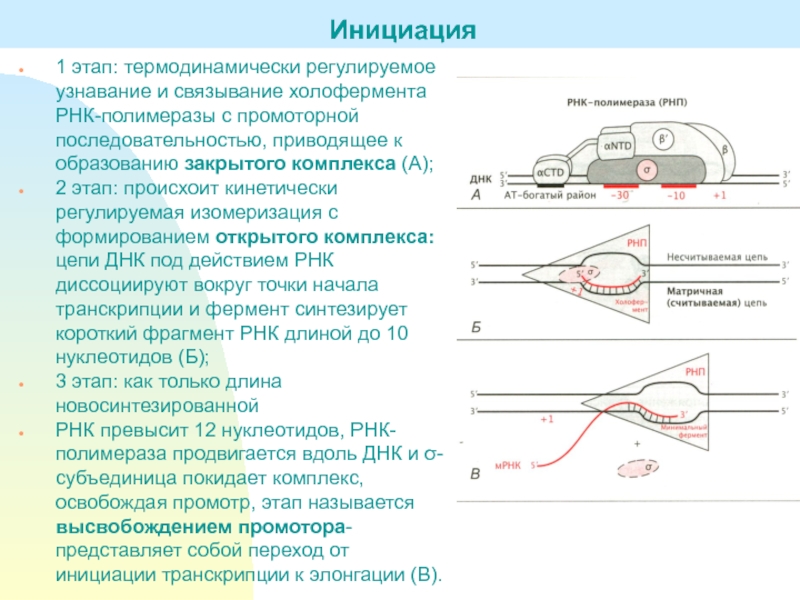
Слайд 121 этап: термодинамически регулируемое узнавание и связывание холофермента РНК-полимеразы с
промоторной последовательностью, приводящее к образованию закрытого комплекса (А);
2 этап: происхоит
кинетически регулируемая изомеризация с формированием открытого комплекса: цепи ДНК под действием РНК диссоциируют вокруг точки начала транскрипции и фермент синтезирует короткий фрагмент РНК длиной до 10 нуклеотидов (Б);3 этап: как только длина новосинтезированной
РНК превысит 12 нуклеотидов, РНК-полимераза продвигается вдоль ДНК и σ-субъединица покидает комплекс, освобождая промотр, этап называется высвобождением промотора- представляет собой переход от инициации транскрипции к элонгации (В).
Инициация
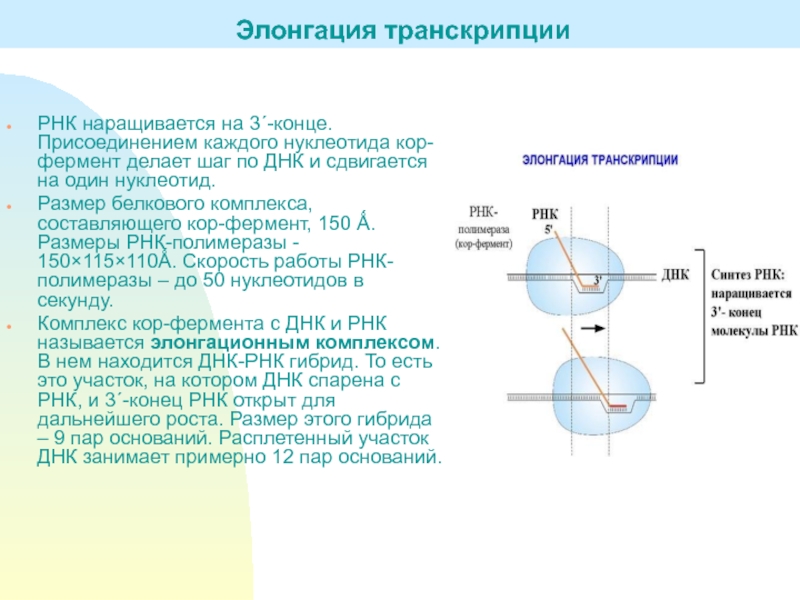
Слайд 13РНК наращивается на 3΄-конце. Присоединением каждого нуклеотида кор-фермент делает шаг
по ДНК и сдвигается на один нуклеотид.
Размер белкового комплекса,
составляющего кор-фермент, 150 Ǻ. Размеры РНК-полимеразы - 150×115×110Ǻ. Скорость работы РНК-полимеразы – до 50 нуклеотидов в секунду. Комплекс кор-фермента с ДНК и РНК называется элонгационным комплексом. В нем находится ДНК-РНК гибрид. То есть это участок, на котором ДНК спарена с РНК, и 3΄-конец РНК открыт для дальнейшего роста. Размер этого гибрида – 9 пар оснований. Расплетенный участок ДНК занимает примерно 12 пар оснований.
Элонгация транскрипции
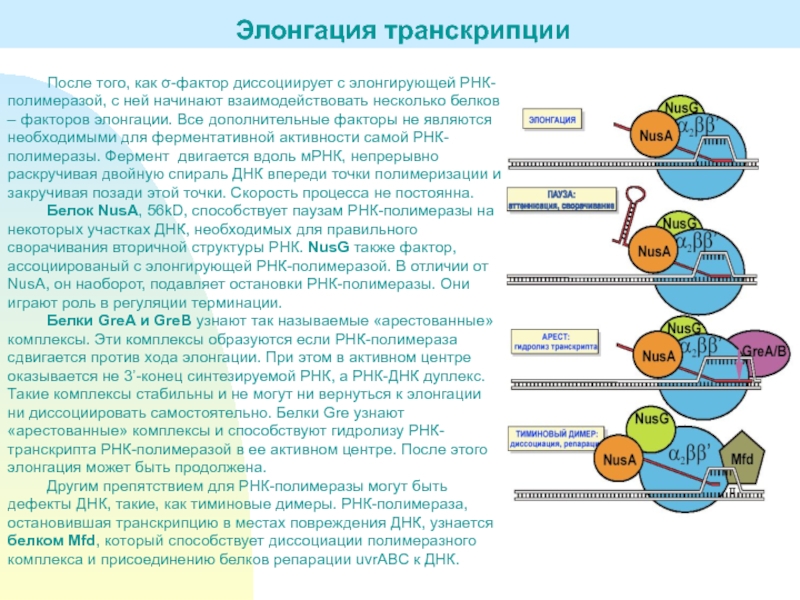
Слайд 14После того, как σ-фактор диссоциирует с элонгирующей РНК-полимеразой, с ней
начинают взаимодействовать несколько белков – факторов элонгации. Все дополнительные факторы
не являются необходимыми для ферментативной активности самой РНК-полимеразы. Фермент двигается вдоль мРНК, непрерывно раскручивая двойную спираль ДНК впереди точки полимеризации и закручивая позади этой точки. Скорость процесса не постоянна.Белок NusA, 56kD, способствует паузам РНК-полимеразы на некоторых участках ДНК, необходимых для правильного сворачивания вторичной структуры РНК. NusG также фактор, ассоциированый с элонгирующей РНК-полимеразой. В отличии от NusA, он наоборот, подавляет остановки РНК-полимеразы. Они играют роль в регуляции терминации.
Белки GreA и GreB узнают так называемые «арестованные» комплексы. Эти комплексы образуются если РНК-полимераза сдвигается против хода элонгации. При этом в активном центре оказывается не 3’-конец синтезируемой РНК, а РНК-ДНК дуплекс. Такие комплексы стабильны и не могут ни вернуться к элонгации ни диссоциировать самостоятельно. Белки Gre узнают «арестованные» комплексы и способствуют гидролизу РНК-транскрипта РНК-полимеразой в ее активном центре. После этого элонгация может быть продолжена.
Другим препятствием для РНК-полимеразы могут быть дефекты ДНК, такие, как тиминовые димеры. РНК-полимераза, остановившая транскрипцию в местах повреждения ДНК, узнается белком Mfd, который способствует диссоциации полимеразного комплекса и присоединению белков репарации uvrABC к ДНК.
Элонгация транскрипции
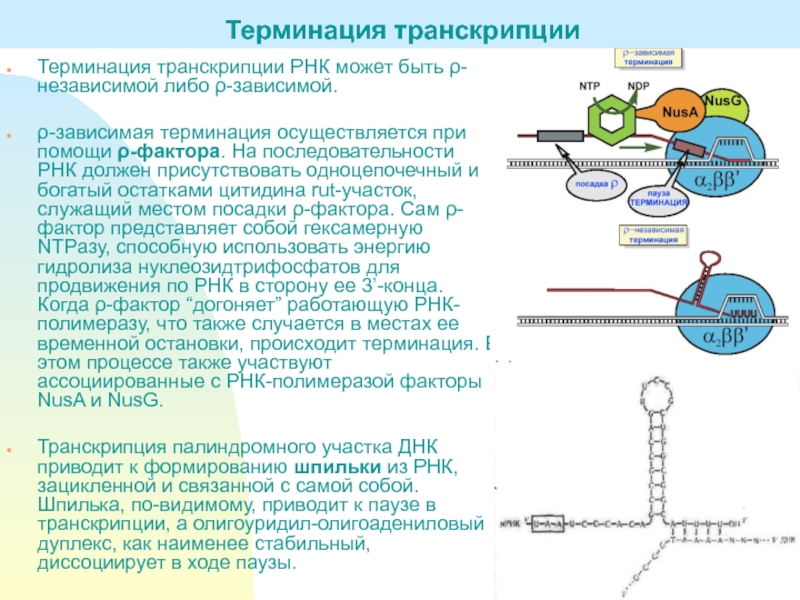
Слайд 15Терминация транскрипции РНК может быть ρ-независимой либо ρ-зависимой.
ρ-зависимая терминация осуществляется
при помощи ρ-фактора. На последовательности РНК должен присутствовать одноцепочечный и
богатый остатками цитидина rut-участок, служащий местом посадки ρ-фактора. Сам ρ-фактор представляет собой гексамерную NTPазу, способную использовать энергию гидролиза нуклеозидтрифосфатов для продвижения по РНК в сторону ее 3’-конца. Когда ρ-фактор “догоняет” работающую РНК-полимеразу, что также случается в местах ее временной остановки, происходит терминация. В этом процессе также участвуют ассоциированные с РНК-полимеразой факторы NusA и NusG.Транскрипция палиндромного участка ДНК приводит к формированию шпильки из РНК, зацикленной и связанной с самой собой. Шпилька, по-видимому, приводит к паузе в транскрипции, а олигоуридил-олигоадениловый дуплекс, как наименее стабильный, диссоциирует в ходе паузы.
Терминация транскрипции
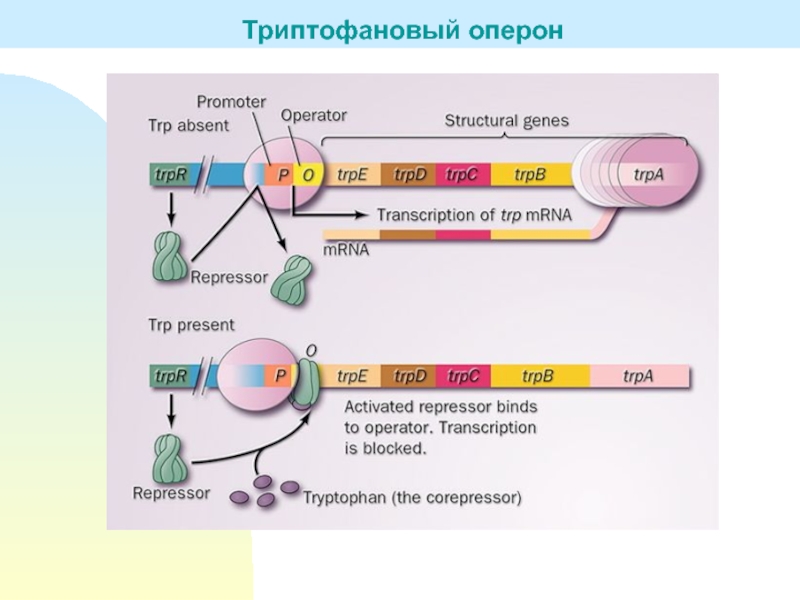
Слайд 16Оперон, группа функционально связанных между собой генов, детерминирующих синтез белков-ферментов,
относящихся к последовательным этапам какого-либо биохимического процесса.
Концепция оперона как
часть теории генетической организации и регуляции выдвинута в 1961 французским учёными Ф. Жакобом и Ж. Моно на основе экспериментальных работ по синтезу индуцируемых ферментов у мутантов кишечной палочки. Регуляторная функция оперона осуществляется на стадии транскрипции.В начале оперона обычно локализован промотор — инициирующий транскрипцию участок ДНК, с которым специфически связывается фермент РНК-полимераза, осуществляющая транскрипцию оперона. За промотором расположен оператор — участок ДНК, с которым взаимодействует регуляторный белок — репрессор. Остальную часть оперона составляют структурные гены, содержащие информацию о последовательности аминокислот в полипептидных цепях белков. Репрессоры синтезируются под контролем генов-регуляторов, необязательно входящих в данный оперон. Взаимодействуя с оператором, репрессор влияет на скорость транскрипции структурных генов. Репрессор, с одной стороны, способен «узнавать» последовательность оснований ДНК оператора, с другой — взаимодействовать с низкомолекулярными веществами — эффекторами, являющимися чаще всего субстратами или продуктами действия ферментов, определяемых данным опероном. Эффекторы резко меняют сродство репрессора к оператору; некоторые его снижают, другие повышают.
Когда репрессор связан с оператором, он препятствует движению РНК-полимеразы вдоль оперона, и синтез м-РНК тормозится, «выключается». Отделение репрессора от оператора приводит к «включению» оперона. Т. о., оператор определяет активность оперона в целом. Описанная регуляция называется негативной, или отрицательной.
Существует и позитивная, или положительная, регуляция, осуществляемая белком-активатором, который, присоединяясь к начальной части оперона (перед промотором), активирует транскрипцию оперона. Конец оперона — последовательность нуклеотидов, с которыми связан специфический белок — т.н. терминатор, прерывающий синтез РНК.
Схема оперона
Слайд 17Для регуляции транскрипции используются как стадии инициации, так и элонгации/терминации.
Замена основного фактора инициации используется в случае, когда необходимо
существенно изменить спектр белков, синтезируемых в клетке. Для более тонкой регуляции используются регуляторные ДНК связывающие белки активаторы и ингибиторы. ДНК-связывающая способность этих белков определяется связыванием лигандов или ковалентной модификацией.
На стадии элонгации и терминации регуляция может осуществляться с помощью аттенюации, когда мРНК может иметь альтернативные вторичные структуры, одна из которых способствует терминации. Относительная стабилизация какой-либо из вторичных структур определяется либо скоростью транскрипции, либо скоростью трансляции, либо связыванием белка.
Антитерминация, или подавление активности некоторых терминаторов может происходить с помощью регуляторных антитерминирующих белков.
Регуляция активности генов
Слайд 18Фактор транскрипции: взаимодействие с РНК-полимеразой
репрессоры
активаторы
Лиганд (кофактор):
способствует/препятствует связыванию с ДНК
триптофановый репрессор
биосинтез триптофана
связан с ДНК при наличии триптофана
лактозный репрессор
использование лактозы
связан
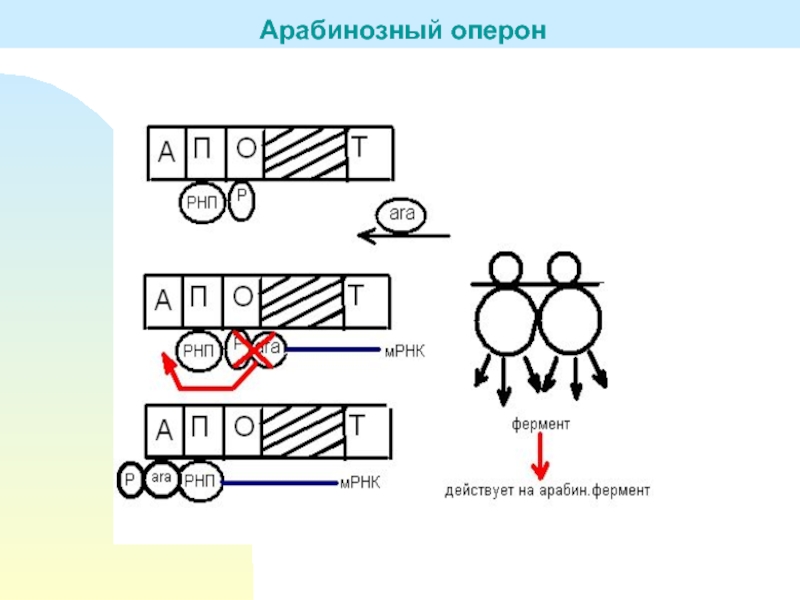
с ДНК при отсутствии лактозыарабинозный активатор
использование арабинозы
связан с ДНК при наличии арабинозы
Регуляция активности генов
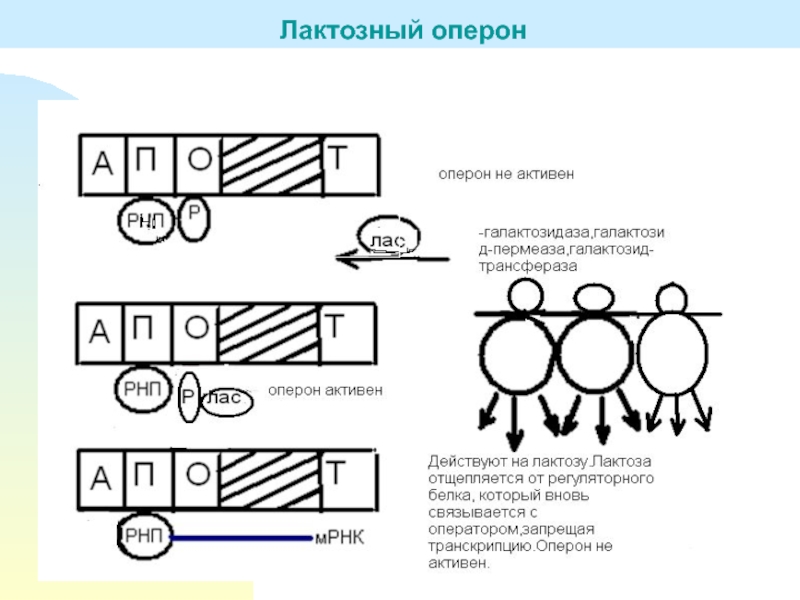
Слайд 19Структурные гены кодируют три фермента, необходимые для расщепления лактозы (молочного
сахара) на глюкозу и галактозу. Молочный сахар лактоза – менее
ценный продукт питания, чем глюкоза, поэтому в присутствии глюкозы сбраживание лактозы является невыгодным для бактерии процессом. Однако при отсутствии глюкозы бактерия вынуждена переходить на питание лактозой, для чего синтезирует соответствующие ферменты Z, Y, А.Терминатор служит для отсоединения РНК-полимеразы после окончания синтеза иРНК, соответствующей ферментам Z, Y, А, необходимым для усвоения лактозы.
Для регуляции работы оперона необходимы еще два гена: ген, кодирующий белок–репрессор, и ген, кодирующий белок СYА. Белок СYА катализирует образование цАМФ из АТФ. Если в клетке имеется глюкоза, то белок СYА вступает с ней в реакцию и переходит в неактивную форму. Таким образом, глюкоза блокирует синтез цАМФ и делает невозможным присоединение РНК-полимеразы к промотору. Итак, глюкоза является репрессором.
Если же в клетке имеется лактоза, то она взаимодействует с белком–репрессором и превращает его в неактивную форму. Белок–репрессор, связанный с лактозой, не может присоединиться к оператору и не преграждает путь РНК-полимеразе. Итак, лактоза является индуктором.
Лактозный оперон
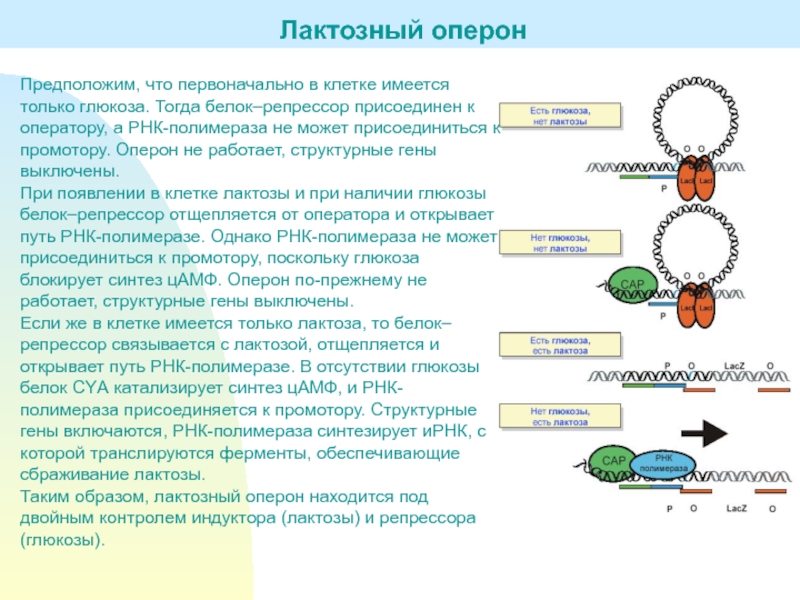
Слайд 20Предположим, что первоначально в клетке имеется только глюкоза. Тогда белок–репрессор
присоединен к оператору, а РНК-полимераза не может присоединиться к промотору.
Оперон не работает, структурные гены выключены.При появлении в клетке лактозы и при наличии глюкозы белок–репрессор отщепляется от оператора и открывает путь РНК-полимеразе. Однако РНК-полимераза не может присоединиться к промотору, поскольку глюкоза блокирует синтез цАМФ. Оперон по-прежнему не работает, структурные гены выключены.
Если же в клетке имеется только лактоза, то белок–репрессор связывается с лактозой, отщепляется и открывает путь РНК-полимеразе. В отсутствии глюкозы белок СYА катализирует синтез цАМФ, и РНК-полимераза присоединяется к промотору. Структурные гены включаются, РНК-полимераза синтезирует иРНК, с которой транслируются ферменты, обеспечивающие сбраживание лактозы.
Таким образом, лактозный оперон находится под двойным контролем индуктора (лактозы) и репрессора (глюкозы).
Лактозный оперон
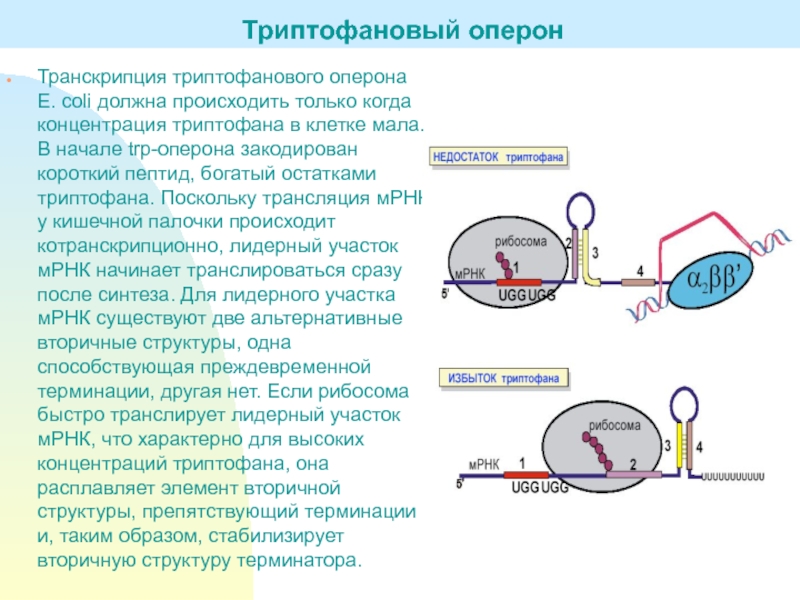
Слайд 23Транскрипция триптофанового оперона E. coli должна происходить только когда концентрация
триптофана в клетке мала. В начале trp-оперона закодирован короткий пептид,
богатый остатками триптофана. Поскольку трансляция мРНК у кишечной палочки происходит котранскрипционно, лидерный участок мРНК начинает транслироваться сразу после синтеза. Для лидерного участка мРНК существуют две альтернативные вторичные структуры, одна способствующая преждевременной терминации, другая нет. Если рибосома быстро транслирует лидерный участок мРНК, что характерно для высоких концентраций триптофана, она расплавляет элемент вторичной структуры, препятствующий терминации и, таким образом, стабилизирует вторичную структуру терминатора.Триптофановый оперон
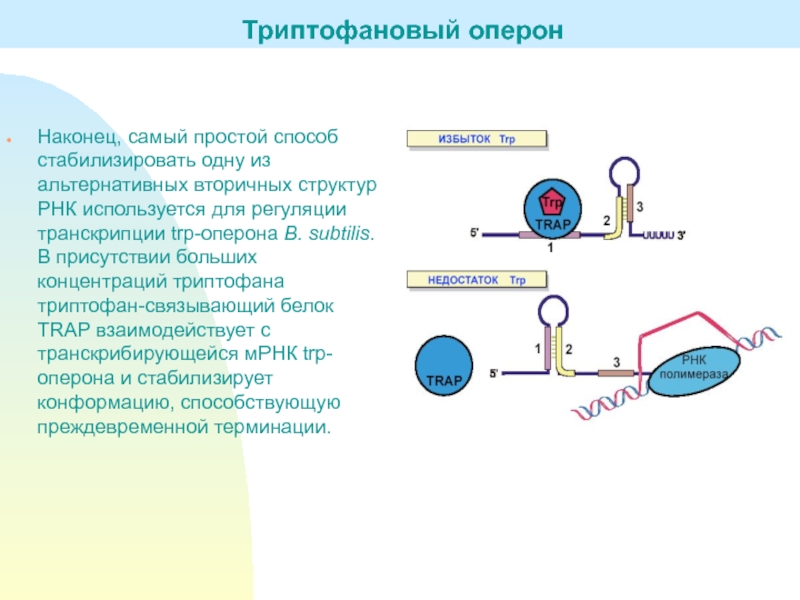
Слайд 24Наконец, самый простой способ стабилизировать одну из альтернативных вторичных структур
РНК используется для регуляции транскрипции trp-оперона B. subtilis. В присутствии
больших концентраций триптофана триптофан-связывающий белок TRAP взаимодействует с транскрибирующейся мРНК trp-оперона и стабилизирует конформацию, способствующую преждевременной терминации.Триптофановый оперон
Слайд 25Кроме стадии инициации, транскрипция может регулироваться также с помощью преждевременной
терминации, т.е. в зависимости от нужд клетки должен осуществляться выбор
между элонгацией и терминацией. Наиболее простой способ остановить транскрипцию – связать белок-регулятор на пути РНК-полимеразы. Два механизма регулируемой терминации это антитерминация и аттенюация.Аттенюация – это регулируемая терминация зависящая от относительной стабилизации альтернативных вторичных структур транскрибируемой мРНК. Как известно, ρ-независимый терминатор представляет собой РНК шпильку и последующий олигоуридиловый участок. Если будет стабилизирована альтернативная вторичная структура, где олигоуридиловый фрагмент удален от ближайшей шпильки, терминация не будет происходить.
Аттенюация
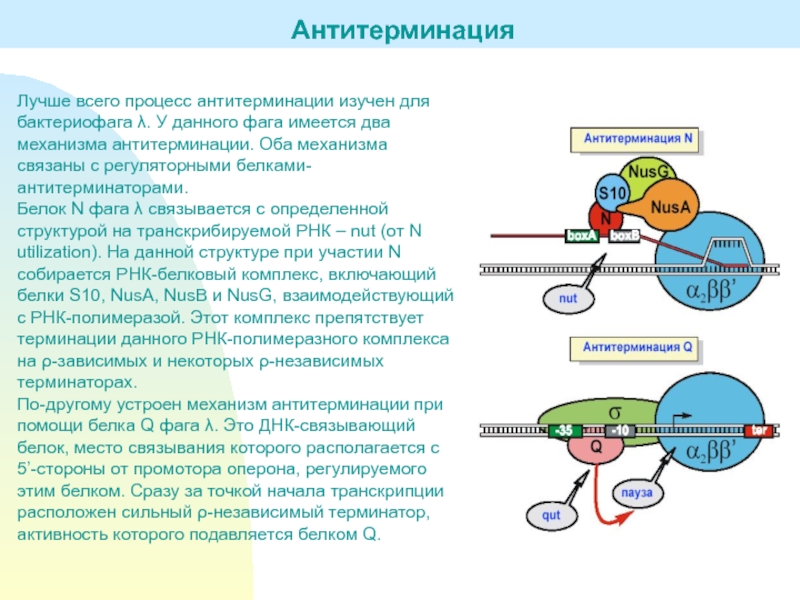
Слайд 26Лучше всего процесс антитерминации изучен для бактериофага . У данного
фага имеется два механизма антитерминации. Оба механизма связаны с регуляторными
белками-антитерминаторами.Белок N фага связывается с определенной структурой на транскрибируемой РНК – nut (от N utilization). На данной структуре при участии N собирается РНК-белковый комплекс, включающий белки S10, NusA, NusB и NusG, взаимодействующий с РНК-полимеразой. Этот комплекс препятствует терминации данного РНК-полимеразного комплекса на -зависимых и некоторых -независимых терминаторах.
По-другому устроен механизм антитерминации при помощи белка Q фага . Это ДНК-связывающий белок, место связывания которого располагается с 5’-стороны от промотора оперона, регулируемого этим белком. Сразу за точкой начала транскрипции расположен сильный -независимый терминатор, активность которого подавляется белком Q.
Антитерминация