, якщо є водний розчин аміаку і NH4Cl, утворює білий
кристалічний осад MgNH4PO4 6H2O: Mg2+ + HPO42– + NH3 + 6H2O = MgNH4PO4 6H2O
Сіль амонію додають для того, щоб не випав осад Mg(OH)2. Реакції заважають іони Ba2+, Ca2+ та інших важких металів.
Характерні реакції іонів Ва2+ :
Калій хромат або біхромат утворюють з іонами Ва2+ жовтий кристалічний осад Барій хромату, нерозчинний в ацетатній кислоті, але розчинний у мінеральних кислотах: Ва2+ + CrО42– = ВаCrО4
Амоній карбонат осаджує з нейтральних або лужних розчинів солей Барію білий аморфний осад BaCO3, який під час нагрівання переходить у кристалічний: Ba2+ + CO32– = BaCО3
Барій карбонат розчиняється в ацетатній та мінеральних (крім H2SO4) кислотах.
Сульфатна кислота (розведена) і розчинні сульфати (фармакопейна реакція за ДФУ ) осаджують з розчинів солей Барію білий дрібнокристалічний осад BaSO4: Ba2+ + SO42– = BaSO4
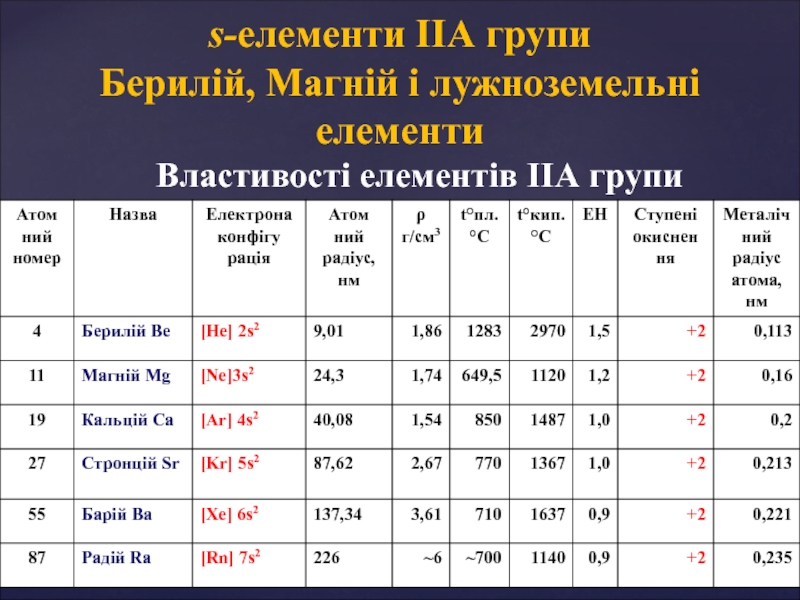
s-елементи ІІА групи












![s- елементи ІІА групи
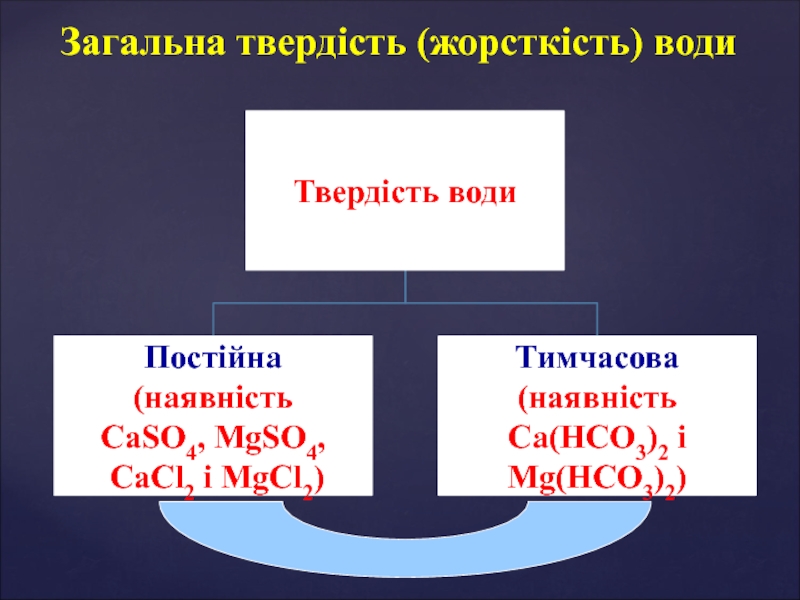
Берилій, Магній і лужноземельні елементи Розрахунок твердості водиТвердість води відображає вміст йонів Мg2+ та Ca2+[T] = Розрахунок твердості водиТвердість води відображає вміст йонів Мg2+ та Ca2+[T] = ммоль·екв/л- 1 ммоль⋅екв кальцієвої твердості дорівнює](/img/thumbs/b6a1abe90d75ee7601cc980d2ac04b4f-800x.jpg)

















![s- елементи ІІА групи
Берилій, Магній і лужноземельні елементи При нагріванні відповідних гідратів відбувається гідроліз:[Al(H2O)6]Cl3 Al(OH)3 + 3HCl + При нагріванні відповідних гідратів відбувається гідроліз:[Al(H2O)6]Cl3 Al(OH)3 + 3HCl + 3H2Oз поступовим перетворенням Al(ОН)3 в Al2О3.Солі](/img/thumbs/826bd69c05897fa29a1dcbbfc7699d32-800x.jpg)