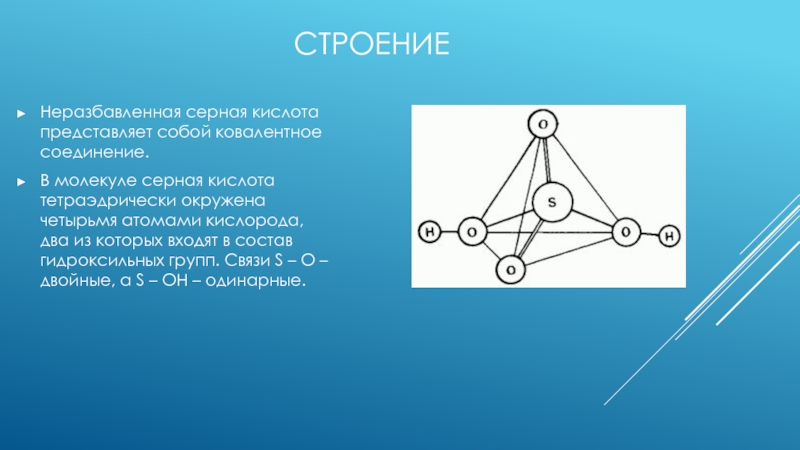
реагентов, известных человеку, особенно в концентрированном виде. Химически серная кислота
представляет собой тяжелую токсичную жидкость маслянистой консистенции, не имеющую запаха и цвета. При приготовлении водного раствора серной кислоты, необходимо помнить – кислоту добавляют в воду, а не воду в кислоту!Серная кислота является двухосновной (в состав кислоты входит два атома водорода, способных заместиться на металл).
Все химические связи являются ковалентными полярными. Сера в серной кислоте проявляет: максимальную валентность VI, степень окисления +6.