Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Щелочные металлы
Содержание
- 1. Щелочные металлы
- 2. Щелочны́е мета́ллы — элементы главной подгруппы первой
- 3. Мягкий металл серебристо-белого цветаСеребристо-белый мягкий металлNaLiСеребристо-белый мягкий
- 4. Эти металлы получили название щелочных, потому что
- 5. История открытия металловВ 1807 г. в Англии
- 6. Нахождение в природе Как очень активные
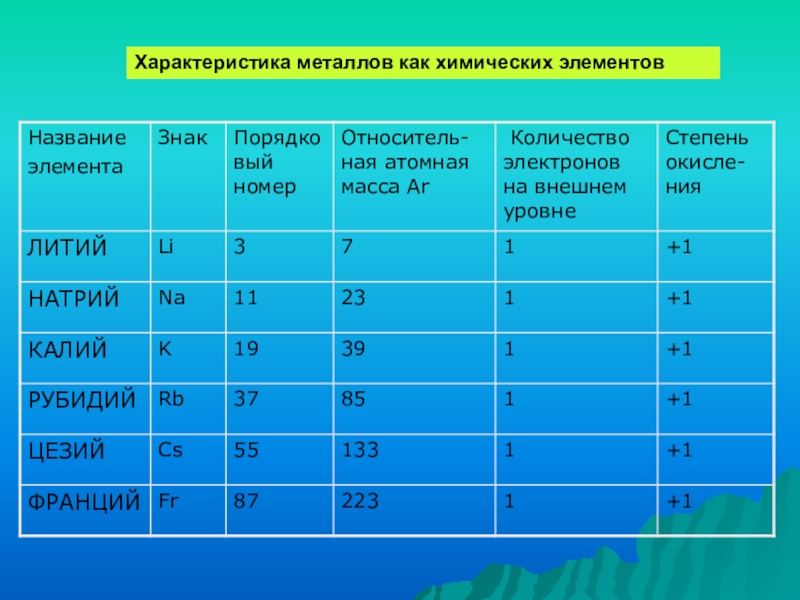
- 7. Характеристика металлов как химических элементов
- 8. Изменение свойств в группеВ ряду щелочных металлов:
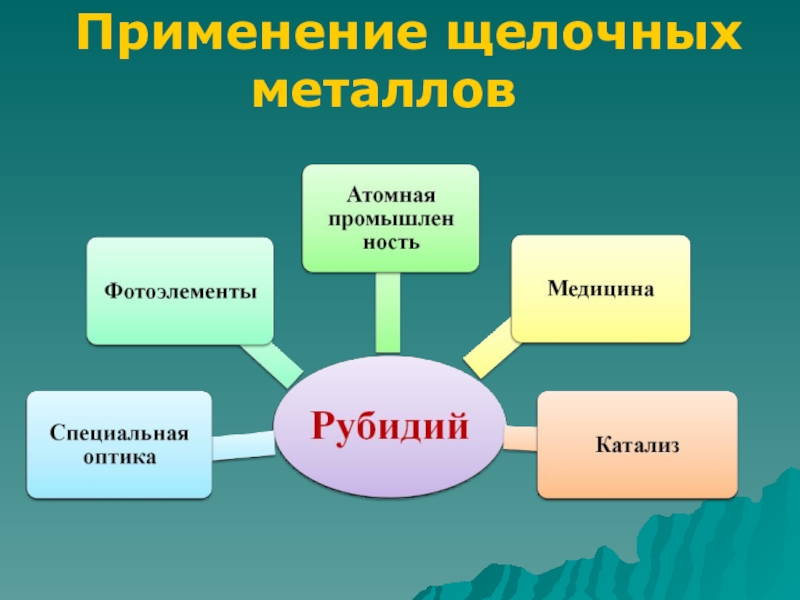
- 9. Применение щелочных металловДля получения тритияПолучение сплавов для
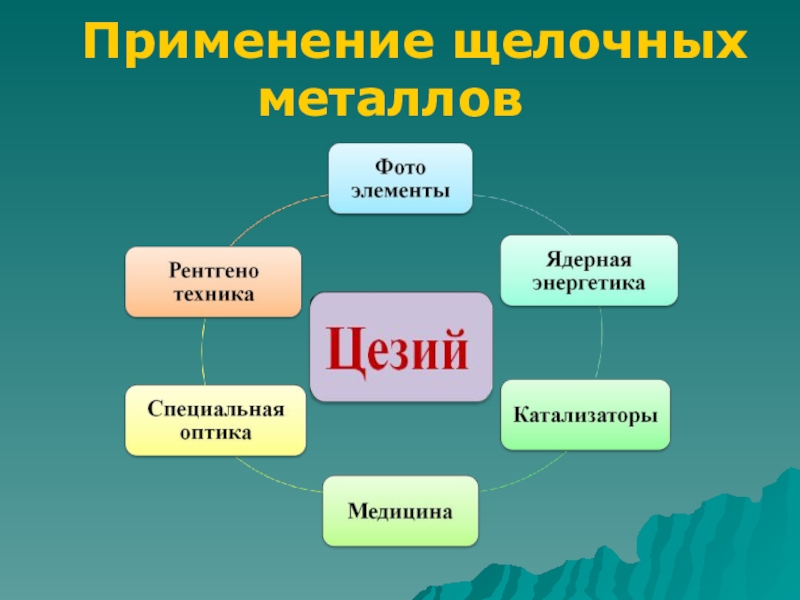
- 10. Применение щелочных металлов
- 11. Применение щелочных металлов КалийВ гальванотехнике Калийные
- 12. Применение щелочных металлов
- 13. Применение щелочных металлов
- 14. Биологическая роль натрия в организме.Совместно с калием
- 15. Биологическая роль КK+ - внеклеточный ион, поддерживает
- 16. Применение соединений натрия в медицине.1) гипертонический раствор
- 17. Симптомы недостатка.При выключении хлористого натрия из пищи
- 18. Симптомы избытка.Постоянный избыток натрия и калия в
- 19. Содержание натрия в продуктах питания.Естественное содержание Натрия
- 20. Для распознавания соединений
- 21. Химические свойстваЩелочные металлы активно взаимодействуют почти со
- 22. Химические свойства Все щелочные металлы активно реагируют с
- 23. Самые распространенные соединения металлов и их применениеNaOH
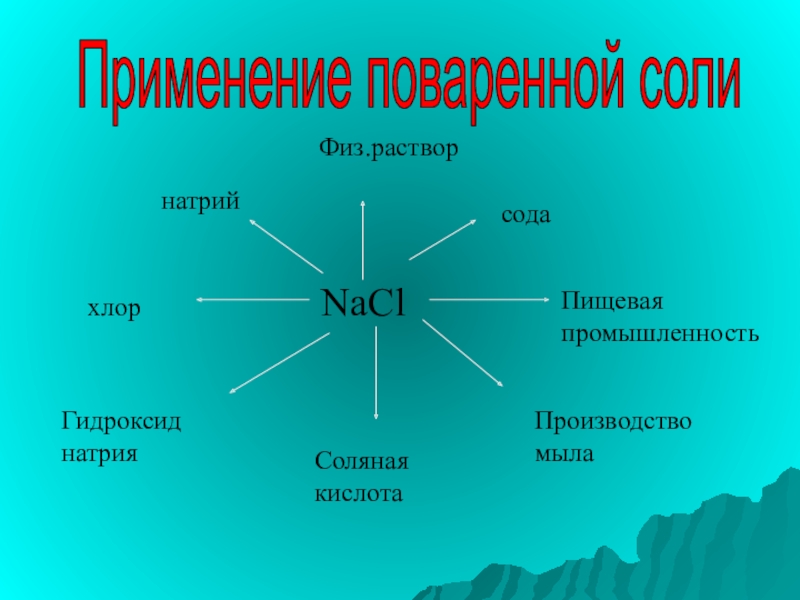
- 24. Применение поваренной солиNaClнатрийхлорГидроксид натрияСоляная кислотаПроизводство мылаПищевая промышленностьсодаФиз.раствор
- 25. ОксидыОксиды щелочных металлов – соединения их с
- 26. ГидроксидыГидроксиды щелочных металлов, кроме Li, термостойки и
- 27. Реакции с кислотами2KOH + H2SO4 = K2SO4
- 28. Реакции с солями2NaOH + CuSO4
- 29. Реакции с кислотными оксидами2KOH + SiO2 =
- 30. Правда или ложь?1. все металлы в ряду
- 31. Ответ: ложьвсе металлы в ряду относятся к
- 32. Ответ: ложьПри взаимодействии натрия с кислородом образуется
- 33. Контрольный тест 1.К группе щелочных металлов относятся:а)
- 34. КЛЮЧ к проверке тестов: 1б 2а 3г 4в 5а
- 35. Скачать презентанцию
Слайды и текст этой презентации
Слайд 3Мягкий металл серебристо-белого цвета
Серебристо-белый мягкий металл
Na
Li
Серебристо-белый мягкий металл
K
Серебристо-белый мягкий металл
Rb
Очень
мягкий вязкий
серебристо-жёлтый похожий на золото металл
Cs
Fr
Радиоактивный щелочной металл
Слайд 4Эти металлы получили название щелочных, потому что большинство их соединений
растворимы в воде.
По-славянски «выщелачивать» означает «растворять», это и определило
название данной группы металлов Слайд 5История открытия металлов
В 1807 г. в Англии Г. Деви открыл
натрий и калий.
«Натрун» - сода, «алкали» - щелочь.
В 1817г. в
Швеции А. Арфведсоном был открыт литий.«Литос» - камень.
В 1860 – 1861г.г. в Германии Р.Бунзен и Г.Кирхгоф открыли рубидий «темно-красный» и цезий «небесно-голубой».
В 1939г. во Франции М. Перей открыла радиоактивный элемент франций, который назвала в честь своей страны – Франции.
Слайд 6 Нахождение в природе
Как очень активные металлы, они встречаются
в природе только в виде соединений
Натрий и калий широко распространены
в природе в виде солей Соединения других щелочных металлов встречаются редко
Кристаллы хлорида натрия – минерал галит
Карбонат калия-поташ
Лепидолит- один из основных источников редких щелочных металлов, рубидия и цезия
Слайд 8Изменение свойств в группе
В ряду щелочных металлов:
Радиус атома увеличивается
Увеличиваются восстановительные свойства (способность отдавать электроны)
Уменьшается прочность химической связи
металл – металлУменьшается температура плавления, температура кипения
Fr
K
Na
Li
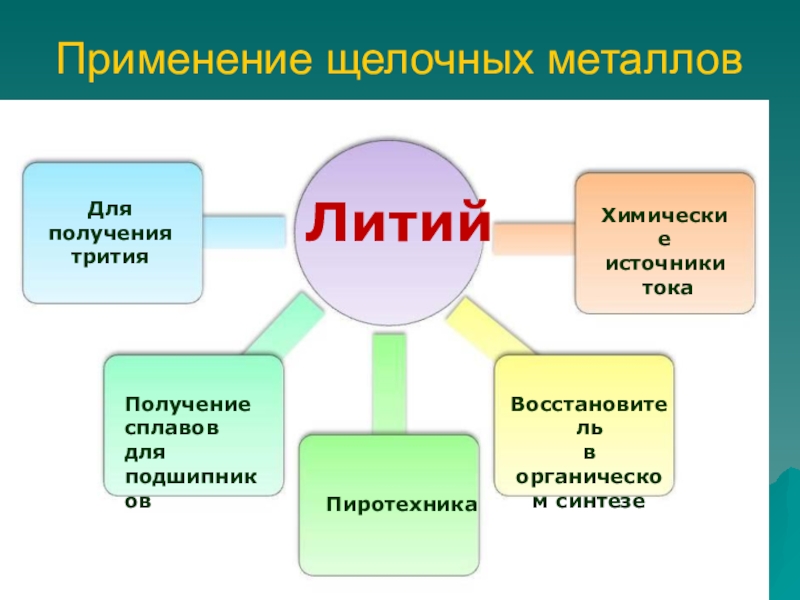
Слайд 9Применение щелочных металлов
Для получения трития
Получение сплавов для подшипников
Пиротехника
Восстановитель
в
органическом синтезеХимические источники
тока
Литий
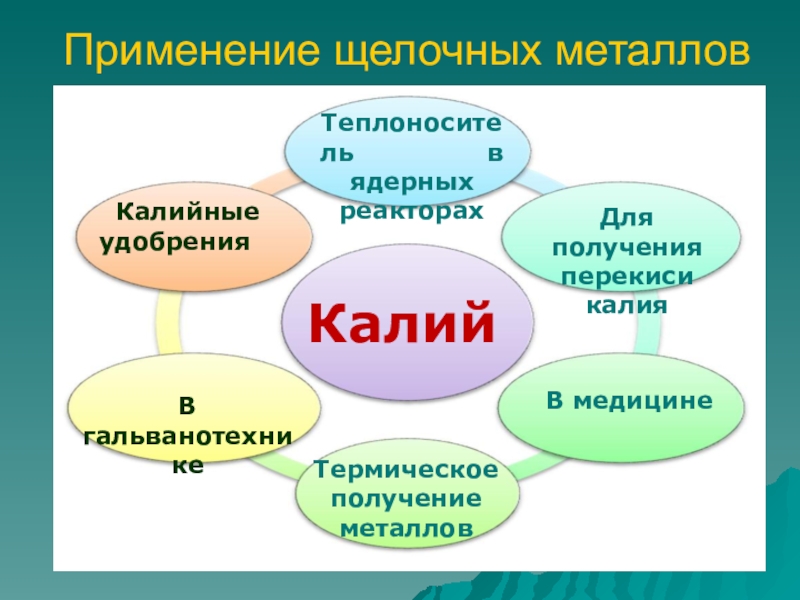
Слайд 11Применение щелочных металлов
Калий
В гальванотехнике
Калийные удобрения
Теплоноситель
в ядерных реакторах
Для получения
перекиси калия В медицине
Термическое получение металлов
Слайд 14Биологическая роль натрия в организме.
Совместно с калием натрий в организме
человека выполняет следующие функции:
Создание условий для возникновения мембранного
потенциала и мышечных сокращений.Поддержание осмотической концентрации крови.
Поддержание кислотно-щелочного баланса.
Нормализация водного баланса.
Обеспечение мембранного транспорта.
Активация многих энзимов.
Рекомендуемая доза натрия составляет для детей от 600 до 1700 миллиграммов, для взрослых от 1200 до 2300 миллиграммов. В виде поваренной соли это составляет от 3 до 6 граммов в день.
Слайд 15Биологическая роль К
K+ - внеклеточный ион, поддерживает работу сердца и
мышц.
Большое количество калия содержится в кураге, сое, фасоли, зеленом горошке,
черносливе, изюме.Слайд 16Применение соединений натрия в медицине.
1) гипертонический раствор натрия хлора.
В следствии
большого астматического давления обезвоживает клетки и способствует плазмолизу бактерий.
Такой раствор
применяют наружно при лечении гнойных ран,воспалительных процессов полости рта и обширных ожогах.
2)Пероксид натрия.
Применяют в замкнутых объектах.
3) натрий гидрокарбонат
В водном растворе в результате гидролиза по аниону возникает слабо щелочная
среда,которая оказывает антимикробное действие.
Применяют для понижения кислотности и для нейтрализации кислот
попавших на кожу. Также его используют как отхаркивающее средство в микстурах.
Слайд 17Симптомы недостатка.
При выключении хлористого натрия из пищи его выделение из
организма прекращается на 9-й день.
Недостаток хлористого натрия вызывает тяжелые
расстройства, проявляющиеся исхуданием, слабостью, кожными сыпями, выпадением волос, поносами, судорогами. У рабочих горячих цехов при усиленном выделении хлористого натрия потовыми железами наблюдаются кишечные колики, судорожные сокращения скелетных мышц, угнетение ЦНС и расстройства кровообращения. Пониженное содержание натрия обычно встречается при нейроэндокринных нарушениях, хронических заболеваниях почек и кишечника или как следствие черепно-мозговых травм.
Основные причины дефицита натрия:
Недостаточное поступление.
Болезни гипофиза, надпочечников.
Болезни почек.
Черепно-мозговые травмы.
Усиленное выделение натрия (повышенная потливость, понос, рвота).
Обильная экссудация при сильных ожогах.
Длительное применение мочегонных препаратов, кортикостероидов, препаратов лития.
Избыток в организме калия, кальция.
Длительный контакт с морской водой.
Нарушение регуляции обмена натрия.
Основные проявления дефицита натрия - исхудание, слабость, кожные сыпи, выпадение волос, поносы, кишечные колики, судорожные сокращения скелетных мышц, расстройства кровообращения, угнетение центральной нервной системы.
Слайд 18Симптомы избытка.
Постоянный избыток натрия и калия в пище сопровождается некоторым
повышением уровня инсулина в крови. Отмечаются и другие гормональные сдвиги.
Введение большого количества хлористого натрия вызывает распад белка и сильное исхудание. При парентеральном введении изотонического раствора может повыситься температура тела, что чаще всего наблюдается у детей.Люди с избытком натрия обычно легко возбудимы, впечатлительны, гиперактивны, у них появляются жажда и потливость, увеличивается частота мочеиспусканий.
Основные причины избытка натрия:
Нарушение регуляции обмена натрия.
Избыточное поступление натрия извне.
Недостаточное содержание воды в организме.
Основные проявления избытка натрия - утомление, возбуждение; неврозы; дисфункция надпочечников; нарушенивыделительной функции почек; образование камней в почках; жажда; отеки; гипертензия; остеопороз.
Слайд 19Содержание натрия в продуктах питания.
Естественное содержание Натрия в пищевых продуктах
относительно невелико (15-80 мг%).
Основное количество минерала - около 80%
- организм получает при поглощении продуктов с добавлением поваренной соли. Относительно много Натрия содержится в красной свекле, устрицах, сельдерее, цикории, моркови, морской капусте.
В минимальных дозах это вещество содержится в мясе, овощах и рыбе. Много соли применяется при изготовлении колбасы, копченостей, сыров, готовых блюд и хлеба. Даже в шоколаде есть соль.
Потребление кофеина способствует потере Натрия.
Слайд 20
Для распознавания соединений щелочных металлов по окраске
пламени исследуемое вещество вносится в пламя горелки на кончике железной
проволоки.Li+ - карминово-красный
K+ - фиолетовый
Cs+ - фиолетово-синий
Na+ - желтый Rb + - красный
Качественное определение щелочных металлов
Li+ Cs+ Na+
K+
Слайд 21Химические свойства
Щелочные металлы активно взаимодействуют почти со всеми неметаллами:
2Ме0 +
Н20 = 2Ме+1Н-1 (гидрид)
2Na + H2 = 2NaH
2Ме0 + Cl20
= 2Mе+1Cl-1 (хлорид)2Ме0 + S0 = Mе+12S (сульфид)
С кислородом натрий образует
пероксиды:
2Ме0 + О20 = Ме+12О2-1 пероксид
2Na + O2 = Na2O2
Слайд 22Химические свойства
Все щелочные металлы активно реагируют с водой, образуя щелочи
и восстанавливая воду до водорода:
2Ме0 + 2Н2О = 2Ме+1ОН +
Н22Na + 2Н2О = 2NaOH + H2
Скорость взаимодействия щелочного металла с водой увеличивается от лития к цезию
Кусочек металлического натрия реагирует с водой в присутствии фенолфталеина
Слайд 23Самые распространенные соединения металлов и их применение
NaOH – едкий натр,
каустическая сода.
KOH - едкое кали.
Na2CO310H2O –кристаллическая сода.
NaHCO3 – пищевая
сода.K2CO3 -поташ.
Na2SO410H2O – глауберова соль.
Используют для очистки нефтепродуктов, производства бумаги, мыла, волокон, стекла, удобрений. Применяют в медицине и фармакологии.
Слайд 24Применение поваренной соли
NaCl
натрий
хлор
Гидроксид натрия
Соляная кислота
Производство мыла
Пищевая промышленность
сода
Физ.раствор
Слайд 25Оксиды
Оксиды щелочных металлов – соединения их с О вида Ме2О:
О2-
О2-Na+ Na+ Li+ Li+
Оксиды основные, так как им соответсвуют гидроксиды NaOH; LiOH.
Слайд 26Гидроксиды
Гидроксиды щелочных металлов, кроме Li, термостойки и не разрушаются от
температуры.
Гидроксиды реагируют с
Кислотами
Кислотными оксидами
Солями (если образуется нерастворимое основание).
Слайд 28Реакции с солями
2NaOH + CuSO4 Cu(OH)2 +
Na2SO4
нерастворимое основание + соль Горение щелочных металлов
Литий - красным цветом
Натрий – желтым или оранжевым
Слайд 30Правда или ложь?
1. все металлы в ряду относятся к щелочным
металлам
Li, Na, K
2. Число электронов на внешнем
уровне в атомах щелочных металлов равно 13. Металлические свойства щелочных металлов от лития к францию усиливаются
4.Восстановительные свойства щелочных металлов от лития к францию ослабевают
5. При взаимодействии натрия с кислородом образуется оксид натрия
6. При взаимодействии лития с кислородом образуется оксид лития
7. Натрий окрашивает пламя в карминово-красный цвет
8. Калий окрашивает пламя в желтый цвет
9. Степень окисления щелочных металлов в соединениях:
+1
10. В ряду от лития к францию атомный радиус увеличивается
Слайд 31Ответ: ложь
все металлы в ряду относятся к щелочным металлам
Li, Na, K ,Са
Число
электронов на внешнем уровне в атомах щелочных металлов равно 1Металлические свойства щелочных металлов от лития к францию усиливаются
Правда или ложь
Ответ: правда
Ответ: правда
Восстановительные свойства щелочных металлов от лития к францию ослабевают
Ответ: ложь
В ряду от лития к францию атомный радиус увеличивается
Ответ: правда
Слайд 32Ответ: ложь
При взаимодействии натрия с кислородом образуется оксид натрия
При взаимодействии
лития с кислородом образуется
оксид лития
Натрий окрашивает пламя в карминово-красный
цветОтвет: правда
Ответ: ложь
Калий окрашивает пламя в желтый цвет
Ответ: ложь
Степень окисления щелочных металлов в соединениях:
+1
Ответ: правда
Слайд 33Контрольный тест
1.К группе щелочных металлов относятся:
а) Li, Na, K,
Cu, Pb, Ag
б) Li,Na,K, Rb,Cs,Frв) Li, Be, B, C, N, O г) Li, Na, Be, Mg, K, Ca
2.Строение внешнего энергетического уровня щелочных металлов отражает электронная формула:
а) ns1 б) ns 2
в) ns1np6 г) np1
3. Для щелочных металлов характерны свойства:
а) окислителей б) восстановителей и окислителей
в) окислителей и восстановителей г)восстановителей
4. Щелочные металлы взаимодействуют со всеми веществами группы
а) HCl, H2O, H2, SO3, O2 б) O2, N2, S, H2O, Cu
в) O2, H2, S, H2O г) KOH, H2, O2, H2O
5. Активность атомов щелочных металлов увеличивается в ряду:
а) Li, Na, K, Rb, Cs, Fr б) Fr, Cs, Rb, K, Na, Li
в) Na, Li, Rb, K, Fr, Cs г) K, Na, Li, Rb, Cs, Fr