Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Система обеспечения качества, безопасности и эффективности лекарственных
Содержание
- 1. Система обеспечения качества, безопасности и эффективности лекарственных
- 2. Жизненный цикл лекарственного средстваПолучение лекарственного вещества путем
- 3. Понятие о качестве, безопасности и эффективности лекарственного
- 4. Закон Республики Беларусь от 20.07.2006 № 161-З
- 5. Система контроля качества лекарственных средств Система контроля
- 6. Производитель лекарственного средства на каждую выпущенную серию
- 7. НОРМАТИВНЫЕ ПРАВОВЫЕ ОСНОВЫ ОБЕСПЕЧЕНИЯ КАЧЕСТВА, ЭФФЕКТИВНОСТИ И БЕЗОПАСНОСТИ ЛС
- 8. Организация системы обеспечения качества лс
- 9. Порядок контроля качества лекарственного средства
- 10. Система контроля за качеством ЛССеть из 12
- 11. фармацевтическая экспертиза регистрационного досьеапробация методов контроля за
- 12. Система ОБЕСПЕЧЕНИЯ КАЧЕСТВА ЛЕКАРСТВЕННЫХ СРЕДСТВ01.01.2007 - первое
- 13. ОБЪЕМ доклинических исследований лекарственного средстваТКП 125-2008: Приложение Д
- 14. Доклинические исследования лекарственных средствЦелью доклинических исследований лекарственных
- 15. Доклинические исследования лекарственных средстввключают в себя химические,
- 16. Доклинические исследования лекарственных средствПри фармакологических исследованиях определяют
- 17. Доклинические исследования лекарственных средствПри токсикологических исследованиях устанавливают
- 18. Доклинические исследования лекарственных средствДоклинические исследования лекарственных средств
- 19. Необходимость проведения доклинических исследований лекарственных средств
- 20. Необходимость проведения доклинических исследований лекарственных средств
- 21. Необходимость проведения доклинических исследований лекарственных средствОбоснование необходимости
- 22. Необходимость проведения доклинических исследований лекарственных средствТребование этичности
- 23. Необходимость проведения доклинических исследований лекарственных средствРекомендации составлены,
- 24. Необходимость проведения доклинических исследований лекарственных средствВ последние
- 25. Альтернативные методы экспериментированияВо многих странах, в том
- 26. Альтернативные методы экспериментированияК альтернативным методам относятся следующие:улучшенная
- 27. Альтернативные методы экспериментированияиспользование низших организмов с ограниченной
- 28. альтернативные биологические модели (АБМ). Внедрение альтернативных методов
- 29. Сопоставимость доклинических и клинических испытанийСогласно современным представлениям,
- 30. Сопоставимость доклинических и клинических испытанийИзвестно много случаев,
- 31. Причины низкой эффективности экспериментов на животныхопределяются биологическими
- 32. Причины низкой эффективности экспериментов на животныхБольшинство болезней
- 33. Причины низкой эффективности экспериментов на животныхНаучно-технический прогресс
- 34. Причины низкой эффективности экспериментов на животныхВ лучшем
- 35. Положительные результаты экспериментов на животныхУчитывая данные факты,
- 36. Национальный комитет по биоэтике Республики Беларусь(НКБЭ РБ)
- 37. Правила надлежащей лабораторной практикиДанным документом введено обязательное
- 38. Правила надлежащей лабораторной практикиВ документе указано, что
- 39. Правила надлежащей лабораторной практикиЭто дает возможность сократить
- 40. Правила надлежащей лабораторной практикиGLP определяют необходимость достаточного
- 41. Надлежащая лабораторная практика Таможенного союза1. Система обеспечения
- 42. Надлежащая лабораторная практика8. Протокол/программа исследования………………………………………………………9. Содержание протокола/программы
- 43. ЭТАПЫ ВНЕДРЕНИЯ ЛЕКАРСТВ И ФАЗЫ КЛИНИЧЕСКИХ ИСПЫТАНИЙПостановление
- 44. Фазы клинического изучения лекарственного средства
- 45. ВИДЫ КЛИНИЧЕСКИХ ИСПЫТАНИЙ (МАСКИРУЕМОСТЬ)
- 46. Виды клинических испытаний
- 47. Особые случаи представления результатов доклинического и клинического
- 48. Обеспечение процесса государственной регистрации
- 49. Организация системы регистрации и модель экспертизы регистрационных
- 50. Процедура государственной регистрации
- 51. Исключения из процедуры госрегистрации
- 52. Государственная регистрация (подтверждение государственной регистрации) лекарственных средств
- 53. Обращение лекарственных средств в условиях таможенного союзаМОДЕЛЬ ДВИЖЕНИЯ ДОСЬЕВ ТАМОЖЕННОМ СОЮЗЕ
- 54. БЛАГОДАРЮ ЗА ВНИМАНИЕ!
- 55. Скачать презентанцию
Жизненный цикл лекарственного средстваПолучение лекарственного вещества путем химического синтеза, методами биотехнологии или выделением из природного сырья Скрининг фармакологической активности методами in vitro. Правила научных исследованийДоклинические исследования (Надлежащая лабораторная практика)- установление специфической
Слайды и текст этой презентации
Слайд 1Система обеспечения качества, безопасности и эффективности лекарственных средств в республике
беларусь
Слайд 2Жизненный цикл лекарственного средства
Получение лекарственного вещества путем химического синтеза,
методами
биотехнологии или выделением из природного сырья
Скрининг фармакологической активности методами
in vitro. Правила научных исследованийДоклинические исследования (Надлежащая лабораторная практика)
- установление специфической фармакологической активности методами in vivo на животных с целью установления его эффективности и безопасности
- изучение острой и хронической токсичности, аллергенности, мутагенности, тератогенности, онкогенности
Фармацевтическая разработка
разработка методик идентификации и количественного определения действующего вещества
создание лекарственной формы
разработка нормативной документации на ЛС
Клинические испытания (Надлежащая клиническая практика)
установление эффективности и безопасности ЛС на людях
Регистрация
Промышленное производство (Надлежащая производственная практика)
Контроль качества
Распространение (надлежащая оптовая (дистрибьюторская) практика
Реализация (Надлежащая практика хранения и Надлежащая аптечная практика),
Медицинское применение (Надлежащая практика фармаконадзора)
Уничтожение (Руководство по уничтожению)
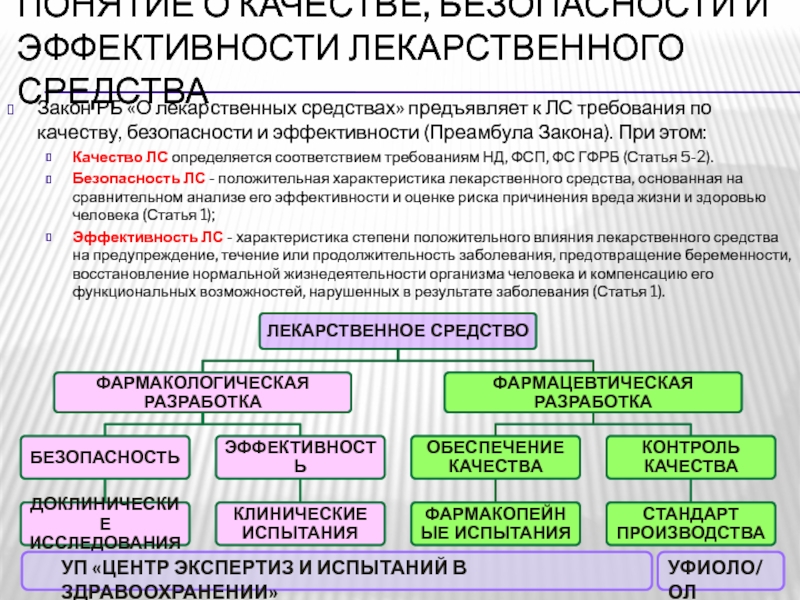
Слайд 3Понятие о качестве, безопасности и эффективности лекарственного средства
Закон РБ «О
лекарственных средствах» предъявляет к ЛС требования по качеству, безопасности и
эффективности (Преамбула Закона). При этом:Качество ЛС определяется соответствием требованиям НД, ФСП, ФС ГФРБ (Статья 5-2).
Безопасность ЛС - положительная характеристика лекарственного средства, основанная на сравнительном анализе его эффективности и оценке риска причинения вреда жизни и здоровью человека (Статья 1);
Эффективность ЛС - характеристика степени положительного влияния лекарственного средства на предупреждение, течение или продолжительность заболевания, предотвращение беременности, восстановление нормальной жизнедеятельности организма человека и компенсацию его функциональных возможностей, нарушенных в результате заболевания (Статья 1).
Слайд 4Закон Республики Беларусь от 20.07.2006 № 161-З «О лекарственных средствах»
Закон Республики Беларусь от 17.11. 2014 г. № 203-З «О
внесении изменений и дополнений в Закон Республики Беларусь «О лекарственных средствах»Слайд 5Система контроля качества лекарственных средств
Система контроля качества лекарственных средств представляет
собой комплекс мероприятий, проводимых при их промышленном производстве, аптечном изготовлении,
реализации, хранении, транспортировке, медицинском применении и позволяющих гарантировать качество лекарственных средств, находящихся в обращении на территории Республики Беларусь.Качество лекарственного средства отечественного производства определяется его соответствием требованиям фармакопейной статьи производителя, фармакопейных статей Государственной фармакопеи Республики Беларусь, а лекарственного средства зарубежного производства - требованиям нормативного документа его производителя, содержащего показатели и методы контроля качества лекарственного средства (далее - нормативный документ производителя). Качество лекарственных средств, изготавливаемых в аптеках, определяется их соответствием требованиям Государственной фармакопеи Республики Беларусь.
Слайд 6
Производитель лекарственного средства на каждую выпущенную серию (партию) лекарственного средства
выдает документ, подтверждающий соответствие качества лекарственного средства требованиям, предусмотренным частью
второй настоящей статьи.Каждая серия (партия) лекарственного средства, зарегистрированного в Республике Беларусь, до поступления в реализацию, а также лекарственные средства, находящиеся в обращении, подлежат контролю качества в испытательных лабораториях, аккредитованных в системе аккредитации Республики Беларусь для испытаний лекарственных средств. Перечень испытательных лабораторий, порядок и условия проведения контроля качества лекарственных средств определяются Министерством здравоохранения Республики Беларусь.
Лекарственное средство отечественного производства, не соответствующее требованиям фармакопейной статьи производителя, фармакопейных статей Государственной фармакопеи Республики Беларусь, а также лекарственное средство зарубежного производства, не соответствующее требованиям нормативного документа производителя, признаются некачественными.
Слайд 10Система контроля за качеством ЛС
Сеть из 12 лабораторий системы Минздрава.
Все
лаборатории аккредитованы Госстандартом РБ по ISO 17025 (Международный стандарт требований
к испытательным лабораториям).Головные лаборатории – Лаборатория фармакопейного и фармацевтического анализа и Республиканская контрольно-аналитическая лаборатория имеют МЕЖДУНАРОДНУЮ аккредитацию
Слайд 11фармацевтическая экспертиза регистрационного досье
апробация методов контроля за качеством ЛС и
АФИ
контроль за качеством ЛС и АФИ с использованием этих методов
при регистрации (перерегистрации) ЛСконтроль за качеством ЛС для клинических испытаний
подготовка к изданию и актуализация Государственной Фармакопеи Республики Беларусь
ЛАБОРАТОРИЯ ФАРМАКОПЕЙНОГО И ФАРМАЦЕВТИЧЕСКОГО АНАЛИЗА
с 17 августа 2013 г. утверждена как ассоциированный член общеевропейской сети лабораторий OMCL (GEON)
Система контроля за качеством ЛС
Слайд 12Система ОБЕСПЕЧЕНИЯ КАЧЕСТВА ЛЕКАРСТВЕННЫХ СРЕДСТВ
01.01.2007 - первое издание первого тома
Государственной фармакопеи Республики Беларусь
01.06.2008 – том 2
22.12.2009 - том
301.01.2013 - второе издание Государственная фармакопея Республики Беларусь II, том 1
01.04.2013 - Вторая редакция правил GMP – ТКП 030-2013 «Надлежащая производственная практика». Учитывает ВСЕ требования Европейского Союза
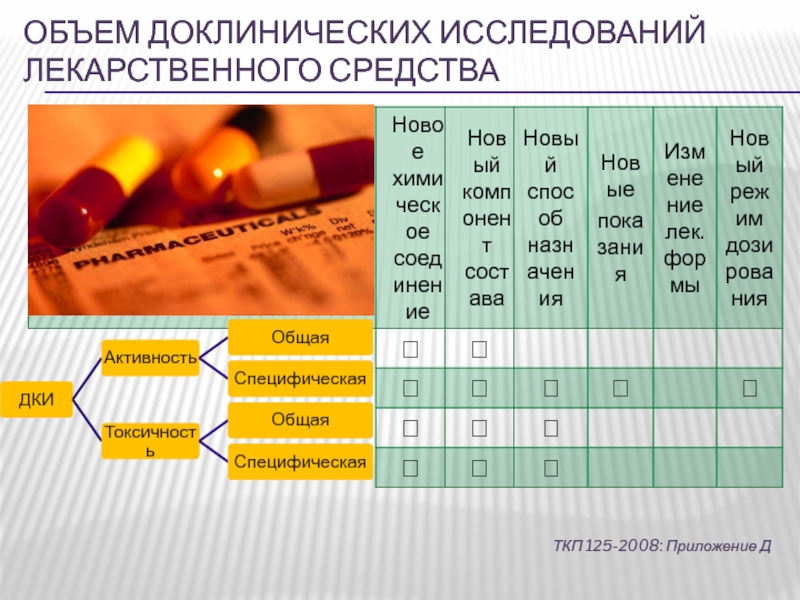
Слайд 14Доклинические исследования лекарственных средств
Целью доклинических исследований лекарственных средств является получение
научными методами оценок и доказательств их специфической фармакологической активностии и
безопасности, не предусматривающие их исследование на физических лицах.Слайд 15Доклинические исследования лекарственных средств
включают в себя химические, физические, биологические, микробиологические,
фармакологические, токсикологические и другие экспериментальные исследования.
все они взаимозависимы. Так,
в результате изучения острой токсичности потенциальных лекарственных соединений получают данные для последующих фармакологических исследований, которые, в свою очередь, определяют степень и продолжительность изучения хронической токсичности вещества.Слайд 16Доклинические исследования лекарственных средств
При фармакологических исследованиях определяют терапевтическую эффективность препарата,
а также его влияние на основные анатомические и физиологические системы
организма.В процессе изучения фармакодинамики вещества устанавливают не только его специфическую активность, но и возможные побочные реакции, связанные с фармакологической активностью.
Действие исследуемого препарата на здоровый и больной организм может различаться, поэтому фармакологические испытания должны проводиться на моделях соответствующих заболеваний или патологических состояний.
Слайд 17Доклинические исследования лекарственных средств
При токсикологических исследованиях устанавливают характер и выраженность
возможного повреждающего воздействия препаратов на экспериментальных животных. В токсикологических исследованиях
выделяют три этапа:изучение острой токсичности вещества при однократном введении;
определение хронической токсичности соединения, которое включает в себя повторные введения препарата на протяжении одного года, а иногда и более;
установление специфической токсичности препарата — онко- генности, мутагенности, эмбриотоксичности, включая тератогенное действие, аллергизирующие свойства, а также способности вызывать лекарственную зависимость.
Слайд 18Доклинические исследования лекарственных средств
Доклинические исследования лекарственных средств проводятся в соответствии
с Законом «О лекарственных средствах». Согласно статье 14 закона «Доклинические
исследования лекарственных средств» доклинические исследования проводятся организациями-разработчиками лекарственных средств по правилам лабораторной практики (GLP) утвержденными Министерством здравоохранения РБ.Слайд 19Необходимость проведения доклинических исследований лекарственных средств
для оценки их безопасного
использования в медицинской практике;
эксперименты на животных необходимы для развития медико-биологических
наук, поскольку позволяют лучше понимать законы и механизмы жизненных процессов;изучение повреждающего действия исследуемого препарата на организм экспериментальных животных позволяет определить, какие органы и ткани наиболее чувствительны к данному веществу и на что следует обратить особое внимание при клинических испытаниях.
Слайд 20Необходимость проведения доклинических исследований лекарственных средств
только в опытах на
животных можно выявить воздействие изучаемого вещества на органы с использованием
гистологических методов оценки их структуры, влияние препаратов на внутриутробное развитие плода, возможное мутагенное или канцерогенное действие и ряд других воздействий;«Чем полнее будет проделан опыт на животных, тем менее часто больным придется быть в положении опытного объекта со всеми печальными последствиями»' (И.П. Павлов).
Слайд 21Необходимость проведения доклинических исследований лекарственных средств
Обоснование необходимости предварительного проведения опытов
на животных перед первым испытанием новых лекарств на людях содержится
в Хельсинкской декларации, где утверждается, что биомедицинские исследования на людях должны отвечать общепринятым научным принципам и основываться на адекватно выполненных лабораторных опытах и экспериментах на животных, а также исчерпывающем знании научной литературы. Кроме того, этот кодекс этических принципов призывает к бережному отношению к животным, которых используют для исследований.Слайд 22Необходимость проведения доклинических исследований лекарственных средств
Требование этичности стало обязательным условием
проведения экспериментов на животных во всех странах мира. Это показатель
цивилизованности страны. В начале 1985 г. Совет международных медицинских научных организаций (СММНО) опубликовал «Этический кодекс», который содержит «международные рекомендации по проведению медико-биологических исследований с использованием животных».В этом кодексе сформулированы приемлемые для научных работников и для общественных групп защитников животных теоретические принципы и этические правила, которые могут быть приняты за основу при разработке регламентирующих мер и нормативных документов в разных странах мира в отношении использования животных для биомедицинских исследований.
Слайд 23Необходимость проведения доклинических исследований лекарственных средств
Рекомендации составлены, исходя из следующих
положений:
в принципе использование животных для научных целей нежелательно;
по возможности следует
применять методы, не требующие использования животных;при существующем уровне знаний использование животных является неизбежным;
моральный долг ученых — гуманно относиться к подопытным животным, по возможности не причинять им боли и неудобств и постоянно стремиться изыскивать способы получения того же результата без привлечения живых животных;
животным, предназначенным для медико-биологических исследований, следует обеспечивать наилучшие из возможных условия их содержания.
Слайд 24Необходимость проведения доклинических исследований лекарственных средств
В последние десятилетия для решения
этических проблем при использовании животных в экспериментальной биологии и медицине
руководствуются концепцией «трех R» Рассела и Берча: замена (replacement), уменьшение (reduction), повышение качества (refinement). Такой подход к экспериментированию имеет своей целью применение лучших научных методов при одновременном сокращении количества животных, используемых в экспериментах, а также при усовершенствовании экспериментальной техники с целью минимизации страданий, испытываемых подопытными.Слайд 25Альтернативные методы экспериментирования
Во многих странах, в том числе в странах-участниках
Европейского Союза, закон обязывает исследователей, подающих заявление о лицензии на
проект, объявить, что они полностью учли возможность применения альтернативных методов экспериментирования. Это поддерживается Директивой ЕС по защите позвоночных животных (1986), которая постановляет: проведение эксперимента запрещается, если имеется другой научно приемлемый метод получения желаемого результата — без использования животных.Слайд 26Альтернативные методы экспериментирования
К альтернативным методам относятся следующие:
улучшенная система хранения и
использования информации, а также обмен информацией об экспериментах, уже проведенных
над животными, во избежание повторения таких процедур;использование физических и химических приемов и прогнозов, основанных на физических и химических свойствах молекул;
использование математических и компьютерных моделей, в том числе моделирование количественных отношений типа «структура-деятельность»;
молекулярное моделирование и использование компьютерных графических средств;
моделирование биохимических, физиологических, фармакологических, токсикологических и поведенческих систем и процессов;
использование in vitro-методов, в том числе клеточных фракций, кратковременного хранения слоев ткани, суспензии клеток и обрызгивания органов, а также выращивания тканей (клеточное и органотипичное), в том числе выращивания человеческих тканей;
Слайд 27Альтернативные методы экспериментирования
использование низших организмов с ограниченной чувствительностью и/или не
защищенных законодательством, регулирующим эксперименты над животными;
использование позвоночных животных на ранних
этапах их развития, предшествующих той стадии, на которой регулируется их использование в экспериментах и других научных процедурах;эксперименты с участием людей, включая участников-добровольцев, после маркетинговых эпидемиологических наблюдений.
Слайд 28альтернативные биологические модели (АБМ).
Внедрение альтернативных методов позволит сократить число животных,
применяемых для получения информации;
уменьшить частоту или интенсивность негуманных процедур;
заменить животных на альтернативные биологические модели (АБМ).
Уникальными альтернативными биологическими моделями (АБМ) признаны культуральные — органы, ткани, клетки вне организма, «in vitro». Ими могут быть бактерии, оплодотворенные куриные яйцеклетки, эмбрионы лягушек, инфузории и пр. АБМ обеспечивают высокую степень воспроизводимости, следовательно, и статистическую достоверность получаемых результатов.
Слайд 29Сопоставимость доклинических и клинических испытаний
Согласно современным представлениям, все шире распространяется
мнение о трудности определения безопасности (или опасности) для человека лечебного
или профилактического средства на основании доклинических испытаний, проведенных только на животных.Насколько низка эффективность использования животных в тестировании лекарственных препаратов, показывает тот факт, что примерно 90% новых лекарственных средств забраковываются на ранних стадиях клинических испытаний, хотя они прошли многолетние испытания на животных по специальной схеме, включающей тесты на острую и хроническую токсичность, канцерогенность, мутагенность и тератогенность.
Слайд 30Сопоставимость доклинических и клинических испытаний
Известно много случаев, когда опыты на
животных привели к неправильным выводам о безопасности препарата. Большой резонанс
в мире получило так называемое «дело о талидомиде», успокаивающем средстве, которое прошло испытание на животных и было рекомендовано для приема беременным женщинам.Слайд 31Причины низкой эффективности экспериментов на животных
определяются биологическими различиями между человеком
и экспериментальными животными.
Животные могут по-разному реагировать на один и
тот же лекарственный препарат, это обусловлено следствием различий в абсорбции, в кишечной флоре, в распределении в тканях, в метаболизме, включая биоинтоксикацию и детоксикацию, в механизмах и скорости всасывания, распределения метаболизма лекарственных веществ.Все это делает проблематичной экстраполяцию результатов, полученных на животных, на человека.
Слайд 32Причины низкой эффективности экспериментов на животных
Большинство болезней человека возникает и
протекает совершенно отлично от болезней животных, даже если они имеют
одно и то же название. Возникновение травм, влияние патогенных и токсичных повреждений на человека существенно отличается от таковых у животных. Организм человека сложнее организма любого животного, его связи с окружающей средой отличаются от всех форм связей у животных.Слайд 33Причины низкой эффективности экспериментов на животных
Научно-технический прогресс «создал» новые болезни,
которых не было в древнюю эпоху жизни человека.
Возникли радиационные,
авиационные, автомобильные болезни, обширная группа профессиональных заболеваний, которые вызываются особенностями трудового процесса или вредными воздействиями материалов производства. Социальные факторы создают у людей особые, свойственные преимущественно человеку болезни, не встречающиеся у животных.
Существенным различием патологических процессов у людей и животных является значительно большее разнообразие форм и вариантов болезней у человека.
Слайд 34Причины низкой эффективности экспериментов на животных
В лучшем случае, у животных
воспроизводятся только отдельные элементы болезней человека, некоторые их «составные части»
— симптомы и синдромы, но не заболевание в целом.По существу, ни одно инфекционное заболевание человека не протекает у животных, восприимчивых к конкретному микроорганизму, тождественно с его клиническим течением и развитием у людей.
Слайд 35Положительные результаты экспериментов на животных
Учитывая данные факты, не нужно забывать
и о положительных результатах, которые дают эксперименты на животных для
развития медицины и фармации для всего человечества.Поэтому на исследователей ложится большой груз ответственности при обосновании необходимости проведения доклинических исследований, соблюдения законодательных и этических норм при проведении экспериментов на животных, при интерпретации итогов исследования.
Таким образом, от высокого нравственного уровня исследователя будет зависеть гарантия надежности результатов, доказывающая целесообразность, осмысленность участия животных в эксперименте.
Слайд 36Национальный комитет по биоэтике Республики Беларусь
(НКБЭ РБ) создан как консультативный
орган при Министерстве здравоохранения во исполнение поручения Совета Министров РБ
от 26.07.2005 г. № 05/137-143 в целях осуществления общественного контроля за соблюдением этических норм и правил при выполнении работ, связанных с использованием человека и животных как объектов экспериментальных и клинических исследований.Слайд 37Правила надлежащей лабораторной практики
Данным документом введено обязательное составление и утверждение
протокола эксперимента,
одобрение его этическим комитетом или комиссией для определения
допустимости и приемлемости эксперимента. введена необходимость разработки и соблюдения стандартных операционных процедур для всех стадий и операций по обращению с животными.
исследователи должны обладать соответствующей квалификацией и опытом, т.к. несут они ответственность за анализ результатов и представление отчета о своей работе руководителю испытания.
Слайд 38Правила надлежащей лабораторной практики
В документе указано, что доклинические исследования лекарственных
средств на животных проводятся в соответствии с международными правилами, с
максимальной гуманностью умерщвления животных и проведения самих экспериментов.Потребление животными пищи и воды происходит в соответствии с протоколом исследований и принципом отсутствия в них патогенных микроорганизмов и вредных примесей.
Должно достигаться максимальное документирование всех действий по приему, обслуживанию и экспериментированию с животными.
Большое внимание уделяется стандартизации тест-систем, то есть использованию для экспериментов животных, живущих в стерильных условиях, лишенных патогенной микрофлоры, с определенным генетическим статусом.
Слайд 39Правила надлежащей лабораторной практики
Это дает возможность сократить разброс результатов, само
количество экспериментов и, соответственно, количество участвующих в них животных.
Так,
если необходимо получить высокостандартные и воспроизводимые результаты, в опытах применяют линейных (гомозиготных) животных, которых получают путем многократного близкородственного скрещивания. Такие животные характеризуются определенными биологическими свойствами, например, одинаковой восприимчивостью к инфекционным агентам, способностью к иммунному ответу.Слайд 40Правила надлежащей лабораторной практики
GLP определяют необходимость достаточного количества помещений для
животных или площадей для обеспечения раздельного содержания видов;
животные должны
содержаться при соответствующих условиях окружающей среды и в помещениях, подвергаемых уборке и удалению отходов. При проведении экспериментов обязательны правила обезболивания и эвтаназии.
Содержание экспериментальных животных должно соответствовать действующим Санитарным правилам по устройству, оборудованию и содержанию экспериментально-биологических клиник (вивариев).
Слайд 41Надлежащая лабораторная практика Таможенного союза
1. Система обеспечения качества……………………………………………………………
2. Персонал лаборатории……………………………………………………………3.
Помещения для исследований…………………………………………………………..4. Оборудование, материалы и реактивы……………………………………
5. Тест-системы
6. Испытуемые вещества
и контрольные образцы…………………………7. Стандартные операционные процедуры…………………………………………………..
Слайд 42Надлежащая лабораторная практика
8. Протокол/программа исследования………………………………………………………
9. Содержание протокола/программы исследования……………………………………
10. Проведение исследования…………………………………………………………………
11.
Содержание заключительного отчета……………………………………………………...
12. ХРАНЕНИЕ ДОКУМЕНТОВ И МАТЕРИАЛОВ……………………………………….
ИНСПЕКТИРОВАНИЕ. ПРОЦЕДУРЫ КОНТРОЛЯ СООТВЕТСТВИЯ
НАДЛЕЖАЩЕЙ ЛАБОРАТОРНОЙ ПРАКТИКЕ……………………………………………………13.Конфиденциальность…………………………………………………………………………
Слайд 43ЭТАПЫ ВНЕДРЕНИЯ ЛЕКАРСТВ И ФАЗЫ КЛИНИЧЕСКИХ ИСПЫТАНИЙ
Постановление МЗ РБ №
52 от 08.05.2009 г (в редакции № 124 от 13.09.2010)
Слайд 47Особые случаи представления результатов доклинического и клинического изучения лекарственного средства
Постановление
МЗ РБ № 52 от 08.05.2009 г (в редакции №
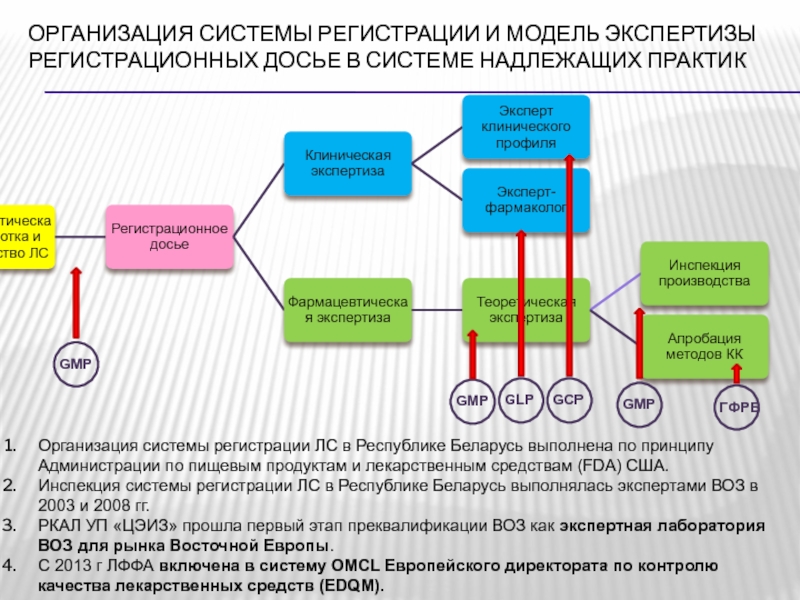
124 от 13.09.2010)Слайд 49Организация системы регистрации и модель экспертизы регистрационных досье в системе
надлежащих практик
Организация системы регистрации ЛС в Республике Беларусь выполнена по
принципу Администрации по пищевым продуктам и лекарственным средствам (FDA) США.Инспекция системы регистрации ЛС в Республике Беларусь выполнялась экспертами ВОЗ в 2003 и 2008 гг.
РКАЛ УП «ЦЭИЗ» прошла первый этап преквалификации ВОЗ как экспертная лаборатория ВОЗ для рынка Восточной Европы.
С 2013 г ЛФФА включена в систему OMCL Европейского директората по контролю качества лекарственных средств (EDQM).
Слайд 52Государственная регистрация (подтверждение государственной регистрации) лекарственных средств
Лекарственные средства могут производиться,
реализовываться и применяться на территории Республики Беларусь после государственной регистрации
(подтверждения государственной регистрации), если иное не определено Законом «О лекарственных средствах».Государственной регистрации не подлежат:
лекарственные средства, изготовленные в аптеках;
лекарственные средства, предназначенные для использования в качестве выставочных образцов;
лекарственные средства, предназначенные для проведения доклинических исследований и клинических испытаний;
лекарственные средства, ввезенные на территорию Республики Беларусь физическим лицом для личного применения;
лекарственные средства, предназначенные только для промышленного производства на экспорт;
фармацевтические субстанции в случае наличия в регистрационных досье на лекарственные средства, в состав которых они входят, документов производителей этих фармацевтических субстанций, отвечающих требованиям, предъявляемым к документам, составляющим регистрационное досье.