Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Система подтверждения соответствия качества в РФ
Содержание
- 1. Система подтверждения соответствия качества в РФ
- 2. План лекцииНормативно-правовая база системы подтверждения соответствия в
- 3. Нормативно-правовая база системы подтверждения соответствия в здравоохранении
- 4. Законодательные основы Основные понятия, цели, принципы, виды и
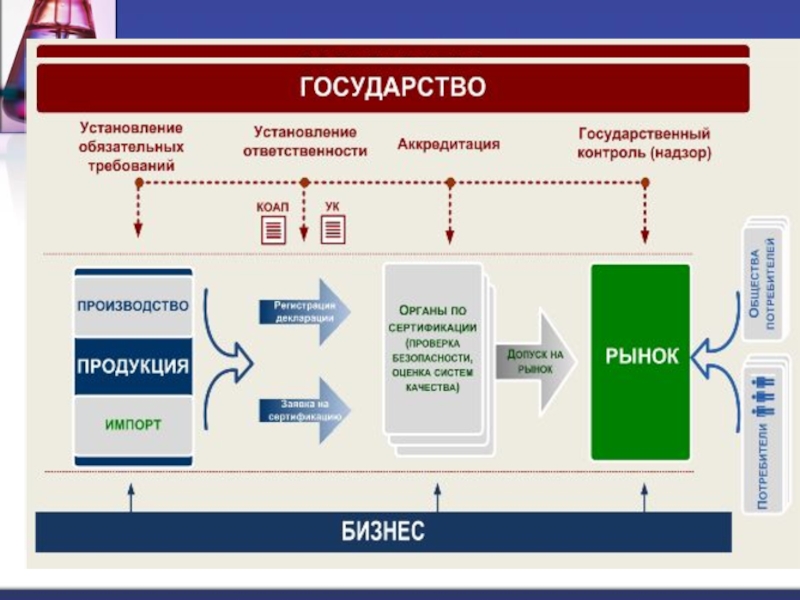
- 5. Подтверждение соответствия -это – процедура документального удостоверения
- 6. Цели подтверждения соответствияСоздание условий для обеспечения свободного
- 7. Принципы подтверждения соответствиядоступность информации о порядке
- 8. Виды и формы подтверждения соответствия2. Обязательное подтверждение
- 9. Форма подтверждения соответствия - определенный порядок документального удостоверения
- 10. Знак обращения на рынке - обозначение, служащее
- 11. Слайд 11
- 12. Знак соответствия нормативной документации это обозначение, служащее для
- 13. Сертификация (ФЗ «О техническом регулировании»)Сертификация – форма
- 14. Система сертификации – это совокупностьправил выполнения
- 15. В чём выражается результат работ по сертификации?Сертификация
- 16. Сертификат соответствия -Это документ, выданный органом по
- 17. Форма сертификата соответствия включает в себя:наименование
- 18. Добровольное подтверждение соответствия -осуществляется по инициативе
- 19. Обязательное подтверждение соответствия -Представляет собой заданную
- 20. Обязательной сертификации подлежат (Закон РФ «О
- 21. Обязательному подтверждению соответствия при реализации на фармацевтическом
- 22. Декларирование соответствия (форма обязательного подтверждения соответствия) Общие
- 23. Схемы сертификации в Системе ГОСТ Р
- 24. Схемы сертификации и декларирования соответствия Декларирование соответствия ЛС
- 25. Декларация о соответствии Декларация о соответствии
- 26. Форма декларации о соответствии Форма декларации
- 27. Содержание декларации о соответствии Декларация о
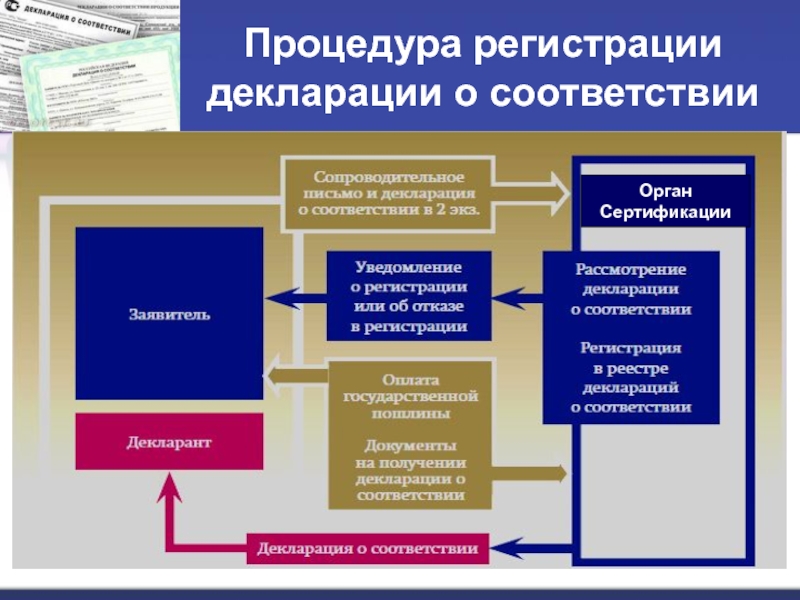
- 28. Процедура регистрации декларации о соответствииОрган Сертификации
- 29. Декларирование соответствия лекарственных средствС 1 января 2007
- 30. Декларация о соответствии лекарственного препаратаДекларация о соответствии
- 31. Документы, которые могут являться основанием для принятия
- 32. Органы управления деятельностью по подтверждению соответствия лекарственных
- 33. Федеральная служба по надзору в сфере здравоохранения
- 34. Орган по сертификации это – юридическое лицо (или
- 35. Полномочия аккредитованных Центров сертификации и контроля качества
- 36. Полномочия аккредитованных Центров сертификации и контроля качества
- 37. Информация для потребителя о качестве лекарственных препаратов Документы,
- 38. Необходимые сведения о подтверждении соответствия товара
- 39. Список фармацевтической продукции, подлежащей декларированию соответствия при ввозе в РФ
- 40. АККРЕДИТАЦИЯ - - официальное признание права
- 41. Перечень испытательных лабораторий (центров), аккредитованных для проведения испытаний
- 42. Слайд 42
- 43. Слайд 43
- 44. БЛАГОДАРЮ ЗА ВНИМАНИЕ !
- 45. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Система подтверждения соответствия качества в РФ
Лекция для студентов 4 курса
фармацевтического факультета и ФВСО
и экономики фармации Медицинское и фармацевтическое товароведениеСлайд 2План лекции
Нормативно-правовая база системы подтверждения соответствия в здравоохранении и фармации
РФ.
Система подтверждения соответствия в РФ. Законодательные основы. Основные понятия. Цели
и принципы. Сертификация. Сертификат соответствия. Знак обращения на рынке. Знак соответствия.Виды и формы подтверждения соответствия (добровольное, обязательное).
Система сертификации РФ. Органы управления по сертификации. Структура органов по сертификации. Основные цели и задачи, полномочия.
Система и порядок подтверждения соответствия лекарственных средств.
Декларирование соответствия ЛС. Основные положения. Документы, подтверждающие соответствие ЛС.
Аккредитация. Понятие. Органы, организации.
Слайд 3Нормативно-правовая база системы подтверждения соответствия в здравоохранении и фармации (основные
акты)
Федеральный закон от 27.12.2002 № 184-ФЗ «О техническом регулировании»;
Закон РФ
«О защите прав потребителей» (от 07.02.1992);Федеральный закон от 12.04.2010 №61-ФЗ «Об обращении лекарственных средств»;
Федеральный закон от 26.06.2008 № 102-ФЗ «Об обеспечении единства измерений»;
Постановление Правительства РФ от 01.12.2009 № 982 «О Едином перечне продукции, подтверждение соответствия которой осуществляется в форме обязательной сертификации и Едином перечне продукции, подтверждение соответствия которой осуществляется в форме принятия декларации о соответствии».
ГОСТ Р ИСО\МЭК 65-2000. Общие требования по сертификации продукции;
ГОСТ Р 51000.4–2008. Общие требования к аккредитации испытательных лабораторий.
Слайд 4Законодательные основы
Основные понятия, цели, принципы, виды и формы деятельности в
сфере подтверждения соответствия, а также функции органов по сертификации установлены
Федеральным законом от 27.12.2002 №184-ФЗ «О техническом регулировании»Слайд 5Подтверждение соответствия -
это – процедура документального удостоверения соответствия продукции или
иных объектов, процессов проектирования (включая изыскания), производства, строительства, монтажа, наладки,
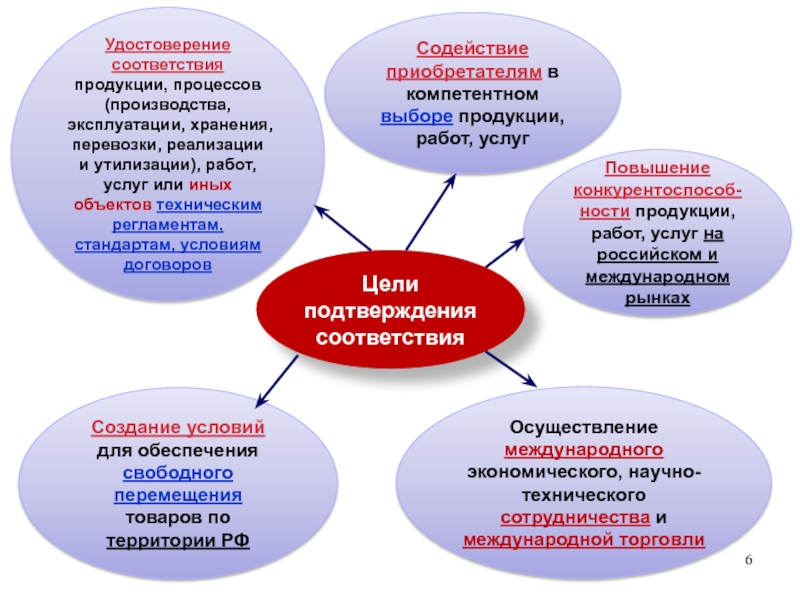
эксплуатации, хранения, перевозки, реализации и утилизации, выполнения работ или оказания услуг требованиям технических регламентов, положениям стандартов, сводов правил или условиям договоров.Слайд 6Цели подтверждения соответствия
Создание условий для обеспечения свободного перемещения товаров по
территории РФ
Повышение конкурентоспособ-ности продукции, работ, услуг на российском и международном
рынкахСодействие приобретателям в компетентном выборе продукции, работ, услуг
Удостоверение соответствия
продукции, процессов (производства, эксплуатации, хранения, перевозки, реализации и утилизации), работ, услуг или иных объектов техническим регламентам, стандартам, условиям договоров
Осуществление международного экономического, научно-технического сотрудничества и международной торговли
Слайд 7Принципы
подтверждения соответствия
доступность информации о порядке осуществления подтверждения соответствия заинтересованным
лицам;
недопустимость применения обязательного подтверждения соответствия к объектам, в отношении которых
не установлены требования технических регламентов;установление перечня форм и схем обязательного подтверждения соответствия в отношении определенных видов продукции;
уменьшение сроков осуществления обязательного подтверждения соответствия и затрат заявителя;
недопустимость принуждения к осуществлению добровольного подтверждения соответствия;
защита имущественных интересов заявителей, соблюдения коммерческой тайны в отношении сведений, полученных при осуществлении подтверждения соответствия;
недопустимость подмены обязательного подтверждения соответствия добровольной сертификацией.
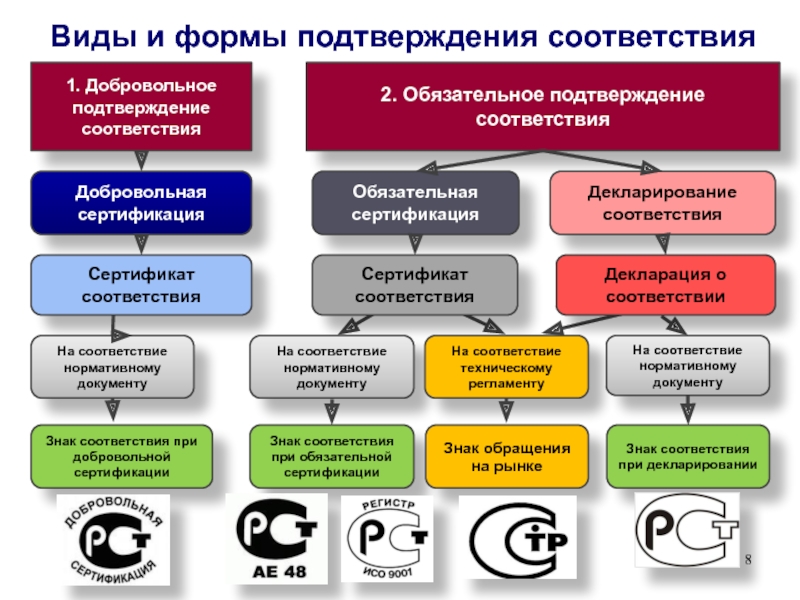
Слайд 8Виды и формы подтверждения соответствия
2. Обязательное подтверждение соответствия
Декларирование соответствия
Обязательная сертификация
1.
Добровольное подтверждение соответствия
Добровольная сертификация
Сертификат соответствия
Знак соответствия при добровольной сертификации
Сертификат
соответствияЗнак соответствия при обязательной сертификации
Декларация о соответствии
Знак обращения на рынке
На соответствие нормативному документу
На соответствие нормативному документу
На соответствие техническому регламенту
На соответствие нормативному документу
Знак соответствия при декларировании
Слайд 9Форма подтверждения соответствия
- определенный порядок документального удостоверения соответствия продукции или
иных объектов, процессов …, выполнения работ или оказания услуг требованиям
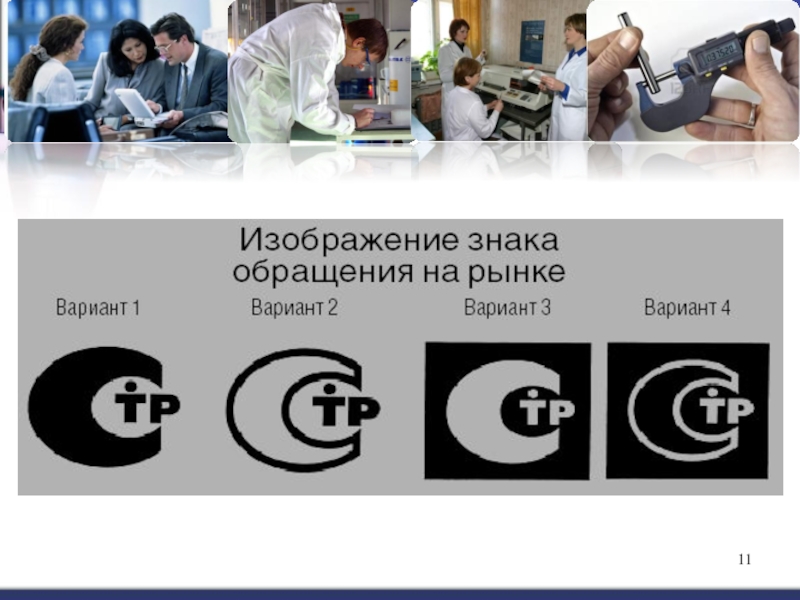
технических регламентов, положениям стандартов или условиям договоров.Слайд 10Знак обращения на рынке -
обозначение, служащее для информирования приобретателей
о соответствии продукции требованиям технических регламентов.
Изображение знака обращения на
рынке установлено Постановлением Правительства РФ от 19.11.2003 №696.Знак обращения на рынке представляет собой сочетание букв «Т» ( с точкой над ней) и «Р», вписанных в букву «С»,
стилизованную под измерительную скобу, имеющую одинаковые высоту и ширину (4 варианта).
Слайд 12Знак соответствия нормативной документации
это обозначение, служащее для информирования приобретателей о
соответствии объекта сертификации требованиям системы добровольной сертификации или национальному стандарту
Слайд 13Сертификация
(ФЗ «О техническом регулировании»)
Сертификация – форма осуществляемого органом по сертификации
подтверждения соответствия объектов требованиям технических регламентов, положениям стандартов, сводов правил
или условиям договоров.«Сертификация» в переводе с латыни означает «сделано верно».
Чтобы знать, что продукт сделан верно, нужно иметь информацию о том, каким требованиям продукт должен соответствовать и каким образом получить доказательство этого соответствия.
Слайд 14Система сертификации
– это совокупность
правил выполнения работ по сертификации,
участников сертификации
(заявителей, органов, центров, испытательных лабораторий и др.),
правил функционирования системы
сертификации в целом.Слайд 15В чём выражается результат работ по сертификации?
Сертификация основана на проведении
испытаний продукции.
Испытания проводятся в аккредитованной лаборатории, на выходе выдается документ,
который называется протокол испытаний. Это и есть основной документ, на основании которого выдается Сертификат соответствия.
Слайд 16Сертификат соответствия -
Это документ, выданный органом по сертификации и удостоверяющий
соответствие объекта требованиям технических регламентов, стандартов (ГОСТ, ГОСТ Р, ГОСТ
Р МЭК, ГОСТ Р ИСО), правил или условиям договоров.Наличие сертификата помогает покупателям в компетентном выборе продукции и является определенной гарантией ее качества.
Слайд 17Форма
сертификата соответствия
включает в себя:
наименование и местонахождение заявителя, изготовителя
продукции и органа по сертификации;
информацию об объекте сертификации;
наименование
технического регламента (или стандарта, НД), на соответствие требованиям которого проводилась сертификация; информацию о представленных заявителем документах (протоколах испытаний и др.) и о проведенных испытаниях и измерениях;
срок действия сертификата соответствия.
Слайд 18Добровольное
подтверждение соответствия -
осуществляется по инициативе заявителя на условиях договора
между заявителем и органом по сертификации
для установления соответствия объектов
(продукции, процессов и др.): национальным стандартам,
стандартам организаций,
системам добровольной сертификации,
условиям договоров;
осуществляется в форме добровольной сертификации.
Слайд 19Обязательное
подтверждение соответствия -
Представляет собой заданную совокупность действий, официально принимаемых
в качестве доказательства соответствия объекта требованиям технического регламента или национального
стандарта.Осуществляется в 2-х формах: обязательной сертификации и декларирования соответствия.
Слайд 20Обязательной сертификации подлежат
(Закон РФ «О защите прав потребителей»):
товары (работы,
услуги), на которые в государственных стандартах установлены требования, направленные на
обеспечение безопасности жизни, здоровья потребителей и охраны окружающей среды, а также на предотвращение вреда имуществу потребителей;средства, обеспечивающие безопасность жизни и здоровья потребителей.
Слайд 21Обязательному подтверждению соответствия при реализации на фармацевтическом рынке подлежат :
Лекарственные
средства, выпускаемые предприятиями-производителями на территории РФ, а также импортные ЛС,
ввозимые на территорию РФ;Медицинские изделия (кроме некоторых видов медицинской техники класса 94 по ОКП 005-93);
Биологически активные добавки (БАД);
Парфюмерно-косметическая продукция, парафармацевтика, товары для детей и др.
Слайд 22Декларирование соответствия
(форма обязательного подтверждения соответствия)
Общие принципы декларирования соответствия и
требования к оформлению декларации о соответствии установлены статьей 24 Федерального
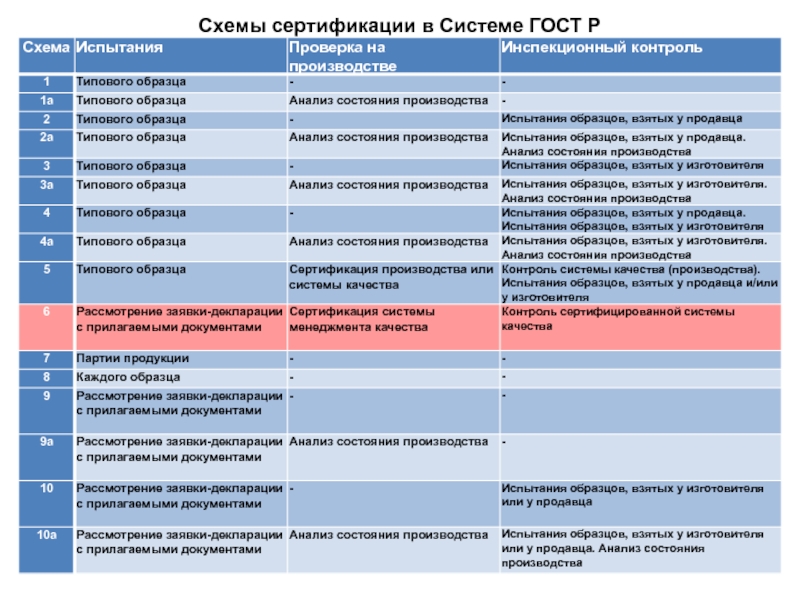
закона РФ от 27.12.2002 г. № 184-ФЗ «О техническом регулировании».В системе ГОСТ Р схемы сертификации — это определенный порядок последовательных действий, в соответствии с которым проводится процедура сертификации качества продукции. Всего существует более 10 различных схем сертификации.
Слайд 24Схемы сертификации и декларирования соответствия
Декларирование соответствия ЛС осуществляется по одной
из следующих схем:
принятие декларации о соответствии на основании собственных
доказательств;принятие декларации о соответствии на основании собственных доказательств и доказательств, полученных с участием органа по сертификации и (или) аккредитованной испытательной лаборатории (центра).
Слайд 25Декларация о соответствии
Декларация о соответствии – документ, удостоверяющий
соответствие выпускаемой в обращение продукции требованиям технических регламентов.
Оформленная
декларация о соответствии подлежит регистрации органом, уполномоченным Федеральным агентством по техническому регулированию и метрологии (РОССТАНДАРТ). Декларация приобретает юридическую силу только после регистрации в органе по сертификации (ОС).
Слайд 26Форма
декларации
о соответствии
Форма декларации о соответствии продукции требованиям технических
регламентов, а также рекомендации по ее заполнению утверждены Приказом Минпромэнерго
РФ от 22.03.2006 г. № 54 «Об утверждении формы декларации о соответствии продукции требованиям технических регламентов».Слайд 27Содержание декларации о соответствии
Декларация о соответствии оформляется на
русском языке и должна содержать:
наименование и местонахождение заявителя и (или)
изготовителя;информацию об объекте подтверждения соответствия, позволяющую однозначно идентифицировать этот объект;
наименование технического регламента (или НД), на соответствие требованиям которого подтверждается продукция;
указание на схему декларирования соответствия (рекомендуется);
заявление заявителя о безопасности продукции при ее использовании в соответствии с целевым назначением и принятии заявителем мер по обеспечению соответствия продукции требованиям технических регламентов;
сведения о проведенных исследованиях (испытаниях) и измерениях, сертификате системы качества, а также документах, послуживших основанием для подтверждения соответствия продукции требованиям;
срок действия декларации о соответствии;
иные предусмотренные соответствующими техническими регламентами сведения.
Декларация о соответствии и сертификат соответствия имеют равную юридическую силу.
Слайд 29Декларирование соответствия лекарственных средств
С 1 января 2007 года обязательная сертификация
лекарственных средств заменена декларированием соответствия (т.е. другой формой обязательного подтверждения
соответствия)Декларирование упрощает для изготовителя (продавца) ЛС процесс обязательного подтверждения соответствия установленным требованиям, а также повышает его ответственность, что направлено на защиту российского потребительского рынка от некачественных и опасных ЛС.
После 1 января 2007 года изготовитель (продавец) ЛС может самостоятельно отдавать образцы на испытания в любые аккредитованные независимые лаборатории (центры), оформлять декларацию о соответствии и регистрировать её в любом аккредитованном органе по сертификации.
Слайд 30Декларация о соответствии лекарственного препарата
Декларация о соответствии принимается в отношении
каждой серии (партии) лекарственного средства, выпускаемой в обращении на срок,
установленный изготовителем (продавцом), но не более установленного срока годности, и подписывается руководителем организации-изготовителя (продавца).Принятая декларация считается зарегистрированной с даты ее внесения в реестр зарегистрированных деклараций о соответствии органа по сертификации и имеет юридическую силу на всей территории Российской Федерации.
В настоящее время провести идентификацию сведений о декларации соответствия можно по базе зарегистрированных деклараций, размещенной на сайте ФГУ «Центр экспертизы и контроля качества медицинской продукции» Росздравнадзора http://www.fgusertif.ru/
.
Слайд 31Документы, которые могут являться основанием для принятия изготовителем (продавцом, исполнителем)
декларации
протоколы приемочных, приемо-сдаточных и других контрольных испытаний продукции, проведенных изготовителем
(продавцом, исполнителем) и/или сторонними компетентными испытательными лабораториями; сертификаты соответствия или протоколы испытаний на сырье, материалы, комплектующие изделия;
документы, предусмотренные для данной продукции соответствующими федеральными законами и выданные уполномоченными на то органами и организациями (гигиенические заключения, ветеринарные свидетельства, сертификаты пожарной безопасности и др.);
сертификаты на систему качества или производства;
другие документы, прямо или косвенно подтверждающие соответствие продукции установленным требованиям.
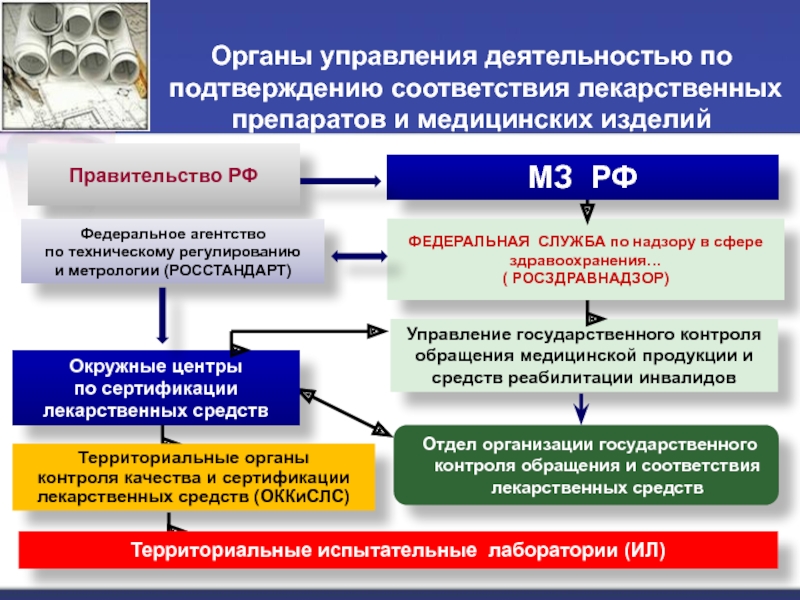
Слайд 32Органы управления деятельностью по подтверждению соответствия лекарственных препаратов и медицинских
изделий
Правительство РФ
МЗ РФ
ФЕДЕРАЛЬНАЯ СЛУЖБА по надзору в сфере здравоохранения…
( РОСЗДРАВНАДЗОР)
Федеральное
агентствопо техническому регулированию
и метрологии (РОССТАНДАРТ)
Управление государственного контроля обращения медицинской продукции и средств реабилитации инвалидов
Отдел организации государственного контроля обращения и соответствия лекарственных средств
Окружные центры
по сертификации лекарственных средств
Территориальные органы
контроля качества и сертификации лекарственных средств (ОККиСЛС)
Территориальные испытательные лаборатории (ИЛ)
Слайд 33Федеральная служба по надзору в сфере здравоохранения
(РОСЗДРАВНАДЗОР)
осуществляет комплексное управление
и определяет единую политику в области подтверждения соответствия медицинской продукции
и лекарственных средств в РФ, участвует в аккредитации научных центров экспертизы и органов по сертификации (ОС).Ведет единый перечень аккредитованных Органов по сертификации (ОС) и Центров контроля качества ЛП (публикует в ведомственных изданиях и в Интернете).
Слайд 34Орган по сертификации
это – юридическое лицо (или индивидуальный предприниматель), аккредитованное
для выполнения работ по сертификации (центры по сертификации лекарственных средств
и медицинской продукции).Он осуществляет:
оценку и подтверждение соответствия,
регистрацию деклараций соответствия (на ЛС, БАД, ИМН),
предоставляет заявителям право на применение знака соответствия национальному стандарту,
приостанавливает или прекращает действие выданных сертификатов соответствия и зарегистрированных деклараций в необходимых случаях.
Слайд 35Полномочия аккредитованных Центров сертификации и контроля качества ЛС
В соответствии с
положениями действующих нормативных актов (на сегодняшний день) в область аккредитации
центров сертификации и контроля качества, включены лекарственные средства, идентифицируемые по ОК (ОКП) 005-93 кодами подклассов продукции ОКП 931000, 932000, 933000, 934000, 935000, 936000, 937000 (в том числе группы, подгруппы, виды продукции).Слайд 36Полномочия аккредитованных Центров сертификации и контроля качества ЛП
Центры контроля качества
вправе:
осуществлять инспекционный контроль в отношении сертифицированной ими продукции один раз
в 6 месяцев (если это предусмотрено схемой сертификации);привлекаться Росздравнадзором для проведения экспертизы качества, безопасности и эффективности ЛС на основании договоров с федеральной службой и ее территориальными органами в соответствии с полученным заданием (общим или частным);
регистрировать декларации о соответствии качества продукции установленным требованиям при наличии соответствующей аккредитации.
Слайд 37Информация для потребителя о качестве лекарственных препаратов
Документы, НЕОБХОДИМЫЕ при реализации
ЛП (один из перечисленных):
Декларация о соответствии;
Копия декларации о соответствии, заверенная
держателем декларации;Товарно-сопроводительные документы (в том числе, например, реестр сертификатов или деклараций), заверенные подписью и печатью производителя (поставщика, продавца).
Слайд 38Необходимые сведения о подтверждении соответствия товара
в товарно-сопроводительных документах:
Товарно-сопроводительные документы
(ТСД) — это документы, содержащие необходимую и достаточную информацию для
идентификации товарных партий на всем пути их товародвижения (коммерческая информация).В ТСД на лекарственные препараты, ИМН и БАД должна быть информация о качестве товара:
Регистрационный номер декларации о соответствии;
Срок действия декларации;
Наименование изготовителя или поставщика (продавца), принявшего декларацию;
Орган, зарегистрировавший декларацию.
На ПФТ, не подлежащие декларированию:
Номер сертификата соответствия; Срок его действия;
Орган, выдавший сертификат.