з лужними металами і заміщувати гідроксильні атоми водню атомами металу
з утворенням речовин, які називають алкоголятами. Наприклад:
2C₂H₅—OH + 2Na → 2C₂H₅—ONa + H₂↑.
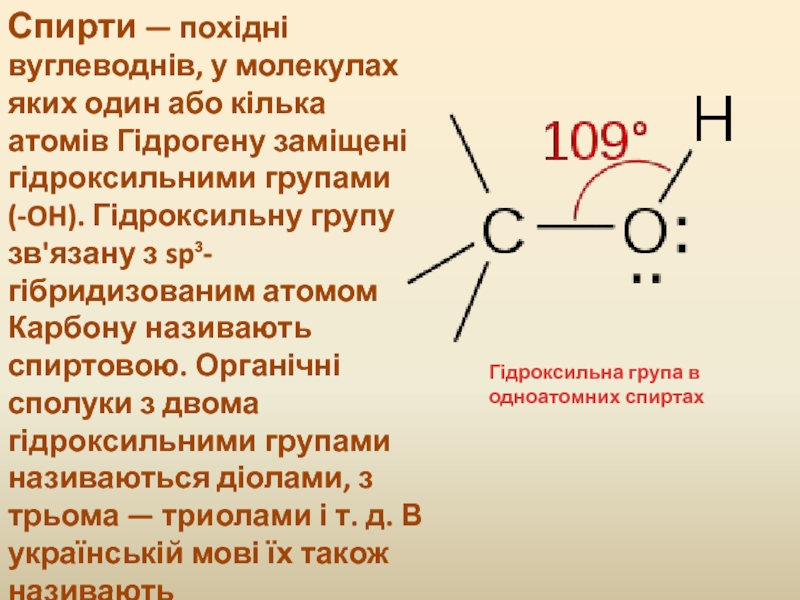
Інші атоми Гідрогену, котрі зв'язані безпосередньо з Карбоном, у реакцію не вступають. На прикладі цих реакцій науковці вперше зустрілись з явищем впливу одних атомів на інші в молекулі. Суть цього впливу можна показати на прикладі молекули етилового спирту, електронну будову якої можна зобразити в такому вигляді:
Гідроксильний атом Гідрогену займає в молекулі особливе положення. На відміну від інших атомів Гідрогену, він не безпосередньо зв'язаний з атомом Карбону, а через Оксиген. Атом Оксигену, як активніший елемент більше, ніж Карбон, відтягує до себе спільну електронну пару. Внаслідок цього гідроксильний атом Гідрогену слабкіше зв'язаний в молекулі, ніж інші атоми Гідрогену, і є більш «рухливим», тому порівняно легко витісняється атомом металу. Реакції спиртів з металами в дечому нагадують реакції кислот з металами. В молекулах спиртів гідроксильні атоми Гідрогену значно тісніше зв'язані з Оксигеном, ніж у молекулах кислот. Тому спирти на відміну від кислот не дисоціюють у воді і іонів Гідрогену не утворюють.
У спиртах можуть заміщатися не лише гідроксильні атоми Гідрогену, а і вся гідроксильна група. Наприклад, при нагріванні етилового спирту з бромоводнем утворюється бромоетан: