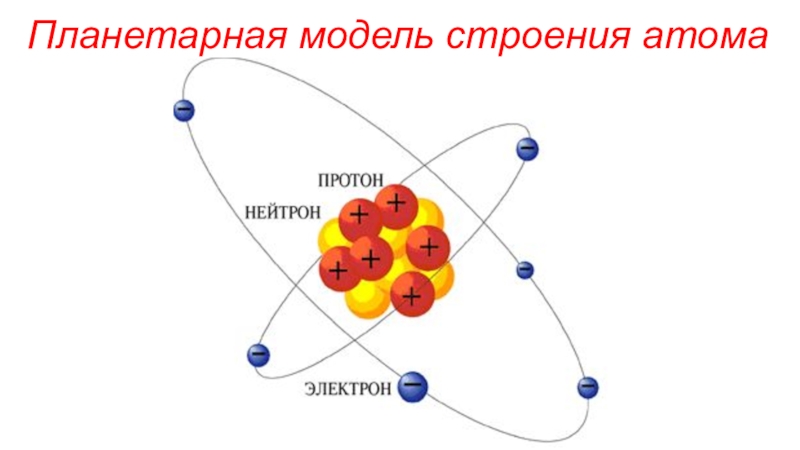
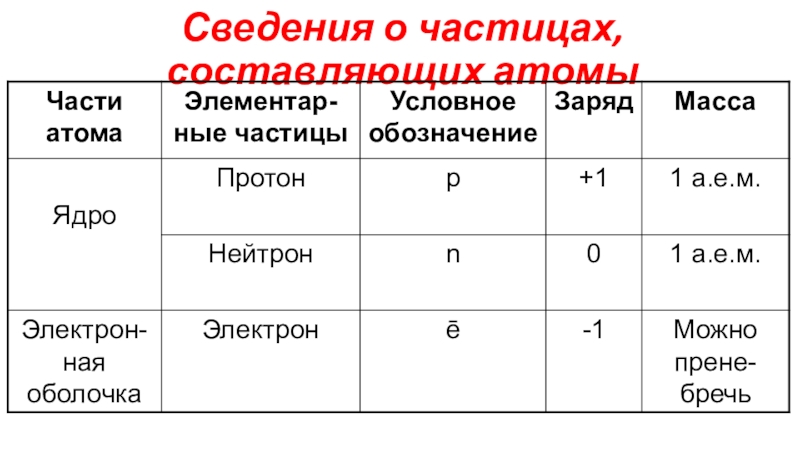
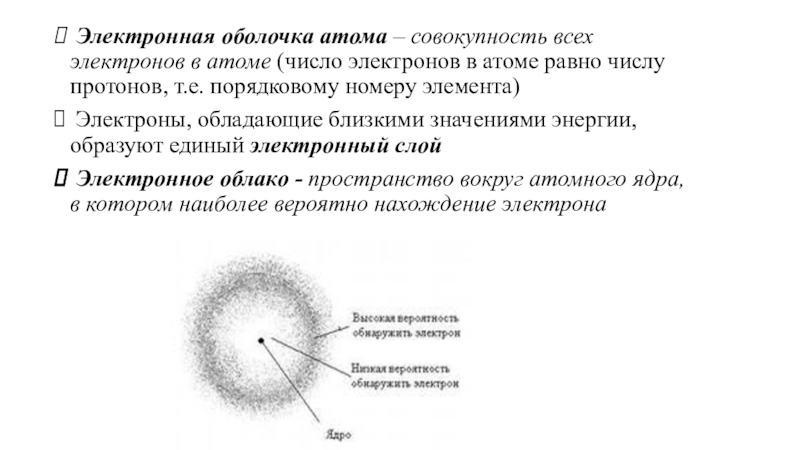
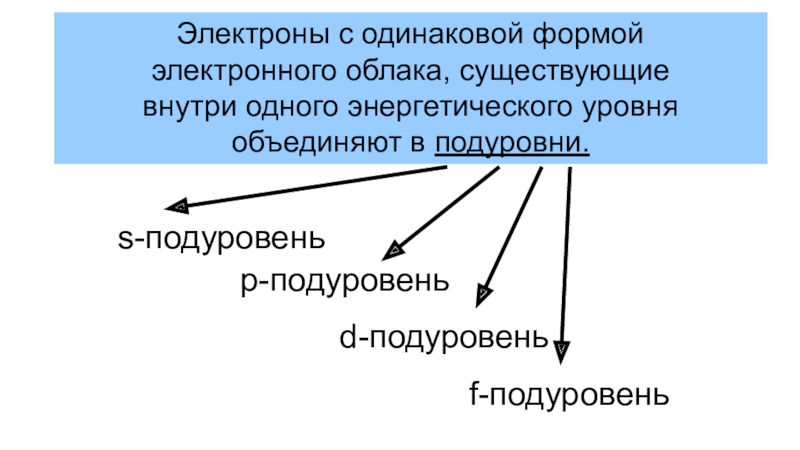
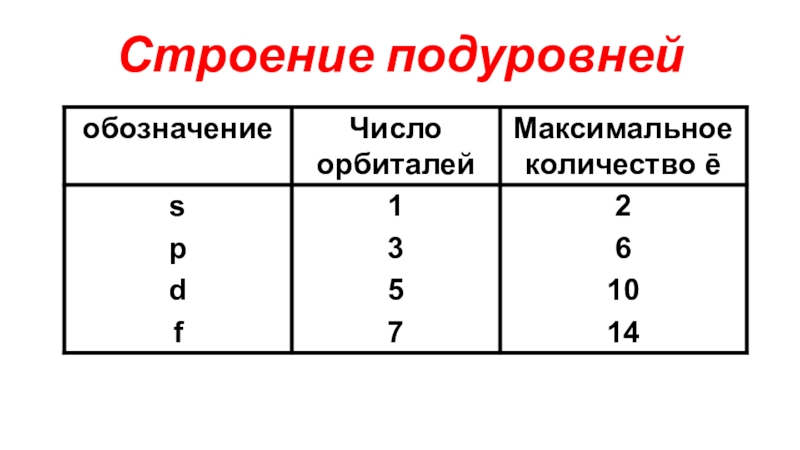
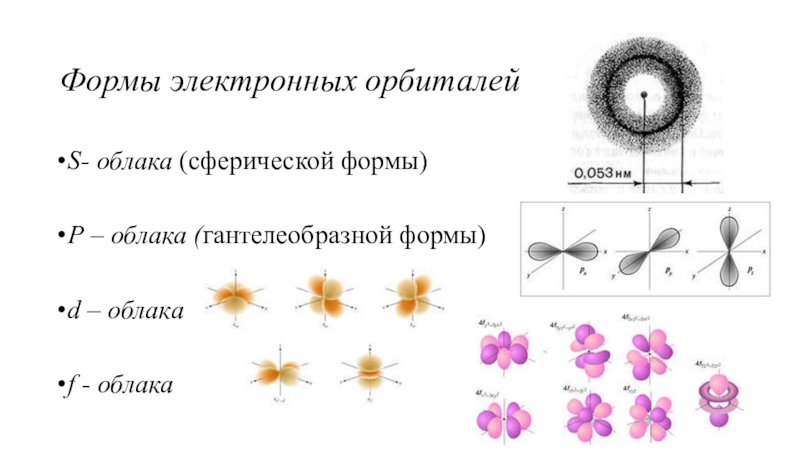
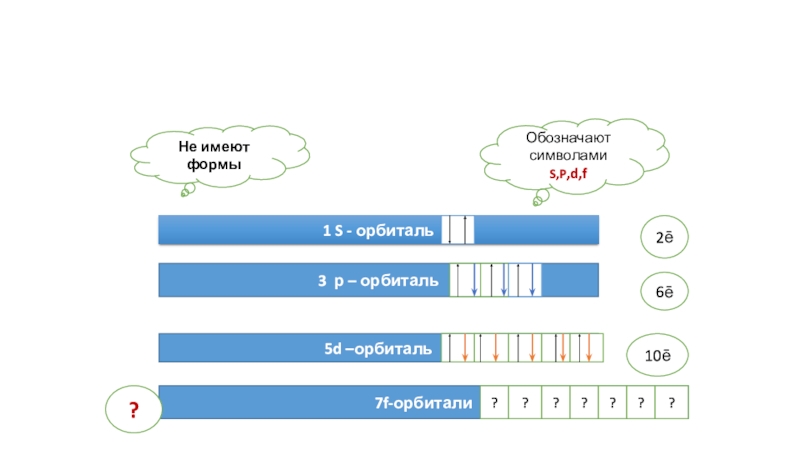
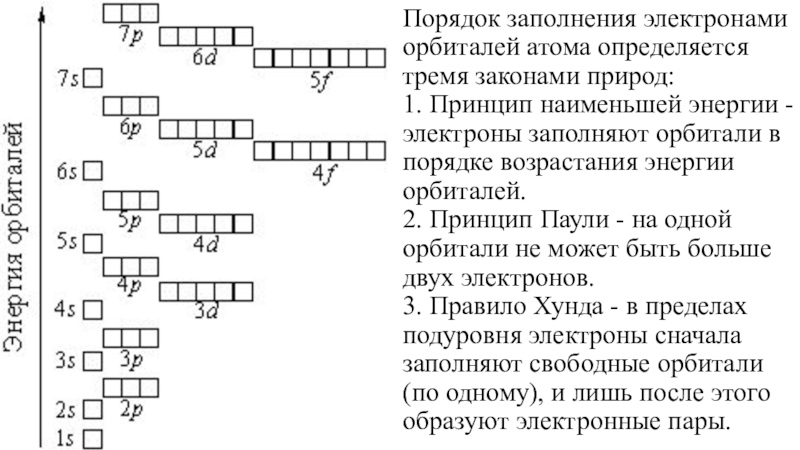
(число электронов в атоме равно числу протонов, т.е. порядковому номеру
элемента)Электроны, обладающие близкими значениями энергии, образуют единый электронный слой
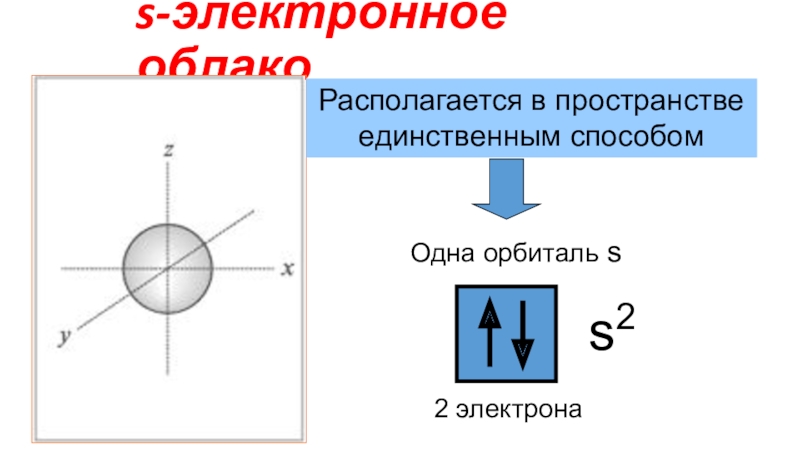
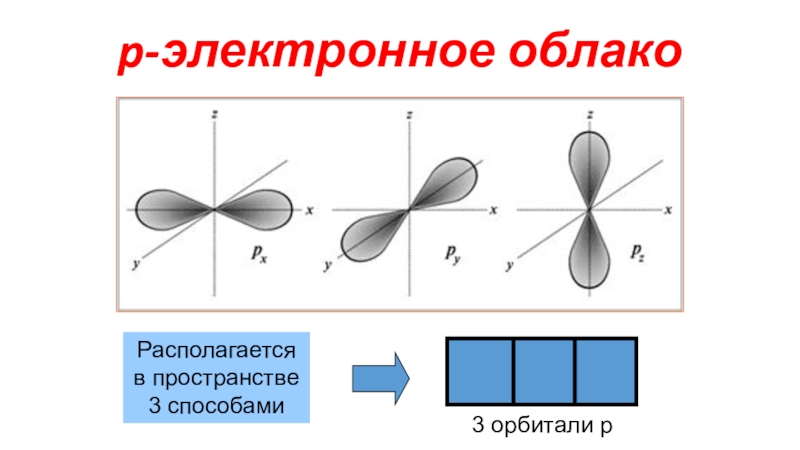
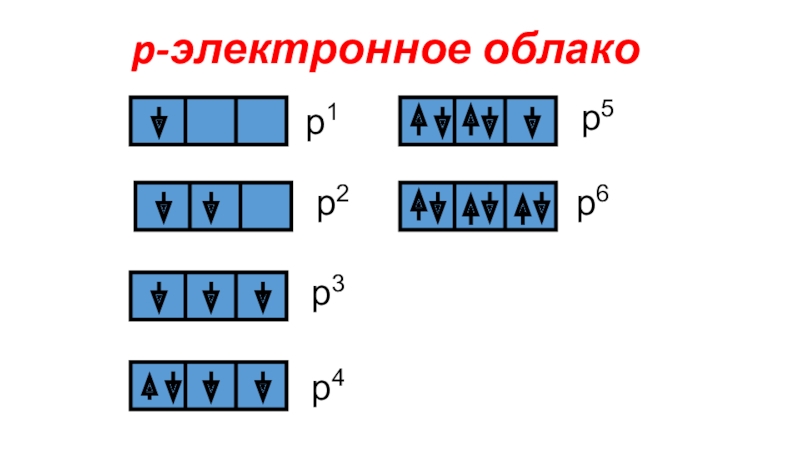
Электронное облако - пространство вокруг атомного ядра, в котором наиболее вероятно нахождение электрона