Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Неорганические вещества
Содержание
- 1. Неорганические вещества
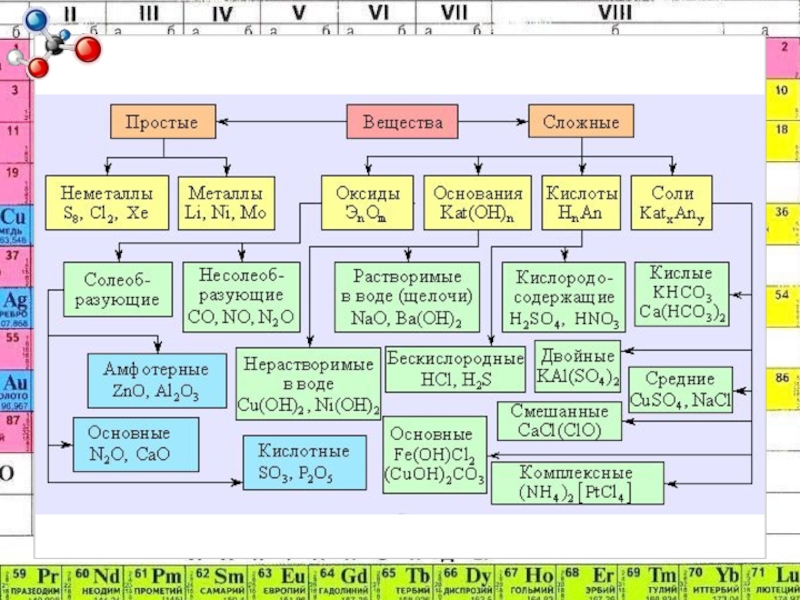
- 2. Химияорганическая:изучает органические вещества(CxHy)неорганическая:изучает неорганические веществасложныеМет.НеМет.простые
- 3. Слайд 3
- 4. Слайд 4
- 5. Слайд 5
- 6. ОксидыСоединения таких элементов, один из которых кислород
- 7. Слайд 7
- 8. СОЛЕОБРАЗУЮЩИЕНЕСОЛЕОБРАЗУЮЩИЕ
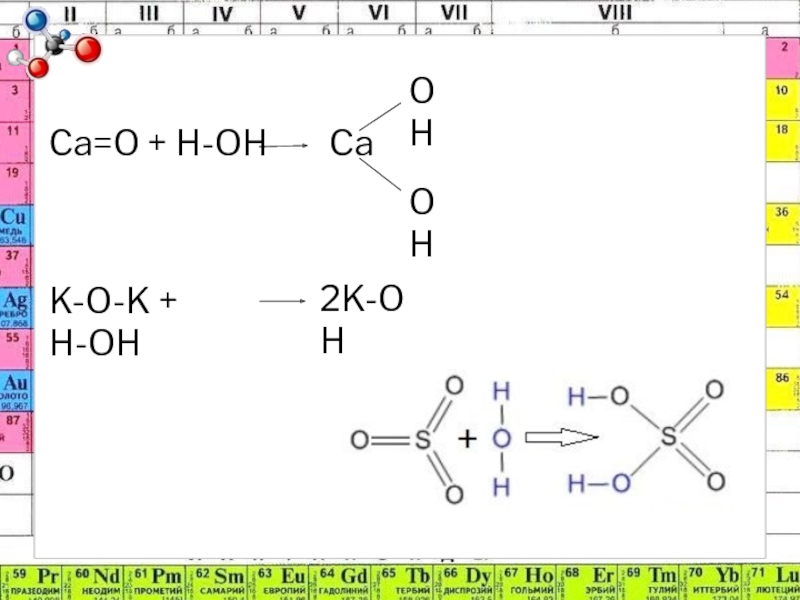
- 9. Ca=O + H-OH CaOHOHK-O-K + H-OH2K-OH
- 10. Al2O3, Al(OH)3, H3AlO3, HAlO2.ортометаСпособны диссоциировать как по типу оснований, так и по типу кислот.
- 11. Слайд 11
- 12. Слайд 12
- 13. Слайд 13
- 14. Слайд 14
- 15. Слайд 15
- 16. Слайд 16
- 17. Слайд 17
- 18. Слайд 18
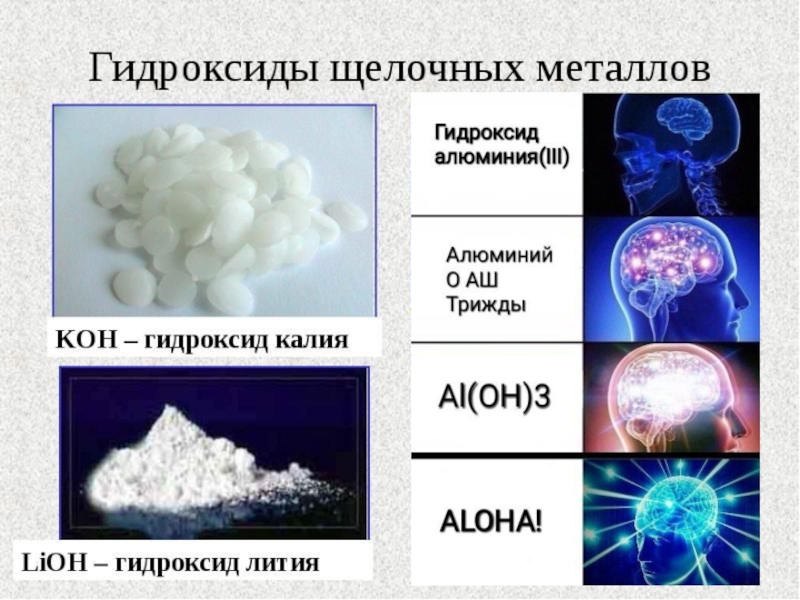
- 19. ОснованияЭто электролиты, которые при диссоциации образуют катионы
- 20. Слайд 20
- 21. Слайд 21
- 22. Слайд 22
- 23. КислотыЭлектролиты, которые при диссоциации образуют только катионы водорода и анионы кислотных остатков.HxAc
- 24. Слайд 24
- 25. Слайд 25
- 26. HF – фтороводородная (плавиковая)HI – йодороводороднаяHBr –
- 27. Слайд 27
- 28. СолиHCl + NaOH => NaCl + H2OCu(OH)2
- 29. КЛАССИФИКАЦИЯ СОЛЕЙ
- 30. Соли
- 31. Задание № 1. Дайте названия веществам, формулы которых: HNO3,
- 32. Вариант 1HNO3, Ba(OH)2, MgSO4, HCN, BeO, (CuOH)2,
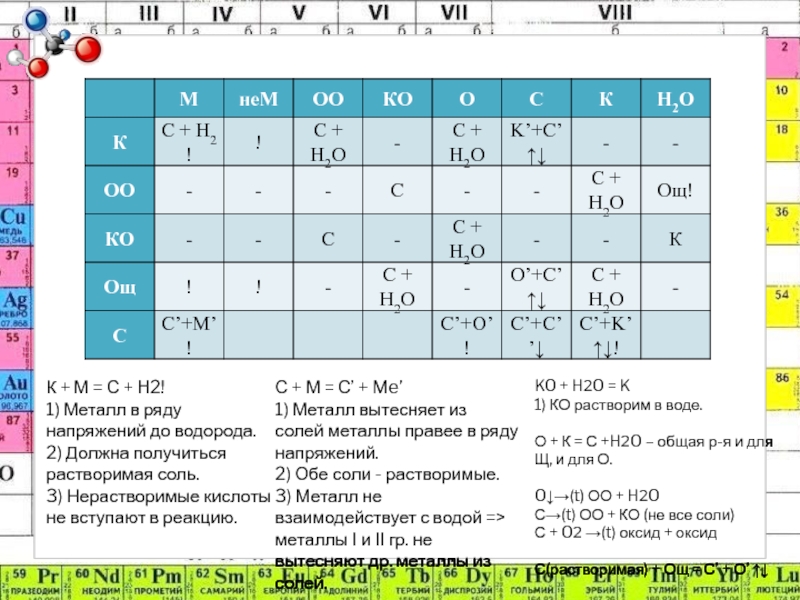
- 33. К + М = С + H2!
- 34. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Химия
органическая:
изучает органические вещества
(CxHy)
неорганическая:
изучает неорганические вещества
сложные
Мет.
НеМет.
простые
Слайд 6Оксиды
Соединения таких элементов, один из которых кислород со степенью окисления
-2.
(кислота или основание)Слайд 10Al2O3, Al(OH)3, H3AlO3, HAlO2.
орто
мета
Способны диссоциировать как по типу оснований, так
и по типу кислот.
Слайд 19Основания
Это электролиты, которые при диссоциации образуют катионы металлов и только
один вид анионов – гидроксид-ионы OH-.
Мx(ОН)y
Электролитическая диссоциация – распад электролитов
на ионы.Слайд 23Кислоты
Электролиты, которые при диссоциации образуют только катионы водорода и анионы
кислотных остатков.
HxAc
Слайд 26HF – фтороводородная (плавиковая)
HI – йодороводородная
HBr – бромоводородная
HCN – циановодородная
(синильная)
HClO2 – хлористая
HClO3 –хлорноватая
HClO4 – хлорная
H2MnO4 – марганцовистая
HMnO4 - марганцовая
Слайд 28Соли
HCl + NaOH => NaCl + H2O
Cu(OH)2 + H2SO4 =>
CuSO4 + 2H2O
Реакция нейтрализации
CuO + H2SO4 => CuSO4 +
H2OSO2 + 2KOH = K2SO3 + H2O
Слайд 31Задание № 1.
Дайте названия веществам, формулы которых: HNO3, MgSO4, NaNO2, Al(OH)3,
FeO, KCl, H2SO3, HI.
Задание № 2. Составьте формулы веществ, названия которых:
сульфит бария, хлорид алюминия, ортофосфорная кислота, оксид магния, оксид серы (VI), угольная кислота, гидроксид бария, фтороводородная кислота.Слайд 32Вариант 1
HNO3, Ba(OH)2, MgSO4, HCN, BeO, (CuOH)2, CO3,Na2O, AlPO4, CrO3,Cu(OH)2,SrO,
HClO4, KOH, P2O3, H2S, Ca(HCO3)2
Вариант 2
Al2O3, NaOH, HBF4, BaO, H2SiO3,
Mg(OH)2, FeO, HMnO4, Fe(NO3)3, HF, Mg(HCO3)2, P2O5, WO3, (AlOH)Cl2, AgJ, Ca(OH)2Вариант 3
KHCO3, CaO, CuS, H2SO3, Ga2O3, Ba(OH)2, Na2O, Ca3(PO4)2, SiO2, HCl, LiOH, FeOHSO4, Ni(OH)2, MoO3, HSCN
Вариант 4
ZnO, CsOH, (CuOH)2SO4, Co(OH)2, BaO, NaHCO3, Sr(OH)2, H2SO4, CuO, Na2SiO3, HBr, V2O5, H2S, Cl2O7, K2CO3, HClO3
Распределите их по классам:
Слайд 33К + М = С + H2!
1) Металл в
ряду напряжений до водорода.
2) Должна получиться растворимая соль.
3) Нерастворимые кислоты
не вступают в реакцию.С + М = С’ + Me’
1) Металл вытесняет из солей металлы правее в ряду напряжений.
2) Обе соли - растворимые.
3) Металл не взаимодействует с водой => металлы I и II гр. не вытесняют др. металлы из солей.
KO + H2O = K
1) КО растворим в воде.
О + К = С +H2O – общая р-я и для Щ, и для О.
O↓→(t) ОО + H2O
С→(t) ОО + КО (не все соли)
С + O2 →(t) оксид + оксид
С(растворимая) + Ощ = С’ + О’ ↑↓