Слайд 1Строение атома
История развития представлений о
строении вещества
Слайд 2
Все тела живой и неживой природы, несмотря на их разнообразие,
состоят из мельчайших частиц — атомов.
Первым, кто высказал предположение об этом, считается древнегреческий философ Демокрит.
Именно он назвал атомом мельчайшую неделимую частицу образующую вещество (атом в переводе с др.греч «неделимый»).
Лишь в конце XIX в. были сделаны открытия, показавшие сложность строения атома, что атомы разлагаются на более мелкие элементарные частицы и таким образом «атомами» в Демокритовском смысле не являются.
Тем не менее, термин используется и теперь в современной химии и физике, несмотря на несоответствие его этимологии современным представлениям о строении атома.
Слайд 3
Демокрит -
древнегреческий
философ
(460 г.до н.э.- 370 г. до
н.э.)
Всё в природе состоит из неделимых малых тел – атомов.
Многообразие атомов объясняет многообразие окружающего мира.
Атомы – «кирпичики мироздания».
Слайд 4В 1897 г. английский физик Дж. Томсон изучая катодные лучи,
пришел к выводу, что атомы любого вещества содержат отрицательно заряженные
частицы, которые он назвал электронами.
Огромной заслугой Томсона явилось доказательство того, что все частицы, образующие катодные лучи, тождественны друг другу и входят в состав вещества.
Он предложил первую модель атома — «пудинг с изюмом» 1904 г.
По мысли Томсона, положительный заряд атома занимает весь его объем и распределен в этом объеме с постоянной плотностью. В этой положительно заряженной сфере находится несколько электронов так, что атом в целом нейтрален.
Атом подобен кексу, в котором роль изюминок играют электроны.
Слайд 5Атом состоит из положительно заряженной материи, в которую вкраплены электроны.
В целом атом нейтрален. Размеры атома: R = 10-10м
Джозеф Джон
Томсон
1856-1937)
(
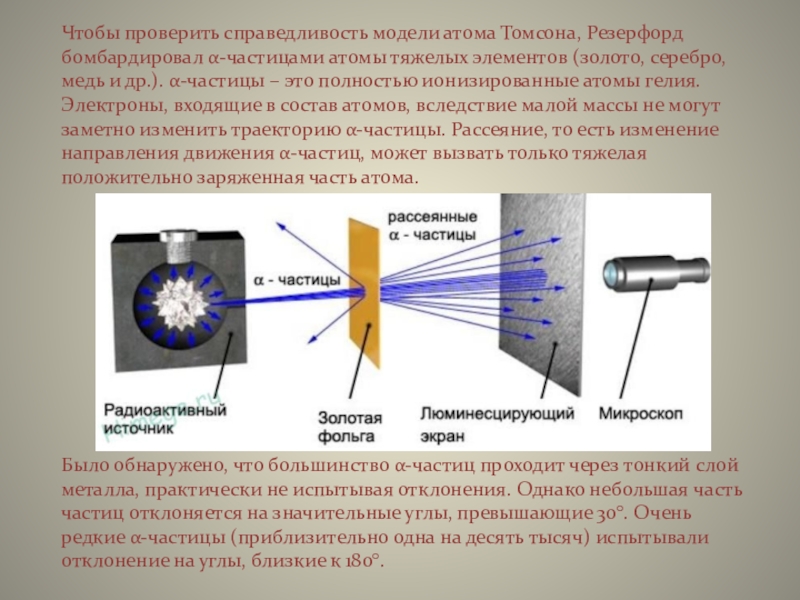
Слайд 7Чтобы проверить справедливость модели атома Томсона, Резерфорд бомбардировал α-частицами атомы
тяжелых элементов (золото, серебро, медь и др.). α-частицы – это
полностью ионизированные атомы гелия. Электроны, входящие в состав атомов, вследствие малой массы не могут заметно изменить траекторию α-частицы. Рассеяние, то есть изменение направления движения α-частиц, может вызвать только тяжелая положительно заряженная часть атома.
Было обнаружено, что большинство α-частиц проходит через тонкий слой металла, практически не испытывая отклонения. Однако небольшая часть частиц отклоняется на значительные углы, превышающие 30°. Очень редкие α-частицы (приблизительно одна на десять тысяч) испытывали отклонение на углы, близкие к 180°.
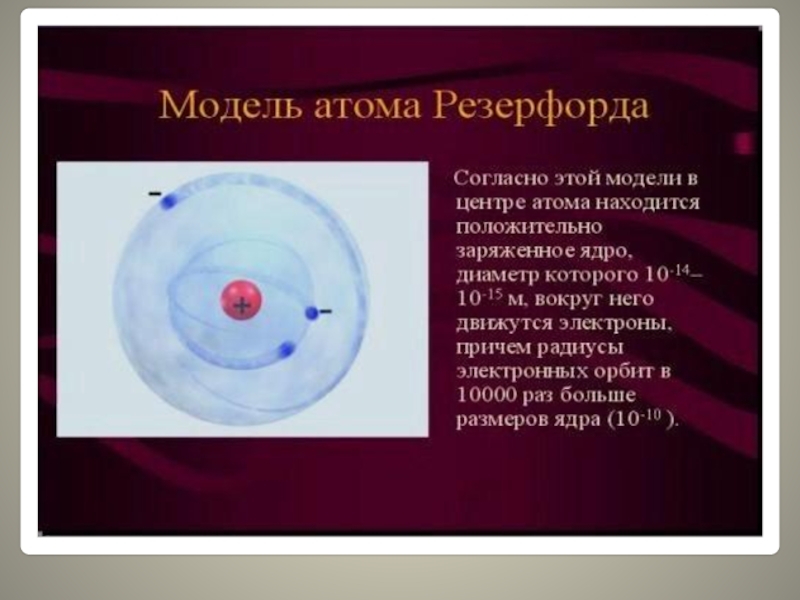
Слайд 9Эти соображения привели Резерфорда к выводу, что атом почти пустой,
и весь его положительный заряд сосредоточен в малом объеме.
Эту часть атома Резерфорд назвал атомным ядром.
Так возникла ядерная модель атома (планетарная):
1. В центре атома находится положительно заряженное ядро, занимающее ничтожную часть пространства внутри атома.
2. Весь положительный заряд и почти вся масса атома сосредоточены в его ядре (масса электрона равна 1/1823 а.е.м.).
3. Вокруг ядра вращаются электроны. Их число равно положительному заряду ядра.
Слайд 11Атом состоит из положительно заряженного ядра, в котором сосредоточена
практически вся масса атома.
Вокруг ядра движутся электроны. Заряд ядра равен суммарному заряду всех электронов, поэтому атом нейтрален.
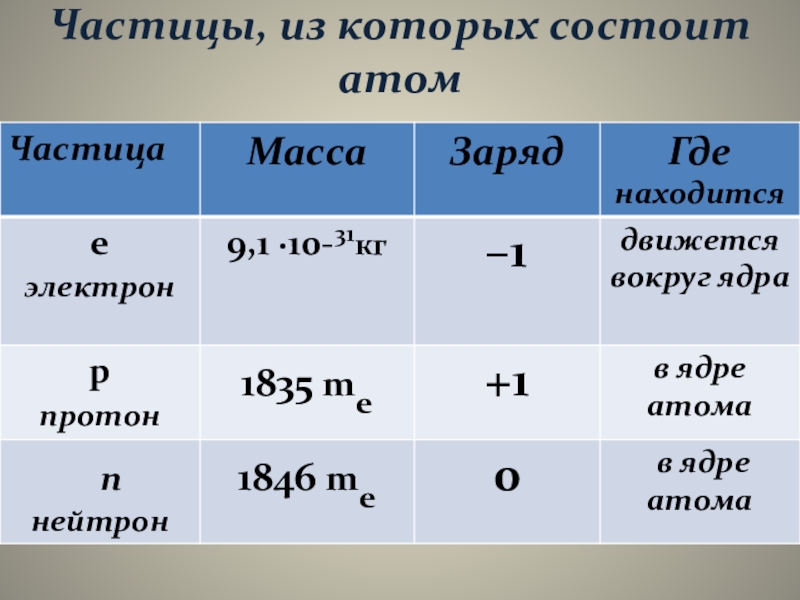
Слайд 13Частицы, из которых состоит атом
Слайд 14Атом не имеет заряда, но в результате различных процессов может
потерять или присоединить к себе электроны и тогда превращается в
ион:
+ ион – атом, потерявший один или несколько электронов .
( N p > N e )
- ион – атом, присоединивший к себе один или несколько электронов.
( N p < N e )
Слайд 15Планетарная модель атома великолепно объясняла рассеяние
α частиц,
но на основе этой модели нельзя объяснить факт существования атома, его устойчивость.
Ведь движение электронов по орбитам происходит с ускорением, причем весьма немалым. Ускоренно движущийся электрон по законам электродинамики должен терять энергию и приближаться к ядру. Как показывают расчеты, основанные на механике Ньютона и электродинамике Максвелла, электрон за ничтожное время должен упасть на ядро. Атом должен прекратить свое существование.
В действительности ничего подобного не происходит. Атомы устойчивы и в невозбужденном состоянии могут существовать неограниченно долго, совершенно не излучая электромагнитные волны. Не согласующийся с опытом вывод о неизбежной гибели атома вследствие потери энергии на излучение — это результат применения законов классической физики к явлениям, происходящим внутри атома.
Отсюда следует, что к явлениям атомных масштабов законы классической физики неприемлемы.
Слайд 17Выход из создавшийся ситуации нашёл датский физик Нильс Бор (1885
— 1962). Он считал что поведение микрочастиц нельзя описывать теми
же законами, которыми описывают поведение макроскопических тел.
Бор предположил, что величины характеризующие микромир, должны квантоваться, т.е. они могут принимать только определенные дискретные значения.
Законы микромира — квантовые законы! Эти законы в начале 20 столетия еще не были установлены наукой. Бор сформулировал их в виде двух постулатов. дополняющих ( и «спасающих») атом Резерфорда.
Его теория впоследствии привела к созданию стройной теории движения микрочастиц — квантовой механики.
Слайд 18Первый постулат Бора:
атомная система может находиться только в особых стационарных, или квантовых, состояниях, каждому из которых соответствует определенная энергия Еn. В стационарном состоянии атом не излучает.
Второй постулат Бора:
излучение света происходит при переходе атома из стационарного состояния с большей энергией Еk в стационарное состояние с меньшей энергией Еn . Энергия излученного фотона равна разности энергий стационарных состояний:
hν = Еk - Еn