Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
ТЕМА БИОХИМИЯ КРОВИ и ЭРИТРОЦИТОВ
Содержание
- 1. ТЕМА БИОХИМИЯ КРОВИ и ЭРИТРОЦИТОВ
- 2. План лекциифункции кровисостав кровиосновные свойства белковых фракций
- 3. ФУНКЦИИ КРОВИТранспортнаяДыхательнаяТрофическаяВыделительнаяРегуляторнаяЗащитнаяТерморегуляторнаяРегуляция водно-солевого и кислотно-основного баланса
- 4. ФУНКЦИИ КРОВИ1. Транспортная функция. Циркулируя по сосудам,
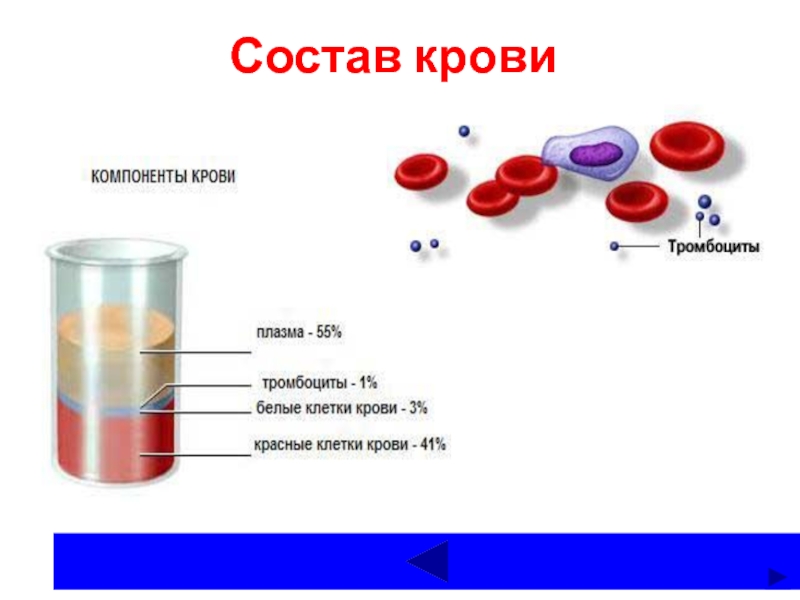
- 5. Состав крови
- 6. Общее количество крови в организме взрослого человека
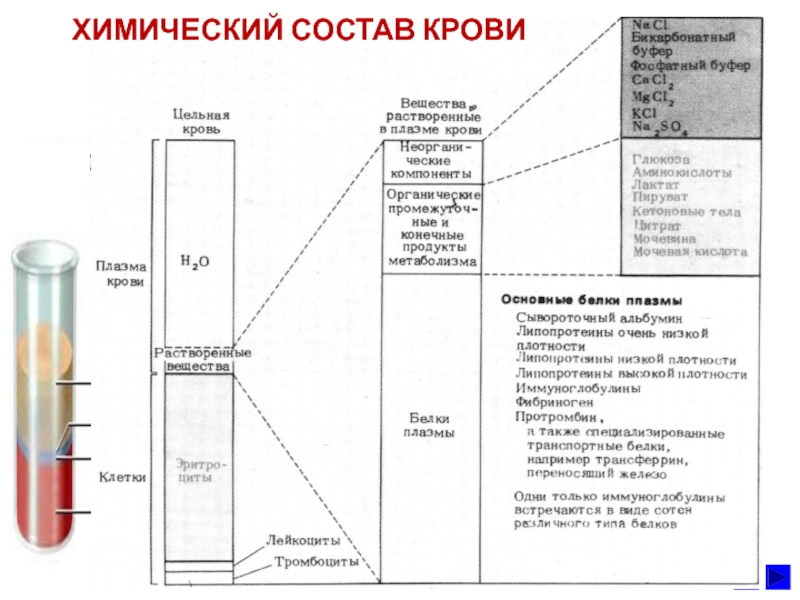
- 7. ХИМИЧЕСКИЙ СОСТАВ КРОВИ
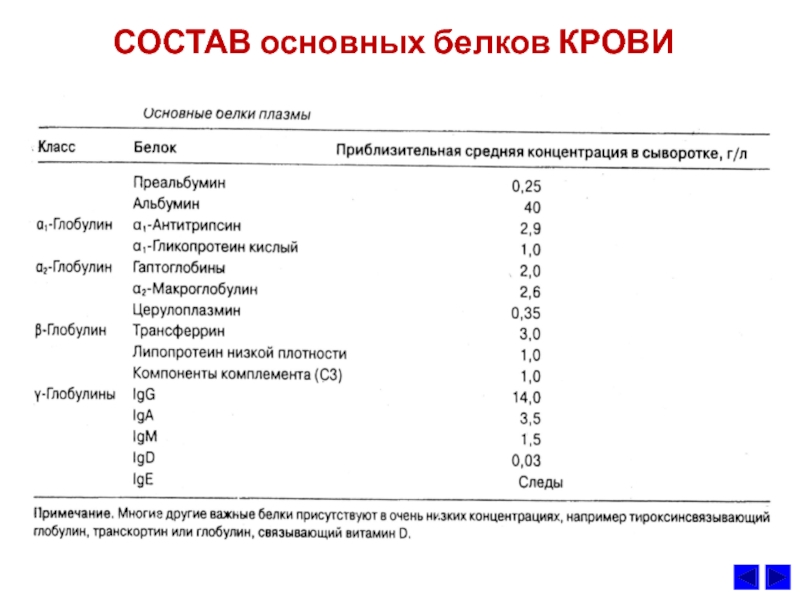
- 8. СОСТАВ основных белков КРОВИ
- 9. Основные свойства белковых фракций крови и их
- 10. Слайд 10
- 11. Методом электрофореза на ацетилцеллюлозе или геле агарозы
- 12. Протеинограммы белковых фракций крови при различных патологических состояниях
- 13. Основные биохимические механизмы гомеостазаПовреждение кровеносного сосуда вызывает
- 14. Компоненты свертывающей системы крови белки свертывающей системы
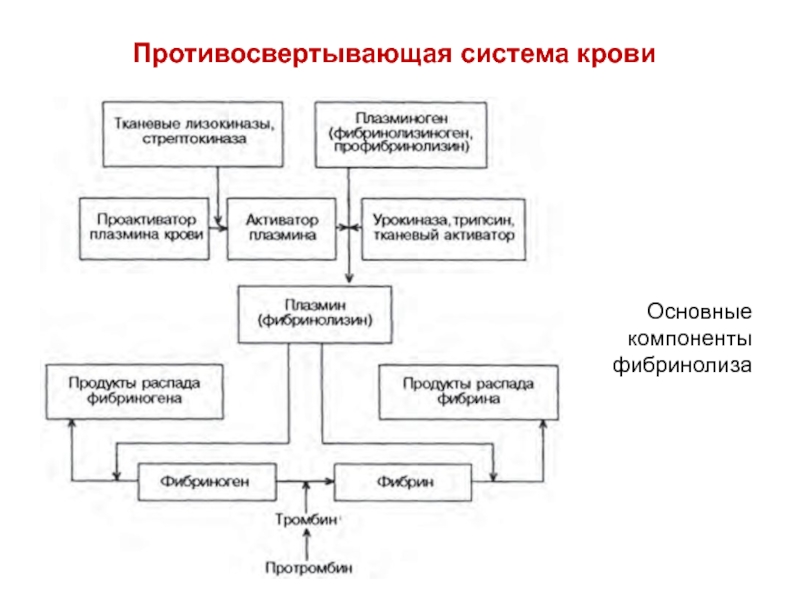
- 15. Противосвертывающая система крови Основные компоненты фибринолиза
- 16. Эритроциты и гемоглобинЭритроциты занимают 36-48% объема крови.В
- 17. ГЕМОГЛОБИН. Строение
- 18. ГемоглобинГемоглобин (Hb) - сложный олигомерный белок гемопротеин,
- 19. Гемоглобин (Hb) - сложный олигомерный белок -
- 20. ГЕМОГЛОБИН
- 21. МиооглобинМиоглобин (Mb) – мономерный белок, содержится в
- 22. Расположение гема и О2 в активном центре
- 23. Изменение конфомации других цепей облегчает их взаимодействие
- 24. СО2 и Н+, образующиеся при катаболизме органических
- 25. В легких высокое парциальное давление кислорода способствует
- 26. А – влияние концентрации СО2 и Н+
- 27. КИСЛОТНО-ОСНОВНОЕ РАВНОВЕСИЕ
- 28. Нормальные формы гемоглобинаСуществует несколько нормальных вариантов гемоглобина:HbР –
- 29. Патологические формы гемоглобинаHbS – гемоглобин серповидно-клеточной анемии.MetHb – метгемоглобин, форма
- 30. Обмен железа Железо является необходимым биохимическим компонентом в
- 31. Распределение железа в организме
- 32. Обмен железа в организме состоит из нескольких
- 33. Основным местом всасывания железа является тонкий кишечник.
- 34. Слайд 34
- 35. Основными формами депонированного железа являются ферритин и
- 36. - Железо поступает с пищей, транспортируется в
- 37. Нарушения обмена железаСиндром перегрузки Fe – гемосидерозПервичный
- 38. СИНТЕЗ ГЕМА и его регуляция
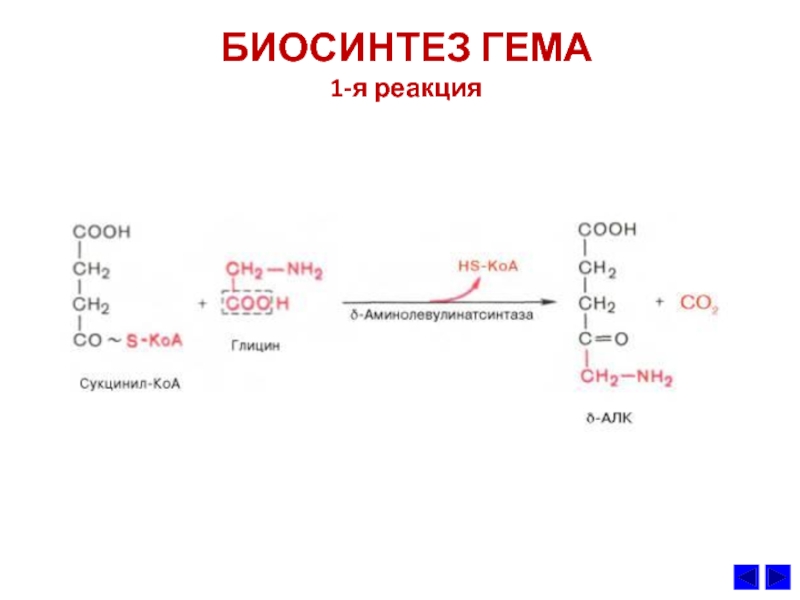
- 39. БИОСИНТЕЗ ГЕМА 1-я реакция
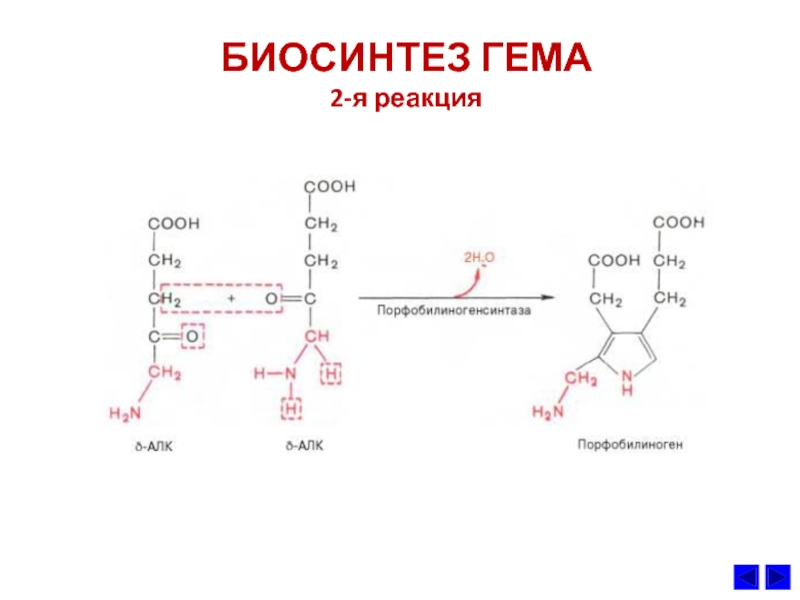
- 40. БИОСИНТЕЗ ГЕМА 2-я реакция
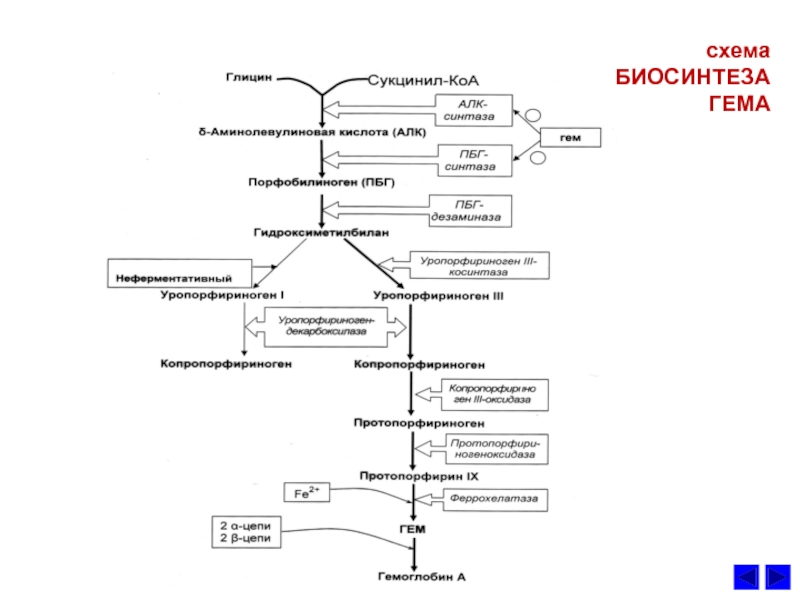
- 41. БИОСЕЗ ГЕМАсхема БИОСИНТЕЗА ГЕМА
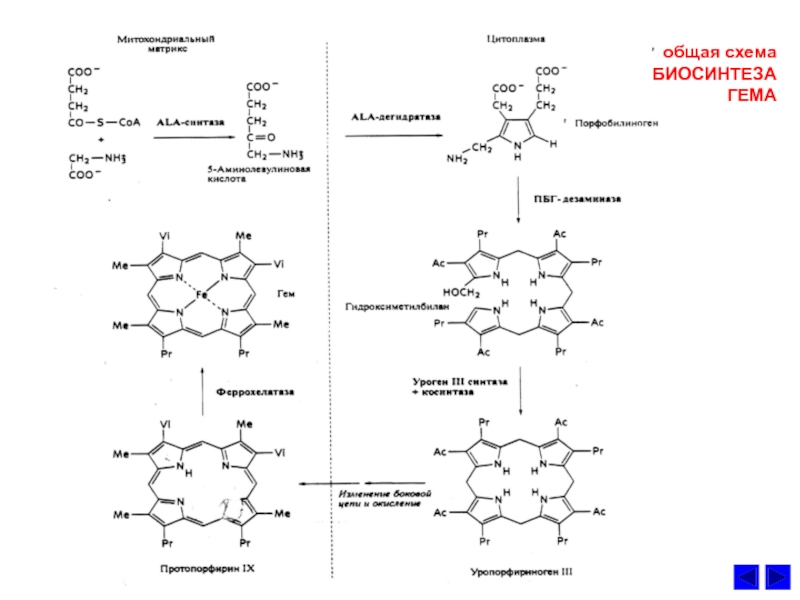
- 42. общая схема БИОСИНТЕЗА ГЕМА
- 43. ПОРФИРИЯБИОСИНТЕЗ ГЕМА 2-я реакция
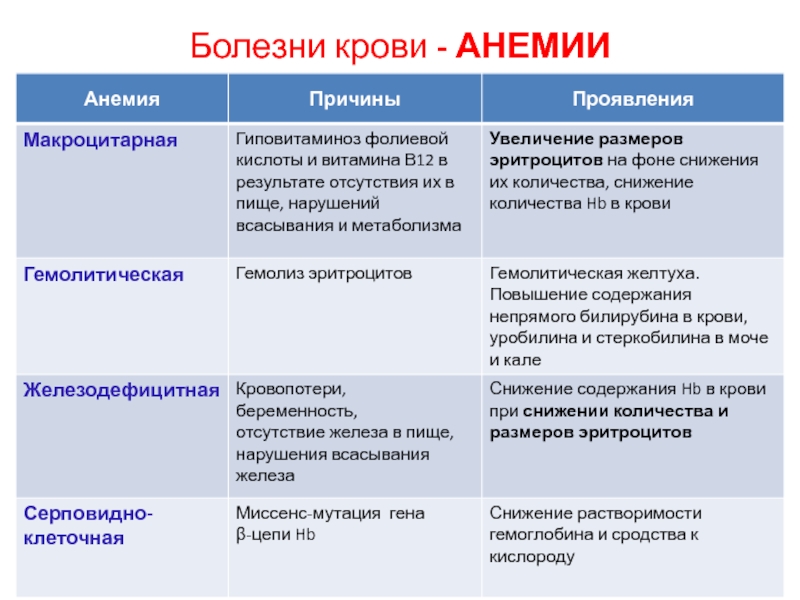
- 44. Болезни крови - АНЕМИИ
- 45. Энзимодиагностика
- 46. Активность ферментов в крови мала -5-40 ЕД/л
- 47. Относительное изменение активности ферментов при острой загрудинной или абдоминальной боли
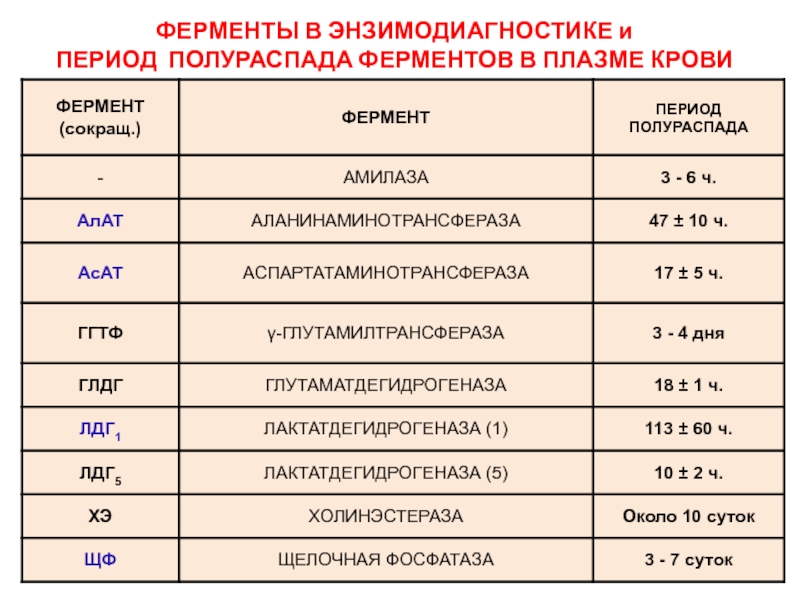
- 48. ФЕРМЕНТЫ В ЭНЗИМОДИАГНОСТИКЕ и ПЕРИОД ПОЛУРАСПАДА ФЕРМЕНТОВ В ПЛАЗМЕ КРОВИ
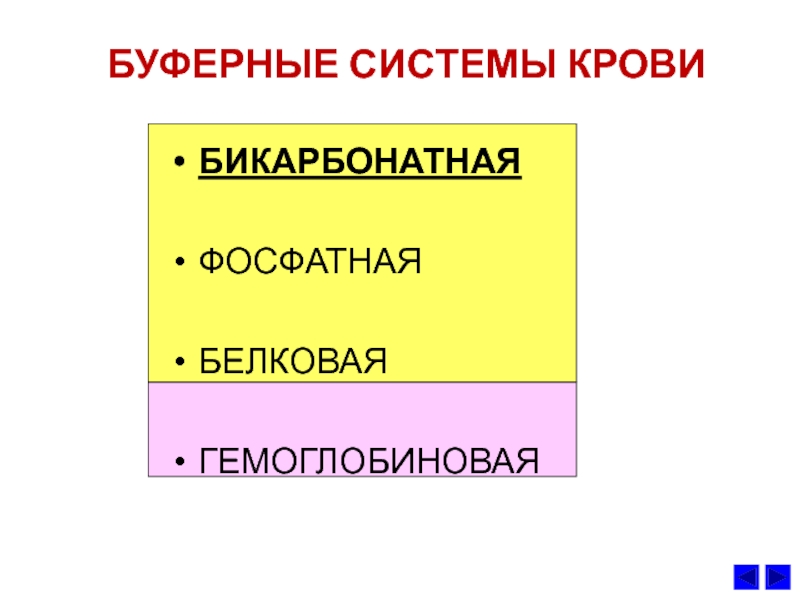
- 49. БУФЕРНЫЕ СИСТЕМЫ КРОВИБИКАРБОНАТНАЯ ФОСФАТНАЯБЕЛКОВАЯГЕМОГЛОБИНОВАЯ
- 50. Особенности метаболизма эритроцитовВ результате дифференцировки предшественники эритроцитов
- 51. В эритроцитах гликолиз обеспечивает синтез АТФ и
- 52. Образование и обезвреживание активных форм кислорода в
- 53. Схема образования телец Хейнца – агрегация молекул
- 54. Основные механизмы фагоцитоза От микрооорганизмов поступающих в организм
- 55. Образование активных форм кислорода активированными макрофагами, нейтрофилами и эозинофилами в процессе респираторного взрыва
- 56. Активирующийся при фагоцитозе ферментный комплекс мембран фагосом
- 57. Благодарю за внимание
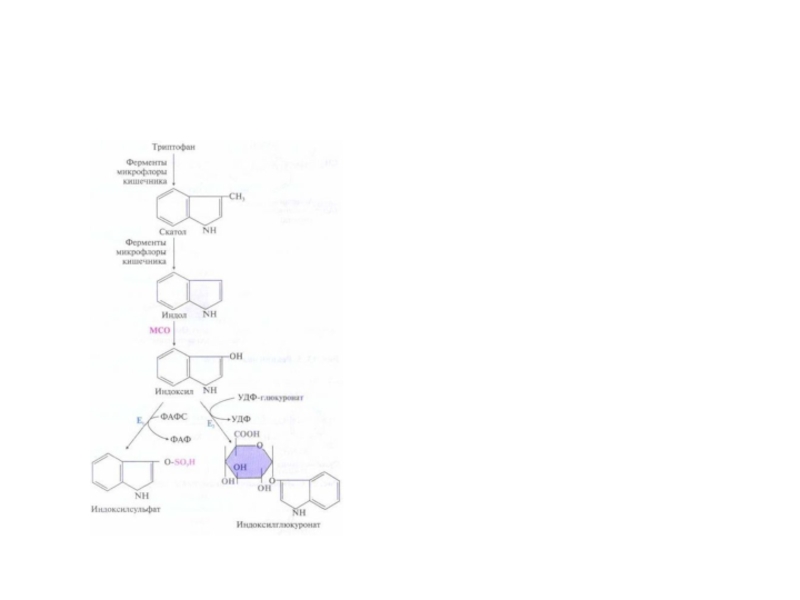
- 58. Инактивация чужеродных веществ в организмеЧужеродные вещества, попадающие
- 59. Система микросомального окисления веществ и реакции коньюгацииПроцесс
- 60. Слайд 60
- 61. Слайд 61
- 62. Слайд 62
- 63. Слайд 63
- 64. Слайд 64
- 65. Слайд 65
- 66. Слайд 66
- 67. Слайд 67
- 68. 2 О2
- 69. Наиболее часто встречающиеся проканцерогены
- 70. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Лекция 12
ТЕМА
БИОХИМИЯ КРОВИ
и
ЭРИТРОЦИТОВ
к.б.н., доцент И.В. Андреева
Каф. Общей и
биологической химии
Слайд 2План лекции
функции крови
состав крови
основные свойства белковых фракций крови
и их диагностическое
значение
эритроциты и гемоглобин
обмен железа
биосинтез гема
болезни крови
энзимодиагностика
Слайд 3ФУНКЦИИ КРОВИ
Транспортная
Дыхательная
Трофическая
Выделительная
Регуляторная
Защитная
Терморегуляторная
Регуляция водно-солевого и кислотно-основного баланса
Слайд 4ФУНКЦИИ КРОВИ
1. Транспортная функция. Циркулируя по сосудам, кровь транспортирует множество
соединений
— среди них газы, питательные вещества,
гормоны и др.2. Дыхательная функция. Эта функция заключается в связывании и переносе кислорода и
углекислого газа.
3. Трофическая (питательная) функция. Кровь обеспечивает все клетки организма
питательными веществами: глюкозой, аминокислотами, жирами, витаминами, минеральными
веществами, водой.
4. Экскреторная функция. Кровь уносит из тканей конечные продукты метаболизма: мочевину,
мочевую кислоту и другие вещества, удаляемые из организма органами выделения.
5. Терморегуляторная функция. Кровь охлаждает внутренние органы и переносит тепло к
органам теплоотдачи.
6. Поддержание постоянства внутренней среды. Кровь поддерживает стабильность ряда
констант организма (рН, Т, концентрация ионов и др.).
7. Обеспечение водно-солевого обмена. Кровь обеспечивает водно-солевой обмен между
кровью и тканями. В артериальной части капилляров жидкость и соли поступают в ткани,
а в венозной части капилляра возвращаются в кровь.
8. Защитная функция. Кровь выполняет защитную функцию, являясь важнейшим фактором
иммунитета или защиты организма от живых тел и генетически чуждых веществ.
9. Гуморальная регуляция. Благодаря своей транспортной функции кровь обеспечивает
химическое взаимодействие между всеми частями организма, т.е. гуморальную регуляцию.
Кровь переносит гормоны и другие физиологически активные вещества.
Слайд 6
Общее количество крови в организме взрослого человека составляет около 5
л
(примерно 7% от массы тела).
Если кровь центрифугировать, то
форменные элементы (эритроциты, лейкоциты, тромбоксаны) осаждаются, а над осадком остается светлая прозрачная жидкость –
плазма крови.
В плазме содержится примерно 7% белков, а также разнообразные
низкомолекулярные вещества.
При стоянии в течение нескольких минут плазма свертывается – образуется сгусток,
жидкость без сгустка называется - сыворотка. А сгусток образован фибриногеном,
который превратился в нерасторимый фибрин.
Состав плазмы крови – зеркало метаболизма человека.
Слайд 9Основные свойства белковых фракций крови
и их диагностическое значение
Содержание общего белка
плазмы крови составляет 60-80 г/л,
альбумина — 40-60 г/л,
глобулинов
— 20–30 г/л. Обычно при лабораторном анализе крови методом электрофореза обнаруживают
5 белковых фракций:
альбумин (55—65%),
α1-глобулины (2—4%),
α2-глобулины (6—12%),
β-глобулины (8—12%) и
γ-глобулины (12—22%).
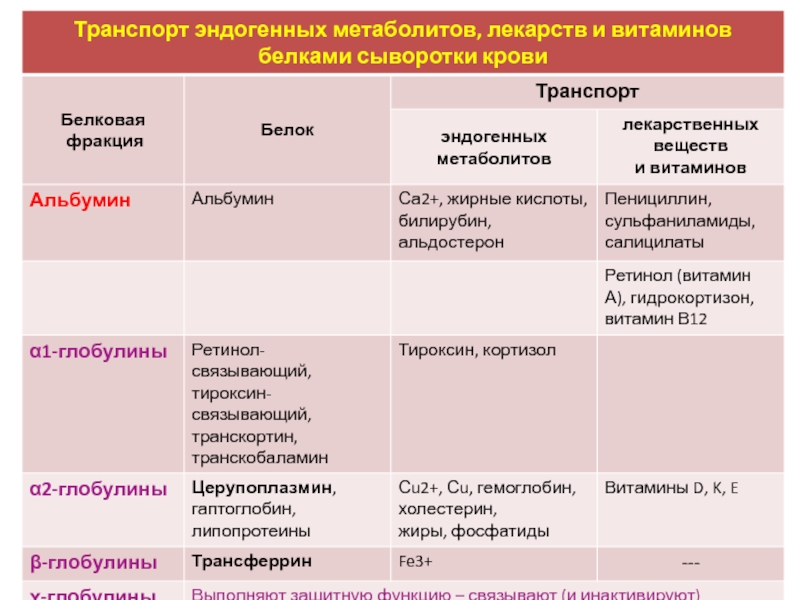
Альбумин имеет наибольшую, а γ-глобулины — наименьшую подвижность в
электрическом поле. Альбумин синтезируется в печени и составляет большую часть
белков плазмы крови (рис.). Благодаря высокому содержанию дикарбоновых
аминокислот альбумин удерживает катионы, главным образом Na+, и играет
основную роль в сохранении коллоидно-осмотического давления. Кроме того,
альбумин транспортирует некоторые гидрофобные метаболиты, например жирные
кислоты, билирубин, альдостерон.
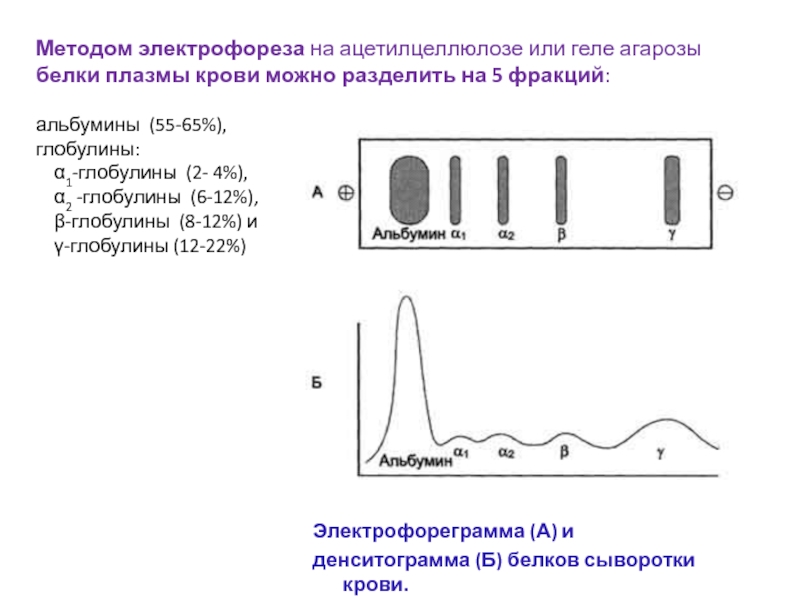
Слайд 11Методом электрофореза на ацетилцеллюлозе или геле агарозы белки плазмы крови
можно разделить на 5 фракций: альбумины (55-65%), глобулины:
α1-глобулины (2- 4%), α2 -глобулины (6-12%), β-глобулины (8-12%) и γ-глобулины (12-22%)Электрофореграмма (А) и
денситограмма (Б) белков сыворотки крови.
Слайд 13Основные биохимические механизмы гомеостаза
Повреждение кровеносного сосуда вызывает каскад процессов, в
результате которых
образуется сгусток крови — тромб, прекращающий вытекание крови.
В этом процессе основную роль играют тромбоциты и некоторые белки плазмы крови. Затем происходит
растворение сгустков крови тромбов и сохранение крови в жидком состоянии
(гомеостаз).
Этот процесс включает 4 этапа:
I – рефлекторное сокращение поврежденного кровеносного сосуда (в первые секунды после травмы);
II – образование в течение 3-5 мин тромбоцитарной пробки (белого тромба) в
результате взаимодействия поврежденного эндотелия с тромбоцитами, которые, наслаиваясь друг на друга, могут закупорить небольшой кровеносный сосуд;
III – формирование фибринового тромба (10-30 мин), заключается в
превращении растворимого белка плазмы крови фибриногена под действием
фермента тромбина в нерастворимый белок фибрин, который откладывается между
тромбоцитами. Такой тромб содержит эритроциты, поэтому называется красным
тромбом.
IV – фибринолиз – растворение тромба под действием протеолитических ферментов,
адсорбированных на фибриновом сгустке. На этом этапе просвет кровяного сосуда
освобождается от отложений фибрина и предотвращается закупорка сосуда
фибриновым тромбом.
Слайд 14Компоненты свертывающей системы крови
белки свертывающей системы крови большей частью
являются
вначале субстратами а потом ферментами, так как активируются
частичным протеолизом.
Их больше 13.- ионы Са
- витамин К,
Тромбоциты
Противосвертывающая система крови
Антитромбин III (инактивирует ряд белов свертывающей системы)
Активатором антитромбинаIII является гетерополисахарид гепарин
альфа-2-МАКРОГЛОБУЛИН
Система протеина С
ферменты (урокиназа) и др.
Недостаток в компонентах этой системы вызывают:
тромбозы и гемофилии
Слайд 16Эритроциты и гемоглобин
Эритроциты занимают 36-48% объема крови.
В 1мм3 содержится 4-5
млн эритроцитов;
Во всей крови взрослого человека – 2,5 х 1013
эритроцитов.95% массы сухого вещества эритроцитов приходится на гемоглобин,
благодаря которому эритроцит и выполняет свою функцию транспорта
кислорода .
На долю гемоглобина приходится половина объема эритроцитов.
Общее содержание гемоглобина в крови составляет 13-16 г/дл.
Эритроцит живет 110-125 дней.
Ежесуточно распадается 2х 1011 эритроцитов и столько же образуется новых
Эритопоэз стимулируется гликопротеином эритропоэтином, образуемым
в почках.
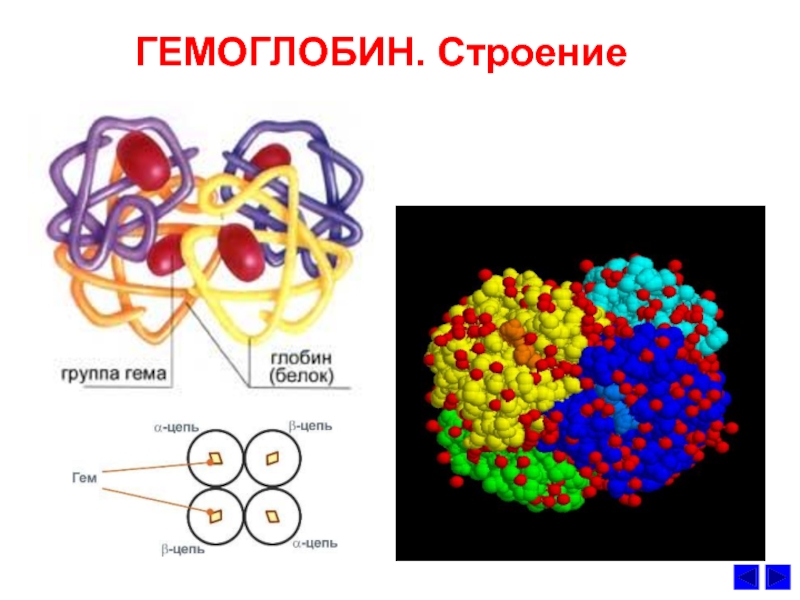
Слайд 18Гемоглобин
Гемоглобин (Hb) - сложный олигомерный белок гемопротеин, содержащийся в
эритроцитах.
Состоит из 4-х протомеров, соединеных нековалетными связями.
Hb – белок родственный
миоглобину (Mb).Молекула гемоглобина состоит из 4-х гемов и белка 4х белков глобина,
Образованного двумя альфа (2α) и двумя бета (2β) полипептидными цепями.
Гем соединяется гидрофобной частью с гидрофобными радикалами
аминокислот каждого портомера.
Виды гемоглобина в процессе жизни человека;
Глобин А - тетрамер: (2α2β) – 98% глобина эритроцитов взрослого человека;
Глобин А2 – тетрамер (2α2δ) – 2% -»-;
Глобин эмбриональный - тетрамер (2α2δ), от 2х недель плода до 6 месяцев.
Глобин F - тетрамер (2α2ʏ) сменяет ранний гемоглобин плода на 6-ом месяце развития плода.
Слайд 19Гемоглобин (Hb) - сложный
олигомерный белок - гемопротеин,
содержащийся в
эритроцитах. Состоит
из 4-х протомеров, соединеных
нековалетными связями.
Hb – белок родственный
миоглобину (Mb).Молекула гемоглобина состоит из 4-х
гемов и белка (4х белков глобина),
образованного двумя альфа (2α) и двумя
бета (2β) полипептидными цепями.
Гем соединяется гидрофобной частью с
гидрофобными радикалами остатков
аминокислот каждого протомера.
Тетрамер гемоглобин
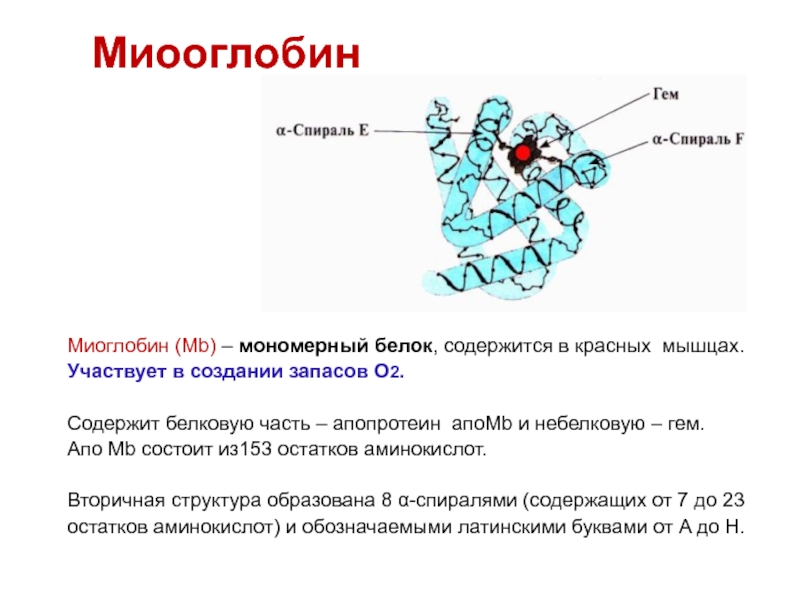
Слайд 21Миооглобин
Миоглобин (Mb) – мономерный белок, содержится в красных мышцах.
Участвует
в создании запасов О2.
Содержит белковую часть – апопротеин апоMb
и небелковую – гем. Апо Mb состоит из153 остатков аминокислот.
Вторичная структура образована 8 α-спиралями (содержащих от 7 до 23
остатков аминокислот) и обозначаемыми латинскими буквами от A до Н.
Слайд 22Расположение гема и О2 в активном центре апогемоглобина и протомеров
глобина
Особенности строения
активного центра гемоглобина
Гем через атом железа ковалентно
связан
с радикалом гистидина α-спирали F8.
О2 присоединяется к железу с другой
стороны плоскости гема.
Гидрофобный радикал остатка
гистидина α-спирали Е7 необходим для
правильной ориентации О2 и облегчает
присоединение кислорода к Fе+2 гема.
Микрооокружение гема создает условия
для прочного, но обратимого связывания
О2 с Fе+2 и препятствует попаданию в
гидрофобный активный центр воды, что
может привести к окислению Fе+2 в Fе+3 .
Слайд 23Изменение конфомации других цепей облегчает их взаимодействие со следующими молекулам
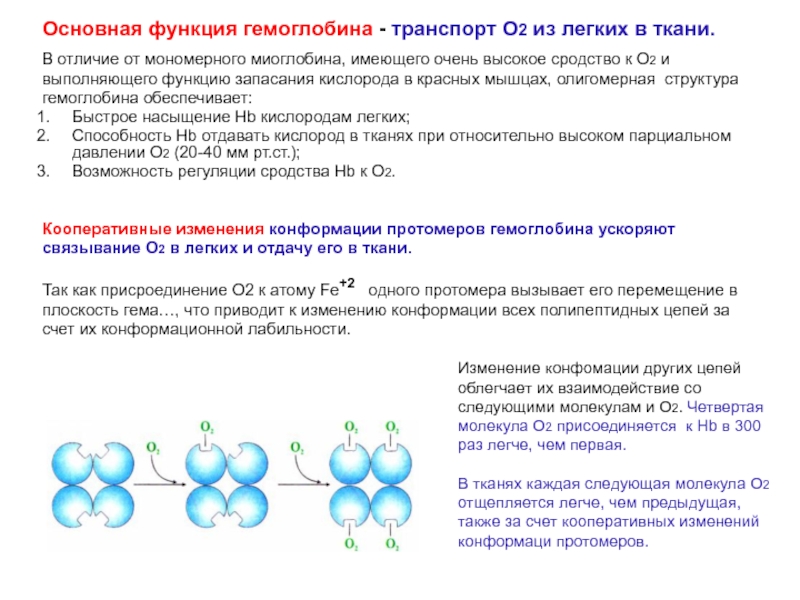
и О2. Четвертая молекула О2 присоединяется к Нb в 300
раз легче, чем первая. В тканях каждая следующая молекула О2 отщепляется легче, чем предыдущая, также за счет кооперативных изменений конформаци протомеров.Основная функция гемоглобина - транспорт О2 из легких в ткани.
В отличие от мономерного миоглобина, имеющего очень высокое сродство к О2 и
выполняющего функцию запасания кислорода в красных мышцах, олигомерная структура
гемоглобина обеспечивает:
Быстрое насыщение Нb кислородам легких;
Способность Нb отдавать кислород в тканях при относительно высоком парциальном давлении О2 (20-40 мм рт.ст.);
Возможность регуляции сродства Нb к О2.
Кооперативные изменения конформации протомеров гемоглобина ускоряют
связывание О2 в легких и отдачу его в ткани.
Так как присроединение О2 к атому Fе+2 одного протомера вызывает его перемещение в
плоскость гема…, что приводит к изменению конформации всех полипептидных цепей за
счет их конформационной лабильности.
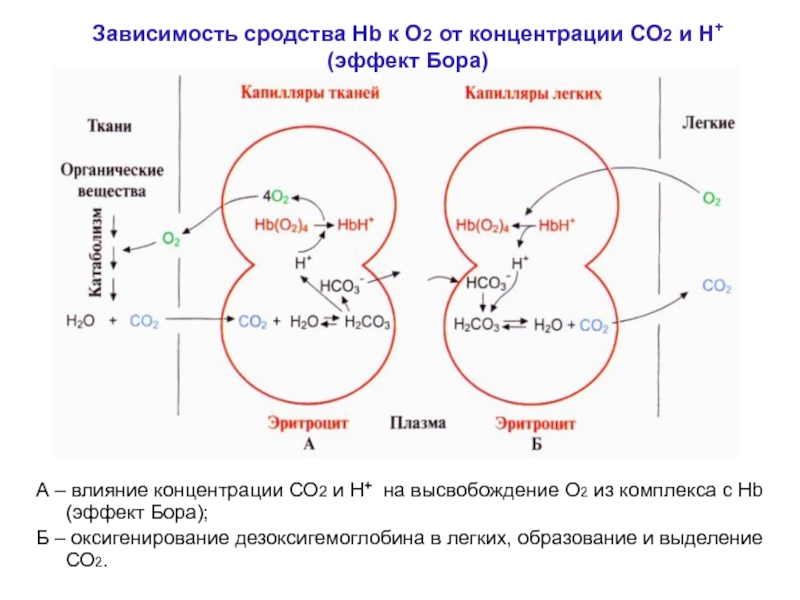
Слайд 24СО2 и Н+, образующиеся при катаболизме органических веществ,
уменьшают сродство
гемоглобина к О2 пропорционально их концентрации.
СО2 образующийся в процессах катаболизма
в клетках тканей органов диффузией попадает в кровь и в эритроциты, где под действием фермента
карбоангидразы превращается в угольную кислоту. Эта слаба кислота
диссоциирует на протон и бикарбонат ион:
СО2 + Н2О → Н2СО3 → Н + + НСО3-
Н+ присоединяются к свободным радикалам остатков аминокислоты
гистидин и снижают сродство оксиНb к О2 . И О2 поступает в ткани, а
оксиНb превращается в дезоксиНb .
Увеличение количества освобожденного кислорода в зависимости от
увеличения концентрации Н+ в эритроцитах называется эффектом Бора
Слайд 25В легких высокое парциальное давление кислорода способствует его
связыванию с
дезоксиHb, что уменьшает сродство белка к Н+
Освободившиеся протоны под
действием карбоангидразы взаимодействуют с бикарбонатами с образованием СО2 и Н2О.
Образовавшийся СО2 поступает в альвеолярное пространство и удаляется с
выдыхаемым воздухом.
Таким образом, количество высвобождаемого гемоглобином кислорода в
тканях регулируется продуктами катаболизма органических веществ:
чем интенсивнее распад веществ (например при физических нагрузках),
тем больше кислорода получат ткани в результате уменьшения сродства
Hb к О2.
Слайд 26А – влияние концентрации СО2 и Н+ на высвобождение О2
из комплекса с Hb (эффект Бора);
Б – оксигенирование дезоксигемоглобина
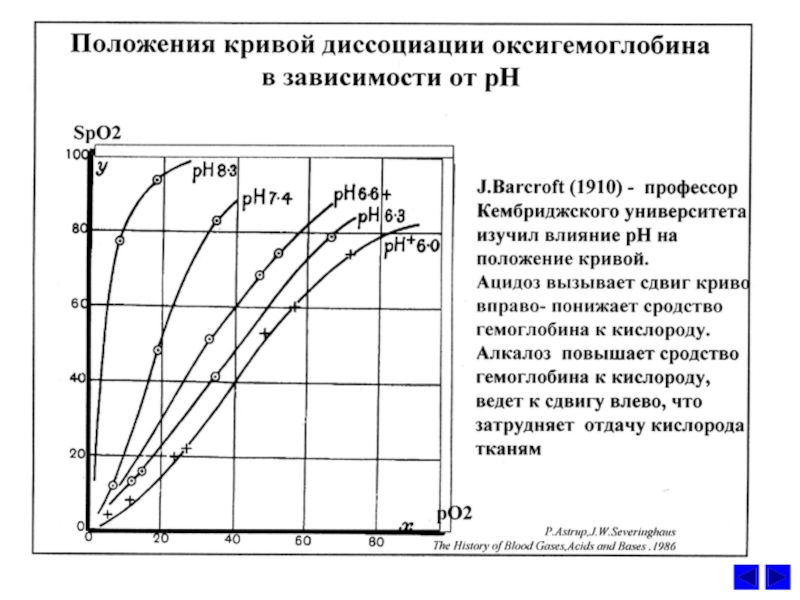
в легких, образование и выделение СО2.Зависимость сродства Hb к О2 от концентрации СО2 и Н+
(эффект Бора)
Слайд 28Нормальные формы гемоглобина
Существует несколько нормальных вариантов гемоглобина:
HbР – примитивный гемоглобин, содержит
2ξ- и 2ε-цепи,
встречается в эмбрионе между 7-12 неделями жизни,
HbF –
фетальный гемоглобин, содержит 2α- и 2γ-цепи, появляется через 12 недель внутриутробного развития и является основным после 3 месяцев,HbA – гемоглобин взрослых, доля составляет 98%, содержит 2α- и 2β-цепи, у плода появляется через 3 месяца жизни и к рождению составляет 80% всего гемоглобина,
HbA2 – гемоглобин взрослых, доля составляет 2%, содержит 2α- и 2δ-цепи,
HbO2 – оксигемоглобин, образуется при связывании кислорода в легких, в легочных венах его 94-98% от всего количества гемоглобина,
HbCO2 – карбогемоглобин, образуется при связывании углекислого газа в тканях, в венозной крови составляет 15-20% от всего количества гемоглобина.
Слайд 29Патологические формы гемоглобина
HbS – гемоглобин серповидно-клеточной анемии.
MetHb – метгемоглобин, форма гемоглобина, включающая трехвалентный
ион железа вместо двухвалентного. Такая форма обычно образуется
спонтанно, в
этом случае ферментативных мощностей клетки хватает на его восстановление. При использовании сульфаниламидов, употреблении
нитрита натрия и нитратов пищевых продуктов, при недостаточности
аскорбиновой кислоты ускоряется переход Fe2+ в Fe3+. Образующийся
metHb не способен связывать кислород и возникает гипоксия тканей. Для
восстановления ионов железа в клинике используют аскорбиновую кислоту
и метиленовую синь.
Hb-CO – карбоксигемоглобин, образуется при наличии СО (угарный газ) во
вдыхаемом воздухе. Он постоянно присутствует в крови в малых концентрациях, но
его доля может колебаться от условий и образа жизни.
Угарный газ является активным ингибитором гем-содержащих ферментов, в
частности, цитохромоксидазы, 4-го комплекса дыхательной цепи.
HbA1С – гликозилированный гемоглобин. Концентрация его нарастает при
хронической гипергликемии и является хорошим скрининговым
показателем уровня глюкозы крови за длительный период времени.
Слайд 30Обмен железа
Железо является необходимым биохимическим компонентом в ключевых
процессах метаболизма,
роста и пролиферации клеток. Исключительная роль железа
определяется важными биологическими
функциями белков, в состав которых входитэтот металл. К наиболее известным железосодержащим белкам относятся
гемоглобин и миоглобин.
Помимо последних, железо находится в составе значительного количества
ферментов, участвующих в процессах энергообразования (цитохромы), в биосинтезе
ДНК и делении клеток, детоксикации продуктов эндогенного распада, ферментов
нейтрализующих активные формы кислорода (пероксидазы, цитохромоксидазы,
каталазы). В последние годы установлена роль железосодержащих белков (ферритин)
в реализации клеточного иммунитета, регуляции кроветворения.
Вместе с тем железо может быть исключительно токсичным элементом, если
присутствует в организме в повышенных концентрациях, превышающих емкость
железосодержащих белков. Потенциальная токсичность свободного двухвалентного
железа (Fе+2) объясняется его способностью запускать цепные свободно-радикальные
реакции, приводящие к перекисному окислению липидов биологических мембран и
токсическому повреждению белков и нуклеиновых кислот.
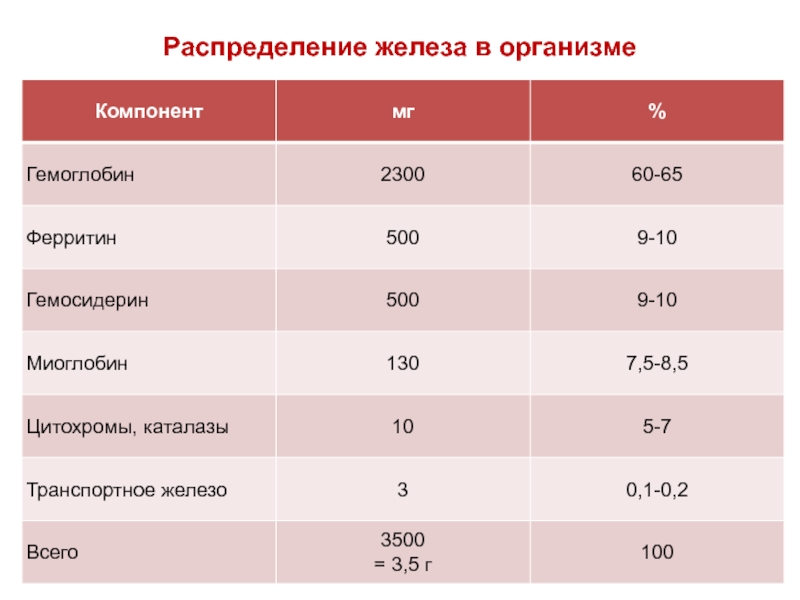
Общее количество железа в организме здорового человека составляет 3,5-5,0 г.
Оно распределено следующим образом (табл.)
Слайд 32Обмен железа в
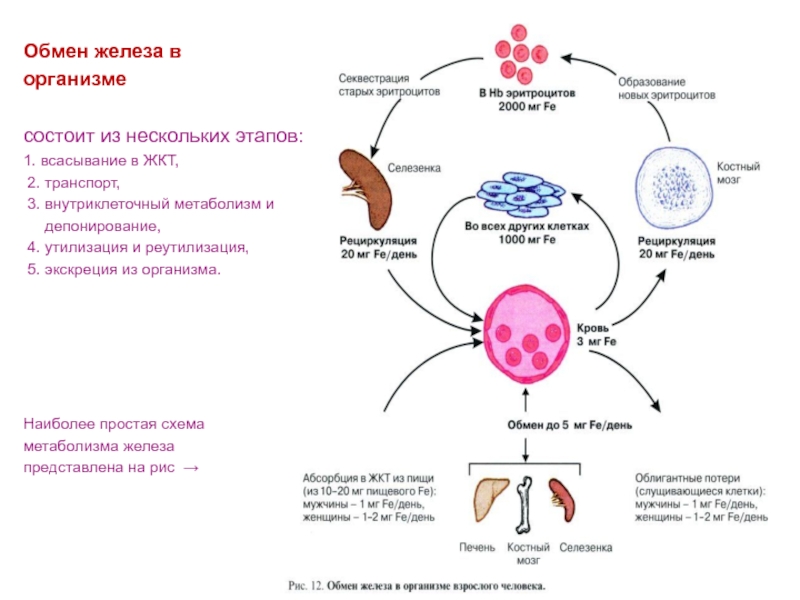
организме
состоит из нескольких этапов:
1. всасывание в
ЖКТ,
2. транспорт,
3. внутриклеточный метаболизм и
депонирование, 4. утилизация и реутилизация,
5. экскреция из организма.
Наиболее простая схема
метаболизма железа
представлена на рис →
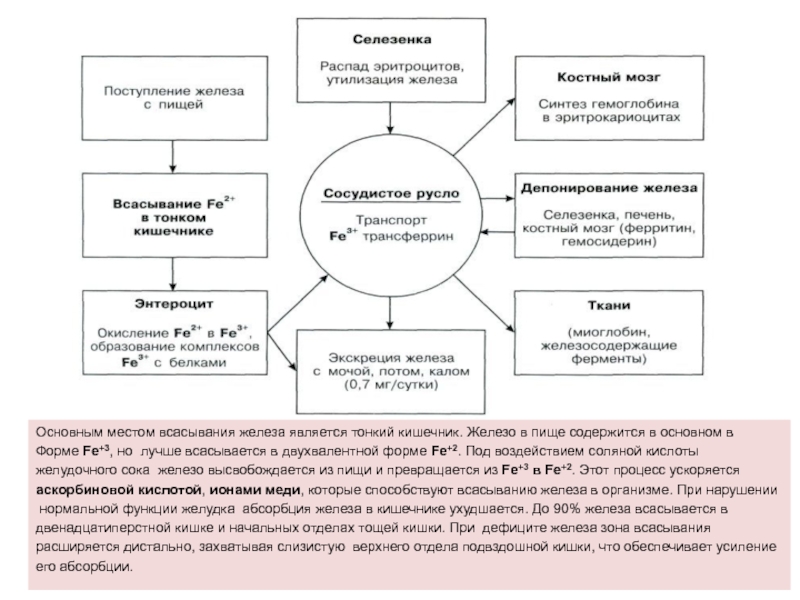
Слайд 33Основным местом всасывания железа является тонкий кишечник. Железо в пище
содержится в основном в
Форме Fе+3, но лучше всасывается в
двухвалентной форме Fе+2. Под воздействием соляной кислоты желудочного сока железо высвобождается из пищи и превращается из Fе+3 в Fе+2. Этот процесс ускоряется
аскорбиновой кислотой, ионами меди, которые способствуют всасыванию железа в организме. При нарушении
нормальной функции желудка абсорбция железа в кишечнике ухудшается. До 90% железа всасывается в
двенадцатиперстной кишке и начальных отделах тощей кишки. При дефиците железа зона всасывания
расширяется дистально, захватывая слизистую верхнего отдела подвздошной кишки, что обеспечивает усиление
его абсорбции.
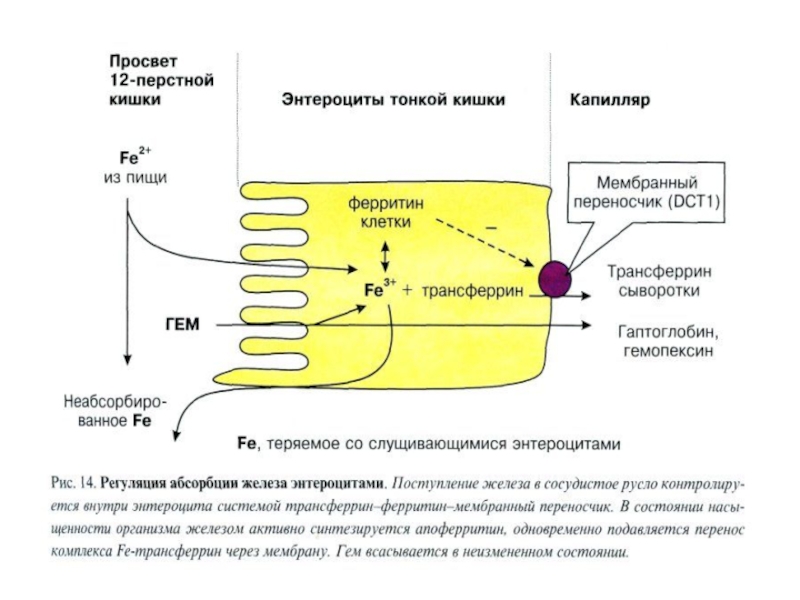
Слайд 35Основными формами депонированного железа являются ферритин и гемосидерин,
которые связывают
"избыточное« железо и откладываются, практически, во всех
тканях организма, но
особенно интенсивно в печени, селезенке, мышцах, костном мозге.Апоферритин покрывает в виде оболочки ядро из гидроксифосфата железа и содержит 24
однотипных цилиндрических субъединицы, образующих сферическую структуру с внутренним
пространством диаметром приблизительно 70 А, сфера имеет поры диаметром 10 А.
Ионы Fе+2 диффундируют через поры, окисляются до Fе+3, превращаются в FеООН и
кристаллизируются.
Ферритин содержит примерно 15-20% общего железа в организме. Молекулы ферритина
растворимы в воде, каждая из них может аккумулировать до 4500 атомов железа
Депонирование железа
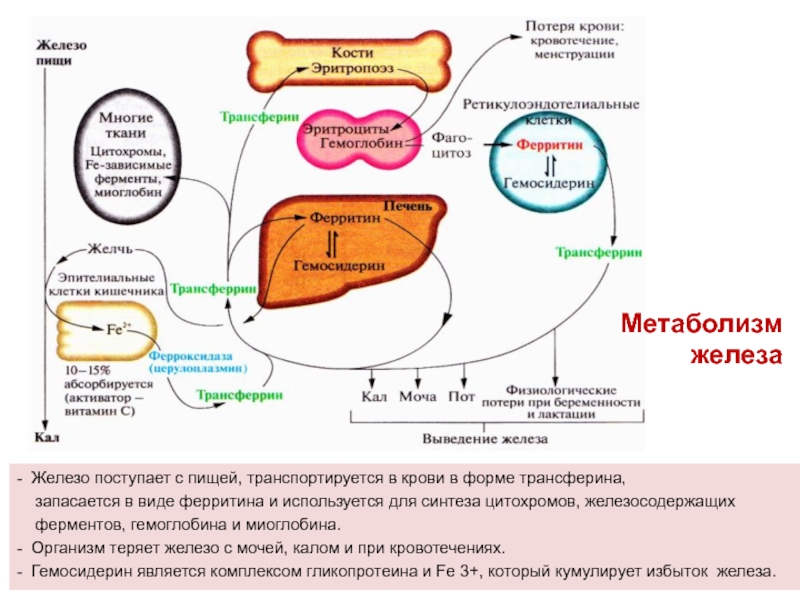
Слайд 36- Железо поступает с пищей, транспортируется в крови в форме
трансферина,
запасается в виде ферритина и используется для
синтеза цитохромов, железосодержащих ферментов, гемоглобина и миоглобина.
- Организм теряет железо с мочей, калом и при кровотечениях.
- Гемосидерин является комплексом гликопротеина и Fe 3+, который кумулирует избыток железа.
Метаболизм железа
Слайд 37Нарушения обмена железа
Синдром перегрузки Fe – гемосидероз
Первичный идеопатический – гемохроматоз
Железодефицитная
анемия – сидеропатия
Механизм повреждения клеток при перегрузке и
отравлении железом:
Прямое
токсическое действие свободных ионов Fe на ферменты окислительно – восстановительной системы клеткиПерегрузка, повреждение и разрушение лизосом
Образование свободных радикалов и индуцирование ПОЛ
Стимулирование ионами железа синтеза коллагена с последующим фиброзом
Слайд 38СИНТЕЗ ГЕМА и его регуляция
1. Гем –
протопорфириновое кольцо с железом.
субстратами синтеза
гема являются глицин, сукцинил КоА и Fe2+.Является простетической группой гемоглобина, цитохромов, каталазы и пероксидазы.
2. Гем синтезируется во всех клетках, но наиболее активно в клетках печени и костном
мозге.
3. Ключевой реакцией синтеза протопорфиринов является реакция образования
аминолевулиной кислоты. Эту реакцию катализирует пиридоксальфасфат-зависимый
фермент митохондрий эритробластов аминолевулинатсинтетаза. Гем и гемоглобин
являютcя аллостерическими иигибиторами и репрессорами синтеза этого фермента.
4. Стероидные гормоны и некоторые лекарства (барбитураты, диклофенак, сульфанил-
амиды, эстрогены, прогестины) являются индукторами синтеза аминолевулиновулинат-
синтетазы.
5. Нарушения синтеза гема.
Наследственные и приобретенные нарушения сопровождающиеся повышенным
содержанием промежуточных продуктов синтеза гема – порфириногенов, а также продуктов
их окисления в тканях называют порфириями. При этих заболеваниях накапливаются
промежуточные метаболиты синтеза гема, которые оказывают токсическое действие на
нервную систему и вызывают нервно-психические расстройства .
Порфироиногены на свету превращаются в порфирины, которые при взаимодействии c
кислородом образуют активные радикалы, повреждающие клетки кожи. Эти вещества
поступают в кровь затем в мочу окрашивая её при стоянии в красный цвет (цвет портвейна).
Прием перечисленных выше лекарств вызывают обострение болезни
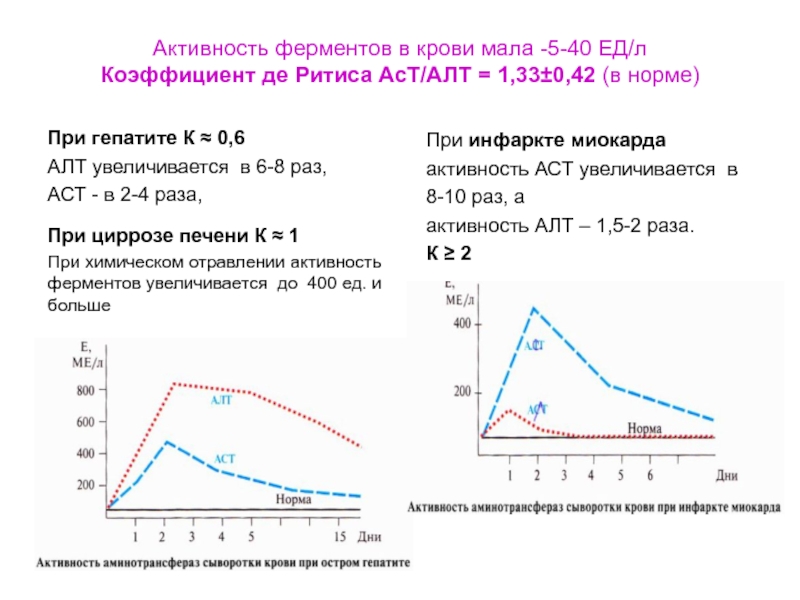
Слайд 46Активность ферментов в крови мала -5-40 ЕД/л Коэффициент де Ритиса АсТ/АЛТ
= 1,33±0,42 (в норме)
При гепатите К ≈ 0,6
АЛТ увеличивается в
6-8 раз, АСТ - в 2-4 раза,
При циррозе печени К ≈ 1
При химическом отравлении активность ферментов увеличивается до 400 ед. и больше
При инфаркте миокарда
активность АСТ увеличивается в
8-10 раз, а
активность АЛТ – 1,5-2 раза.
К ≥ 2
Слайд 50Особенности метаболизма эритроцитов
В результате дифференцировки предшественники эритроцитов эритробласты теряют ядро,
рибосомы, митохондрии и эндоплазматический ретикулум и преобразуются сначала в
ретикулоциты,
а затем в эритроциты. Существуют в крови 110-125 дней.Глюкоза - единсьвенная топливная молекула. Метаболизм глюкозы в эритроцитах
представлен анаэробным гликолизом и пентозофосфатным путем катаболизма.
Высокое содержание кислорода в эритроцитах вызывает повышение
скорости образования супероксидного анион-радикала (O2 -), Н2О2 (пероксида водорода) и
ОН* (гидроксил-радикала) = (активные формы кислорода - АФК).
Постоянным источником активных форм кислорода в эритроцитах является
неферментативное окисление гемоглобина: Hb(Fe2+ ) + O2 → MetHb(Fe 3+ ) + O2 - .
Активные формы кислорода (АФК) могут вызвать гемолиз эритроцитов.
НО! Эритроциты содержат ферментную систему, предотвращающую токсическое
действие радикалов кислорода и разрушение мембран эритроцитов. ЭТО
Антиоксидантная защита (АОЗ)
Слайд 51В эритроцитах гликолиз обеспечивает синтез АТФ и восстановление НAД до
НАДН+Н.
АТФ необходима для работы ионных насосов.
НAДН является коферментом
метгемоглобинредуктазы, катализирующей восстановление метгемоглобина до гемоглобина.
Супероксидный анион супероксиддисмутазой превращается в пероксид водорода,
который под действием глутатионпероксидазы или каталазы превращается в Н2О и
О2 (АОЗ).
Донором водорода для глутатионпероксидазы является восстановленный
глутатион (GSH).
Окисленный глутатион (GSSG) восстанавливается ферментом
глутатионредуктазой, кофермент которого - НAДФН образуется в
Пентозофосфатном пути катаболизма глюкозы.
При генетическом дефекте глюкозо-6-фосфатдегидрогеназы и приёме некоторых
лекарств, являющихся сильными окислителями, потенциала глутатионовой защиты
может оказаться недостаточным, что приводит к увеличению содержания в клетках
активных форм кислорода, вызывающих окисление SH-групп молекул гемоглобина.
Образование дисульфидных связей между протомерами гемоглобина и
метгемоглобина приводит к их агрегации — образованию телец Хайнца. Последние
способствуют разрушению эритроцитов при попадании их в мелкие капилляры.
Активные формы кислорода и сами разрушают мембраны, вызывая перекисное
окисление липидов (ПОЛ) мембран.
Слайд 52
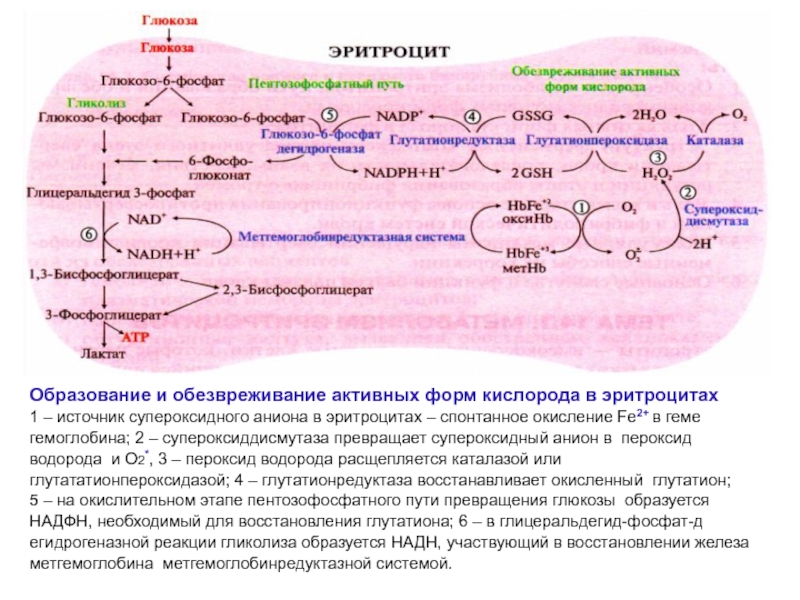
Образование и обезвреживание активных форм кислорода в эритроцитах
1 – источник
супероксидного аниона в эритроцитах – спонтанное окисление Fe2+ в геме
гемоглобина; 2 – супероксиддисмутаза превращает супероксидный анион в пероксид
водорода и О2*, 3 – пероксид водорода расщепляется каталазой или
глутататионпероксидазой; 4 – глутатионредуктаза восстанавливает окисленный глутатион;
5 – на окислительном этапе пентозофосфатного пути превращения глюкозы образуется
НАДФН, необходимый для восстановления глутатиона; 6 – в глицеральдегид-фосфат-д
егидрогеназной реакции гликолиза образуется НАДН, участвующий в восстановлении железа
метгемоглобина метгемоглобинредуктазной системой.
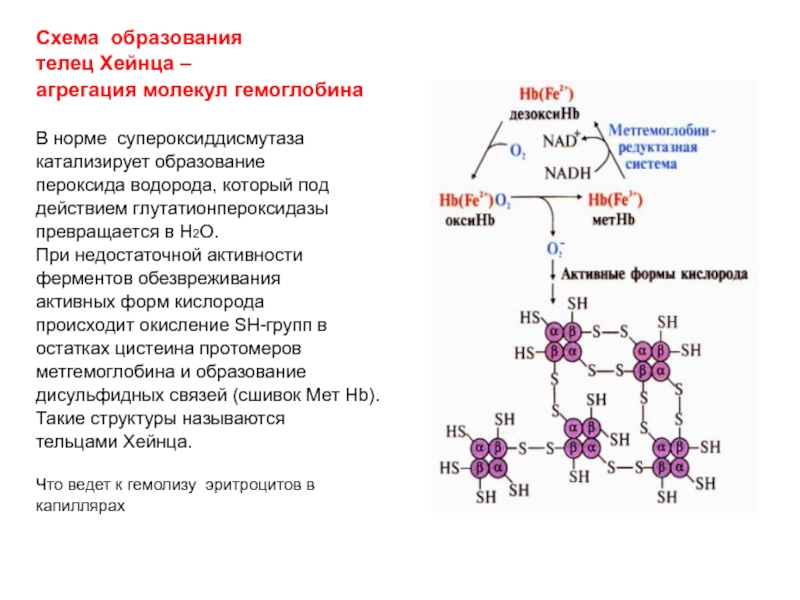
Слайд 53Схема образования
телец Хейнца –
агрегация молекул гемоглобина
В норме супероксиддисмутаза
катализирует образование
пероксида водорода, который под
действием глутатионпероксидазы
превращается в
Н2О. При недостаточной активности
ферментов обезвреживания
активных форм кислорода
происходит окисление SН-групп в
остатках цистеина протомеров
метгемоглобина и образование
дисульфидных связей (сшивок Мет Hb).
Такие структуры называются
тельцами Хейнца.
Что ведет к гемолизу эритроцитов в
капиллярах
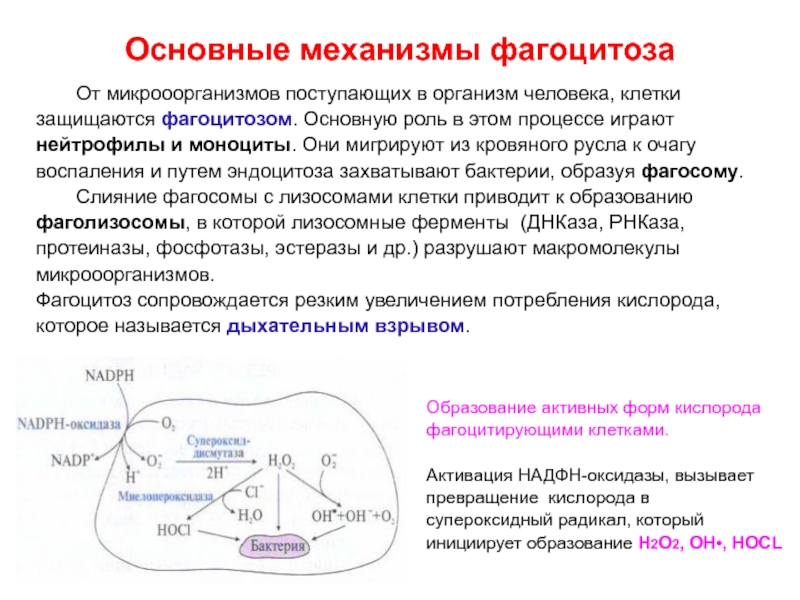
Слайд 54Основные механизмы фагоцитоза
От микрооорганизмов поступающих в организм человека, клетки
защищаются
фагоцитозом. Основную роль в этом процессе играют
нейтрофилы и моноциты.
Они мигрируют из кровяного русла к очагу воспаления и путем эндоцитоза захватывают бактерии, образуя фагосому.
Слияние фагосомы с лизосомами клетки приводит к образованию
фаголизосомы, в которой лизосомные ферменты (ДНКаза, РНКаза,
протеиназы, фосфотазы, эстеразы и др.) разрушают макромолекулы
микрооорганизмов.
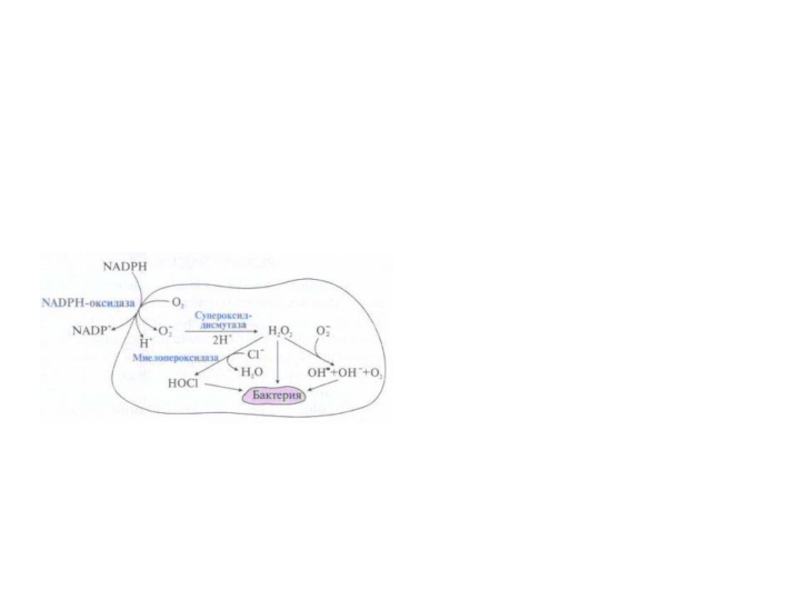
Фагоцитоз сопровождается резким увеличением потребления кислорода,
которое называется дыхательным взрывом.
Образование активных форм кислорода
фагоцитирующими клетками.
Активация НАДФН-оксидазы, вызывает
превращение кислорода в
супероксидный радикал, который
инициирует образование Н2О2, ОН•, НОСL
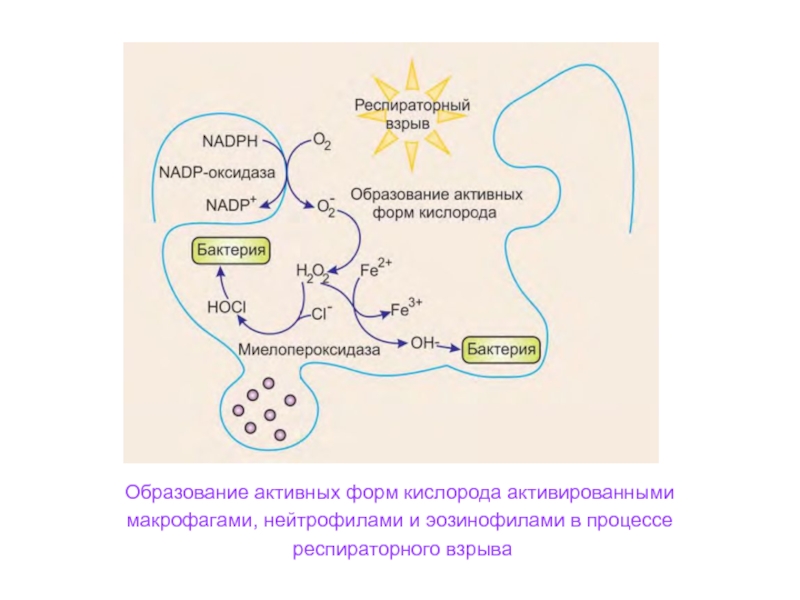
Слайд 55Образование активных форм кислорода активированными
макрофагами, нейтрофилами и эозинофилами в
процессе
респираторного взрыва
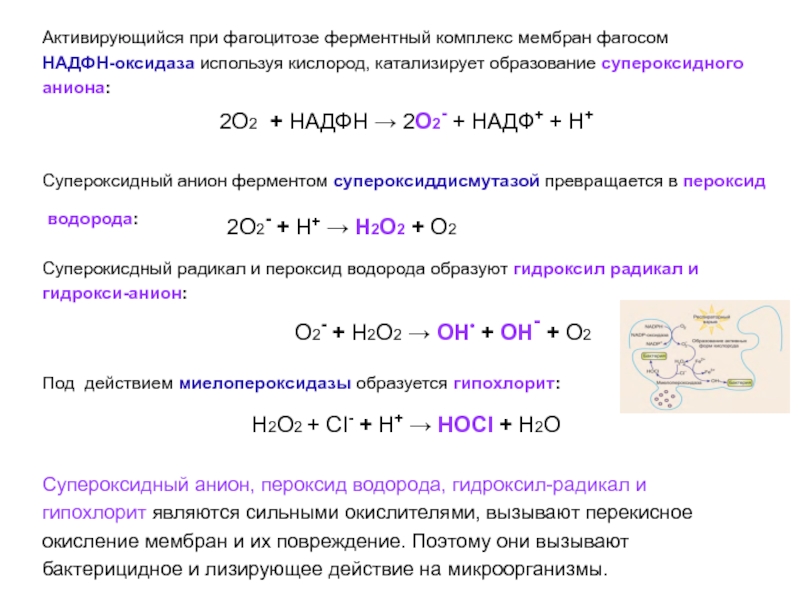
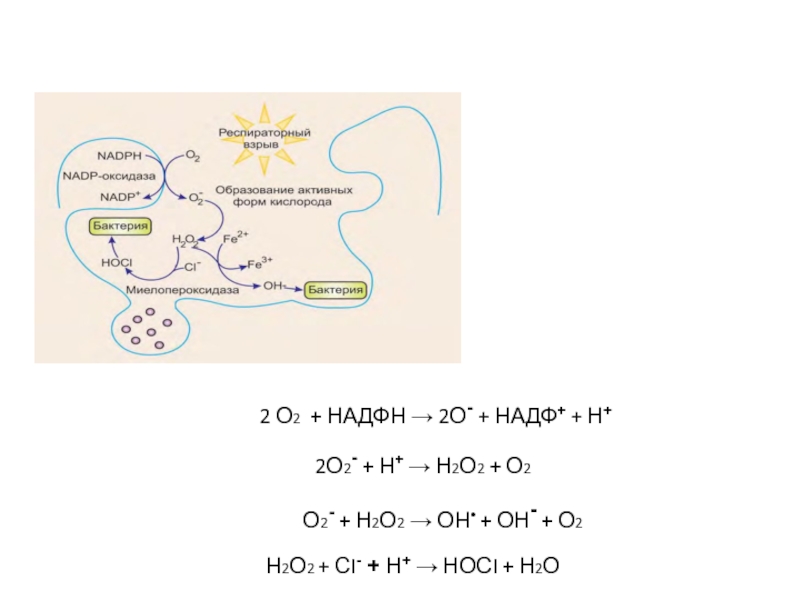
Слайд 56Активирующийся при фагоцитозе ферментный комплекс мембран фагосом
НАДФН-оксидаза используя кислород,
катализирует образование супероксидного
аниона:
2О2 + НАДФН → 2О2- + НАДФ+
+ Н+Супероксидный анион ферментом супероксиддисмутазой превращается в пероксид
водорода: 2О2- + Н+ → Н2О2 + О2
Суперокисдный радикал и пероксид водорода образуют гидроксил радикал и
гидрокси-анион:
О2- + Н2О2 → ОН• + ОН- + О2
Под действием миелопероксидазы образуется гипохлорит:
Н2О2 + СI- + Н+ → НОСI + Н2О
Супероксидный анион, пероксид водорода, гидроксил-радикал и
гипохлорит являются сильными окислителями, вызывают перекисное
окисление мембран и их повреждение. Поэтому они вызывают
бактерицидное и лизирующее действие на микроорганизмы.
Слайд 58Инактивация чужеродных веществ в организме
Чужеродные вещества, попадающие в организм из
ЖКТ, через кожу
и легкие и не использующиеся для пластических
и энергетическихцелей, называют ксенобиотиками. К ним относятся:
лекарства,
красители,
токсины бактерий и грибов,
пестициды,
продукты метаболизма кишечной микрофлоры и др….
Гидрофильные ксенобиотики выводятся из организма с мочёй. А
гидрофобные могут накапливаться и взаимодействовать с белками
и липидами клеток и нарушать их структуру и функции.
Механизмы обезвреживания ксенобиотиков происходят во многих
Тканях, но наиболее активно в печени.
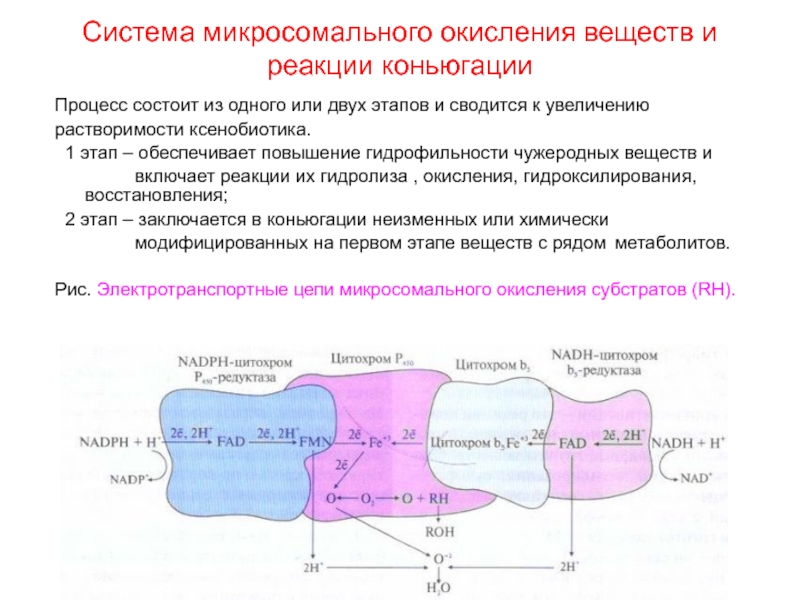
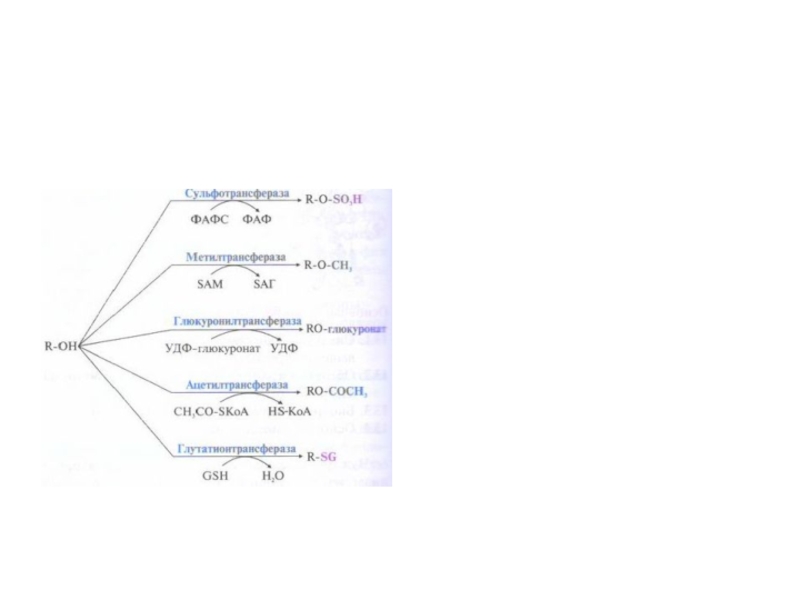
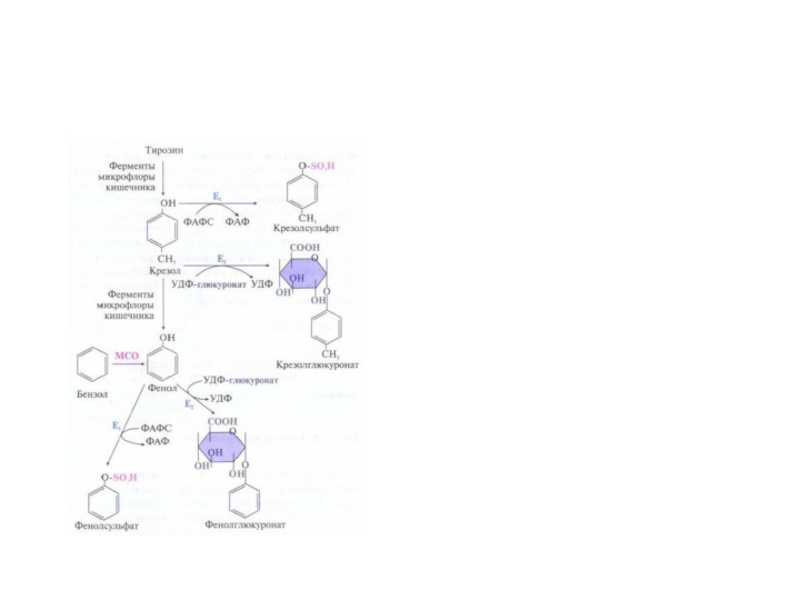
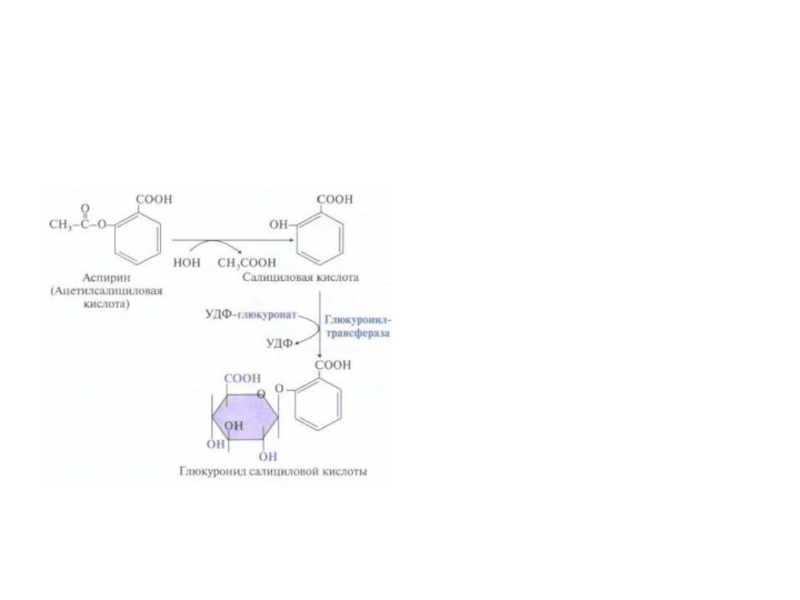
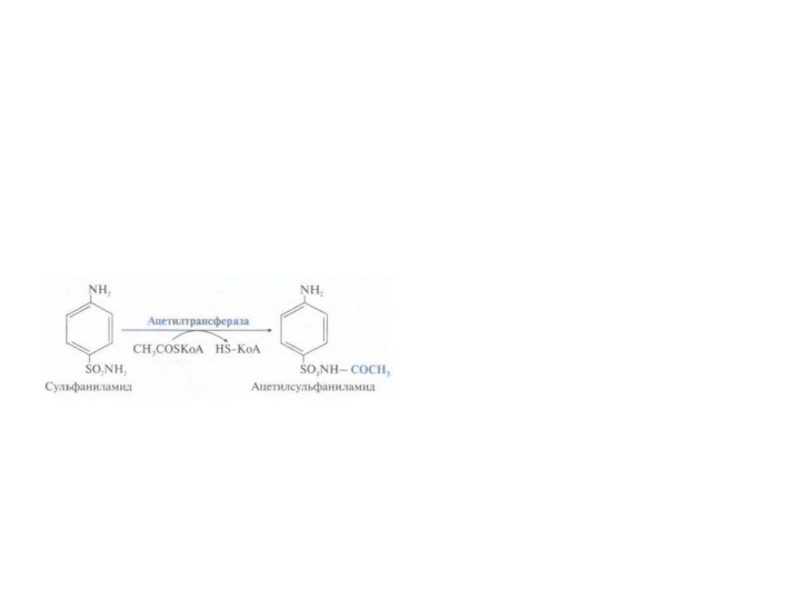
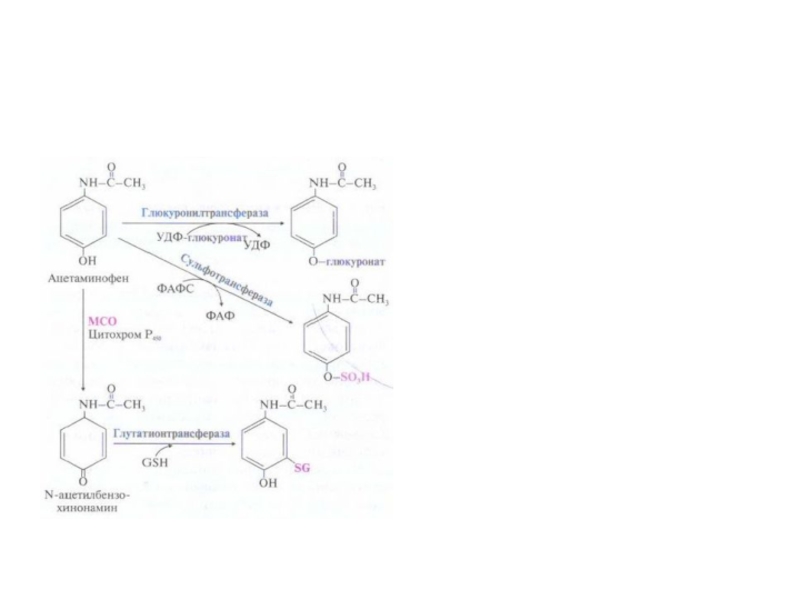
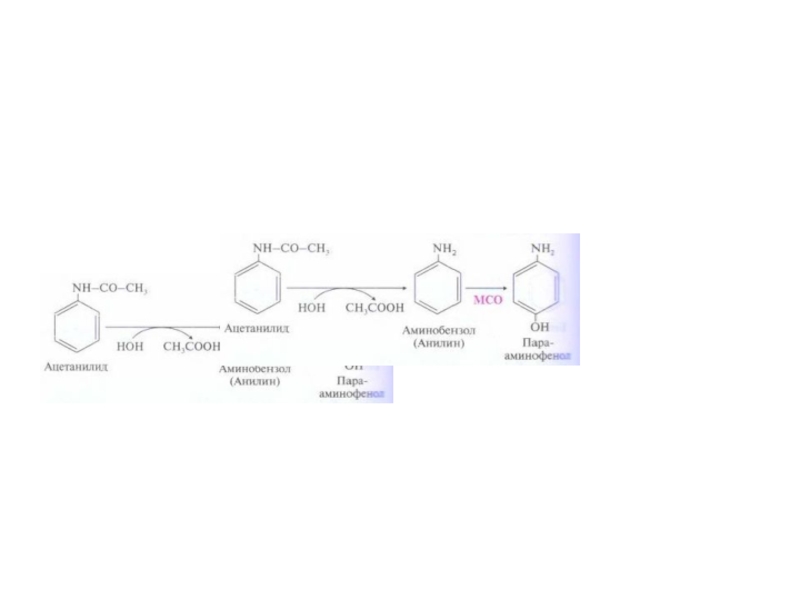
Слайд 59Система микросомального окисления веществ и реакции коньюгации
Процесс состоит из одного
или двух этапов и сводится к увеличению
растворимости ксенобиотика.
1
этап – обеспечивает повышение гидрофильности чужеродных веществ и включает реакции их гидролиза , окисления, гидроксилирования, восстановления;
2 этап – заключается в коньюгации неизменных или химически
модифицированных на первом этапе веществ с рядом метаболитов.
Рис. Электротранспортные цепи микросомального окисления субстратов (RН).
Слайд 68
2 О2 + НАДФН →
2О- + НАДФ+ + Н+
2О2- + Н+ →
Н2О2 + О2О2- + Н2О2 → ОН• + ОН- + О2
Н2О2 + СI- + Н+ → НОСI + Н2О