Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Теория полимолекулярной адсорбции Поляни
Содержание
- 1. Теория полимолекулярной адсорбции Поляни
- 2. Основные положения На поверхности адсорбента нет активных
- 3. В результате взаимодействия с поверхностью газ сжимается
- 4. Слайд 4
- 5. Рассматривая молекулы адсорбата как идеальный газ, можно
- 6. Зависимость адсорбционного потенциала (ε) от адсорбционного
- 7. Теория Поляни позволяет рассчитывать изотермы адсорбции различных
- 8. Адсорбционные потенциалы для разных адсорбатов на одном
- 9. Дальнейшие представления о многослойной адсорбции.Теория БЭТ.В 1915-1917
- 10. Современная обобщенная теория полимолекулярной адсорбции была развита
- 11. По теории БЭТ адсорбированная фаза может быть
- 12. С.Брунауэр, П.Эммет и Е.Теллер вывели уравнение полимолекулярной адсорбции БЭТ.
- 13. Расчет параметров адсорбции по уравнению БЭТ Для расчета
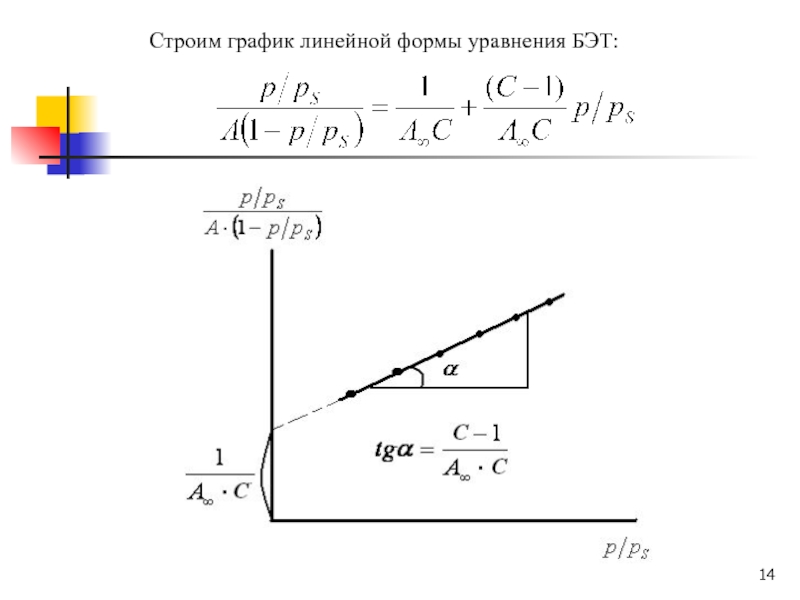
- 14. Строим график линейной формы уравнения БЭТ:
- 15. На тории БЭТ основан стандартный метод измерения
- 16. Применение уравнения БЭТ к описанию изотерм адсорбции
- 17. 2. Область высоких относительных давлений: р/рS >>
- 18. Ограничения теории БЭТ 1.
- 19. Адсорбция на пористых адсорбентах Пористые адсорбенты – твердые
- 20. макропористые тела (r > 200 нм), для
- 21. Капиллярная конденсация на пористых адсорбентах Поры тонкопористых адсорбентов
- 22. Конусообразная пораПри смачивании адсорбатом стенок поры,
- 23. 2. Цилиндрическая закрытая пора Т.к. радиус кривизны
- 24. 3. Цилиндрическая открытая пора сферический мениск цилиндрический
- 25. 4. Бутылкообразная пора. Заполнение поры начинается со
- 26. Реальные пористые сорбенты имеют поры различных размеров
- 27. Скачать презентанцию
Слайды и текст этой презентации
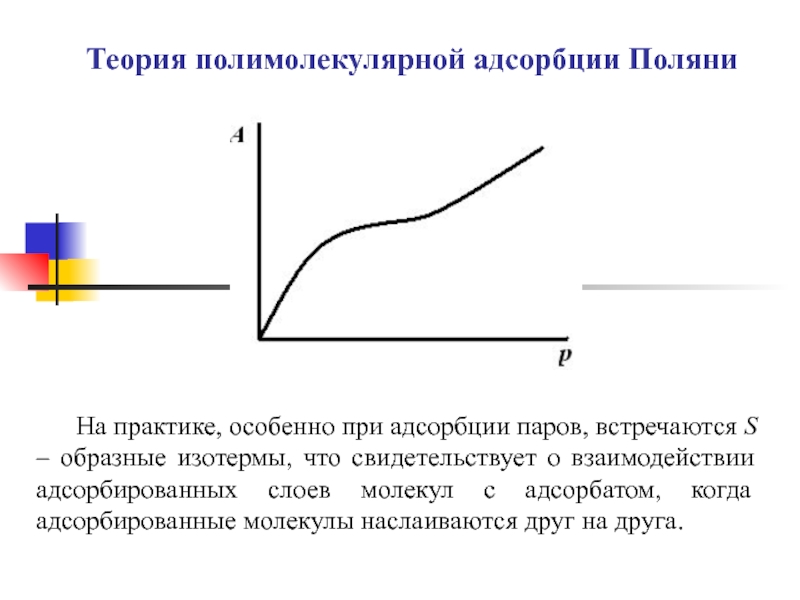
Слайд 1Теория полимолекулярной адсорбции Поляни
На практике, особенно при адсорбции паров, встречаются
Слайд 2Основные положения
На поверхности адсорбента нет активных центров.
Адсорбция обусловлена
физическими силами. Основной вклад вносят дальнодействующие дисперсионные силы аддитивные и
не зависящие от температуры.Адсорбционные силы действуют на больших расстояниях, что приводит к образованию полимолекулярного слоя. По мере удаления от поверхности действие адсорбционных сил уменьшается и на некотором расстоянии практически становится равным нулю.
Адсорбционные силы не зависят от температуры.
Практически все адсорбированное вещество на поверхности адсорбента находится в жидком состоянии.
Слайд 3 В результате взаимодействия с поверхностью газ сжимается до давления насыщенного
пара рS и переходит в жидкость.
При этом возникает адсорбционный
объем жидкости Vадс, который связан с величиной адсорбции соотношением:Vадс = А · Vm
Адсорбционный объем (толщиной l) может быть представлен рядом эквипотенциальных поверхностей, каждая из которых соответствует определенному значению адсорбционного потенциала (ε).
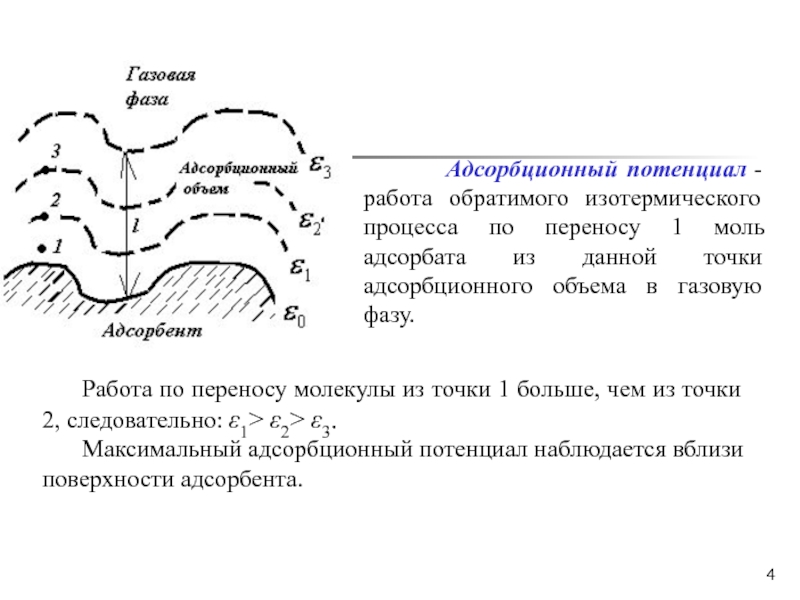
Слайд 4
Адсорбционный потенциал - работа обратимого изотермического процесса по переносу 1
моль адсорбата из данной точки адсорбционного объема в газовую фазу. Работа по переносу молекулы из точки 1 больше, чем из точки 2, следовательно: ε1> ε2> ε3.
Максимальный адсорбционный потенциал наблюдается вблизи поверхности адсорбента.
Слайд 5 Рассматривая молекулы адсорбата как идеальный газ, можно записать, что адсорбционный
потенциал равен работе расширения или сжатия идеального газа:
Слайд 6 Зависимость адсорбционного потенциала (ε) от адсорбционного объема (Vадс) Поляни
назвал характеристической кривой.
Характеристическая кривая не зависит от температуры и
индивидуальна для каждого вида адсорбента для сходных адсорбатов.ε ≠ f(Т)
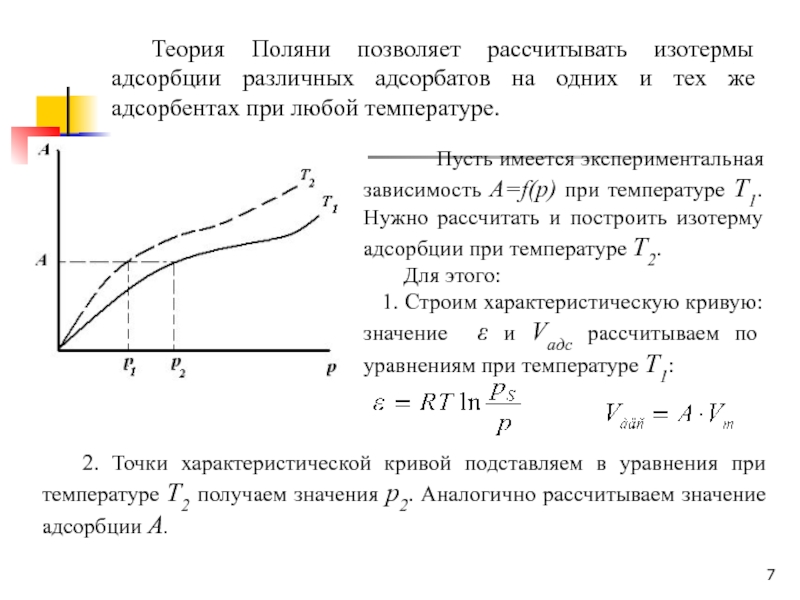
Слайд 7 Теория Поляни позволяет рассчитывать изотермы адсорбции различных адсорбатов на одних
и тех же адсорбентах при любой температуре.
Пусть имеется экспериментальная зависимость А=f(p) при температуре Т1. Нужно рассчитать и построить изотерму адсорбции при температуре Т2. Для этого:
1. Строим характеристическую кривую: значение ε и Vадс рассчитываем по уравнениям при температуре Т1:
2. Точки характеристической кривой подставляем в уравнения при температуре Т2 получаем значения р2. Аналогично рассчитываем значение адсорбции А.
Слайд 8 Адсорбционные потенциалы для разных адсорбатов на одном и том же
адсорбенте находятся в постоянном соотношении. Это соотношение называется коэффициентом аффинности
(близости, сродства ). Если имеется изотерма адсорбции и известно значение коэффициента аффинности для одного адсорбата, то можно построить изотерму адсорбции для другого адсорбата.
Теория Поляни:
не дает аналитического выражения для изотермы адсорбции;
позволяет вычислить адсорбцию любого адсорбата при любой температуре;
пригодна для описания адсорбции на пористых адсорбентах, в порах которых происходит конденсация пара.
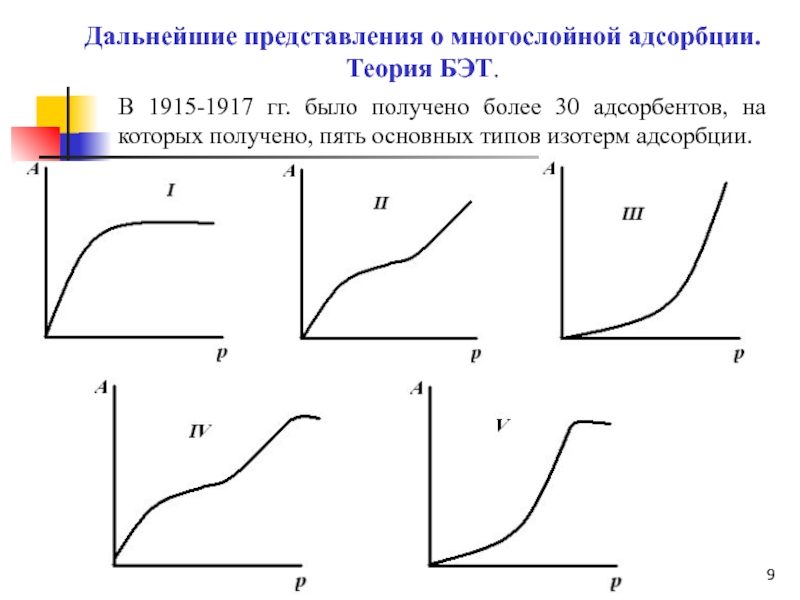
Слайд 9Дальнейшие представления о многослойной адсорбции.
Теория БЭТ.
В 1915-1917 гг. было получено
более 30 адсорбентов, на которых получено, пять основных типов изотерм
адсорбции.Слайд 10 Современная обобщенная теория полимолекулярной адсорбции была развита в 1935-1940 гг.
Брунауэром, Эмметом и Теллером. Эта теория получила название теории БЭТ
по первым буквам имен авторов.Основные положения
1. На поверхности адсорбента имеется определенное число энергетически равноценных активных центров.
2. Каждая молекула предыдущего слоя представляет собой возможный активный центр для адсорбции молекулы следующего адсорбционного слоя (адсорбция многослойна).
3. Первый слой адсорбата образуется в результате действия физических сил между адсорбентом и адсорбатом, последующие в результате конденсации.
4. Все молекулы во втором и более далеких слоях ведут себя подобно молекулам жидкости.
5. Возможно построение последующих слоев при незаполненном первом.
Слайд 11 По теории БЭТ адсорбированная фаза может быть представлена как совокупность
адсорбционных комплексов – цепей молекул.
Процесс адсорбции можно представить в
виде последовательных квазихимических реакций:где: – адсорбционный центр; В – молекула адсорбата;
– адсорбционный комплекс.
Слайд 13Расчет параметров адсорбции по уравнению БЭТ
Для расчета параметров адсорбции по
теории БЭТ уравнение полимолекулярной адсорбции приводят к линейному виду:
Перевернем полученное
уравнение:Приведем к линейному виду:
Слайд 15 На тории БЭТ основан стандартный метод измерения удельной поверхности Sуд
адсорбентов, катализаторов, порошков и др.
По экспериментальным данным находят величину
А∞, затем рассчитывают удельную поверхность адсорбента:
Адсорбаты - инертные газы (N2, Ar, Kr и др.), которые характеризуются слабым межмолекулярным взаимодействием на поверхности адсорбента.
Для увеличения адсорбции таких газов ее ведут при низких температурах, откуда и частое название метода БЭТ – метод низкотемпературной адсорбции.
Слайд 16Применение уравнения БЭТ к описанию изотерм адсорбции различного вида
или
1.
Область низких относительных давлений: р/рS
> 1 В области малых относительных давлений уравнение БЭТ переходит в уравнение Лэнгмюра.
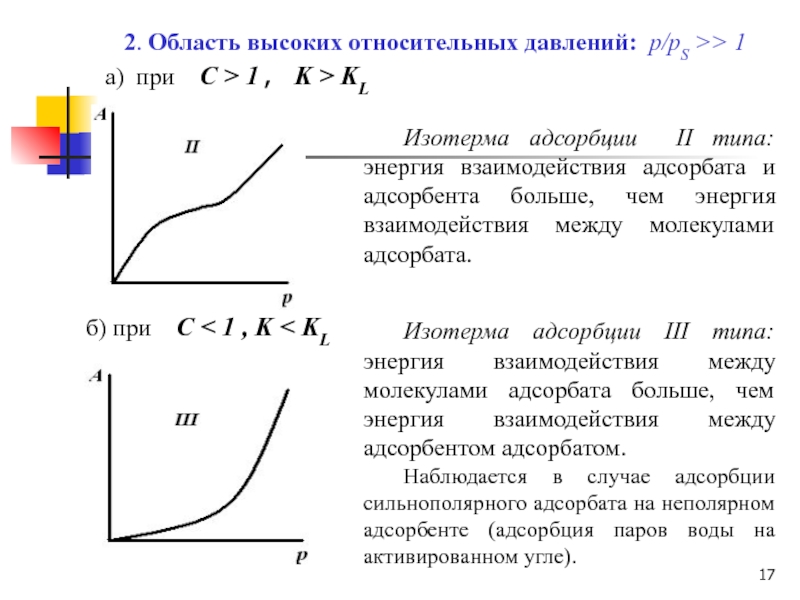
Слайд 172. Область высоких относительных давлений: р/рS >> 1
а) при
С > 1 , K > KL
Изотерма
адсорбции II типа: энергия взаимодействия адсорбата и адсорбента больше, чем энергия взаимодействия между молекулами адсорбата.б) при С < 1 , K < KL
Изотерма адсорбции III типа: энергия взаимодействия между молекулами адсорбата больше, чем энергия взаимодействия между адсорбентом адсорбатом.
Наблюдается в случае адсорбции сильнополярного адсорбата на неполярном адсорбенте (адсорбция паров воды на активированном угле).
Слайд 18Ограничения теории БЭТ
1. Уравнение БЭТ хорошо
выполняется при относительных давлениях:
Если р/рS < 0,05, то отклонения
связаны с неоднородностью поверхности.Если р/рS > 0,3, то отклонения связаны с боковыми взаимодействиями между молекулами адсорбата и капиллярной конденсацией.
2. Уравнение применимо для адсорбции паров, но не применимо для адсорбции газов (пар – жидкость конденсируется, газ – не конденсируется в жидкость).
3. Уравнение не описывает изотерму IV и V типов.
Слайд 19Адсорбция на пористых адсорбентах
Пористые адсорбенты – твердые тела, внутри которых
имеются поры, обуславливающие наличие внутренней межфазной поверхности.
Адсорбция на пористых
телах значительно выше адсорбции на ровной поверхности. Увеличение пористости сорбента приводит к увеличению Sуд и обеспечивает конденсацию пара при давлениях меньших, чем для ровной поверхности. Пористые сорбенты широко применяются в промышленности: в гетерогенном катализе, при улавливании выбросов предприятий (экология) и т.д.
Слайд 20макропористые тела (r > 200 нм), для количественного описания используют
уравнения Лэнгмюра;
мезопористые (переходнопористые) тела (r = 2 – 200 нм),
в порах - полимолекулярная адсорбция, которая заканчивается капиллярной конденсацией (силикагели, алюмогели), процесс адсорбции описывается теориями Поляни и БЭТ;микропористые тела (r = 0,5 – 2 нм) – молекулярные сита (цеолиты, алюмосиликаты, активированные угли, обладающие строго регулярной кристаллической структурой).
Классификация пористых сорбентов по размерам пор
(М.М. Дубинина)
Слайд 21Капиллярная конденсация на пористых адсорбентах
Поры тонкопористых адсорбентов в результате капиллярной
конденсации заполняются молекулами адсорбата уже в области малых относительных давлений
паров, так что адсорбция достигает предела.Капиллярная конденсация:
обусловлена наличием пор в адсорбенте
часто сопровождает физическую адсорбцию;
имеет место тогда, когда адсорбат смачивает стенки поры (вогнутый мениск);
характеризуется наличием петли гистерезиса на изотерме адсорбции.
сферическая пора
цилиндрическая пора
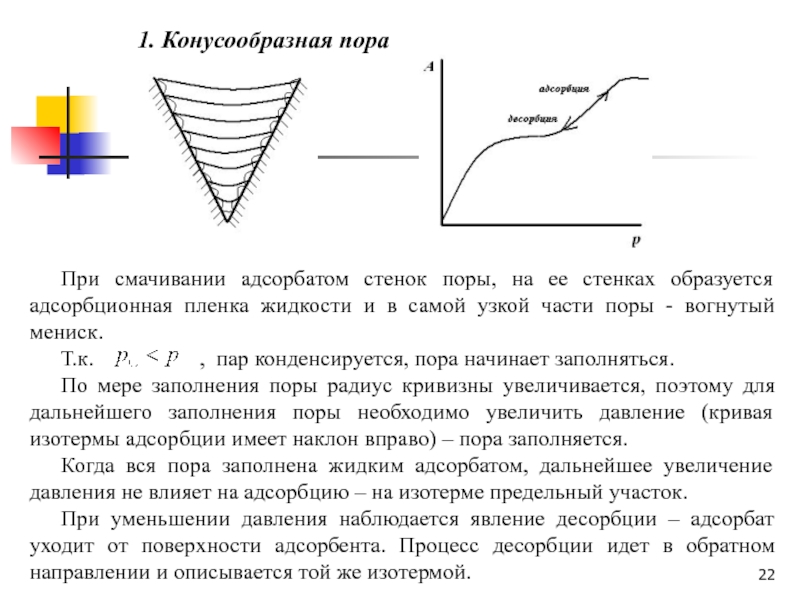
Слайд 22 Конусообразная пора
При смачивании адсорбатом стенок поры, на ее стенках
образуется адсорбционная пленка жидкости и в самой узкой части поры
- вогнутый мениск.Т.к. , пар конденсируется, пора начинает заполняться.
По мере заполнения поры радиус кривизны увеличивается, поэтому для дальнейшего заполнения поры необходимо увеличить давление (кривая изотермы адсорбции имеет наклон вправо) – пора заполняется.
Когда вся пора заполнена жидким адсорбатом, дальнейшее увеличение давления не влияет на адсорбцию – на изотерме предельный участок.
При уменьшении давления наблюдается явление десорбции – адсорбат уходит от поверхности адсорбента. Процесс десорбции идет в обратном направлении и описывается той же изотермой.
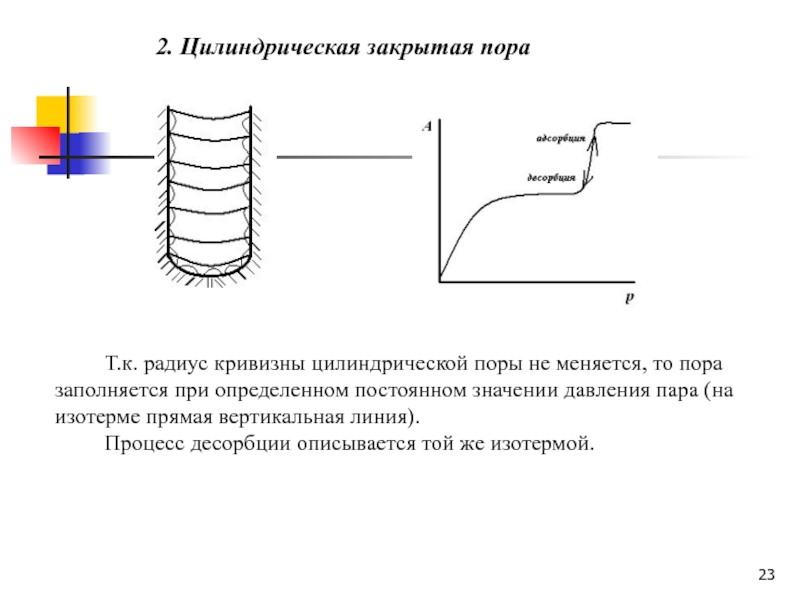
Слайд 232. Цилиндрическая закрытая пора
Т.к. радиус кривизны цилиндрической поры не
меняется, то пора заполняется при определенном постоянном значении давления пара
(на изотерме прямая вертикальная линия).Процесс десорбции описывается той же изотермой.
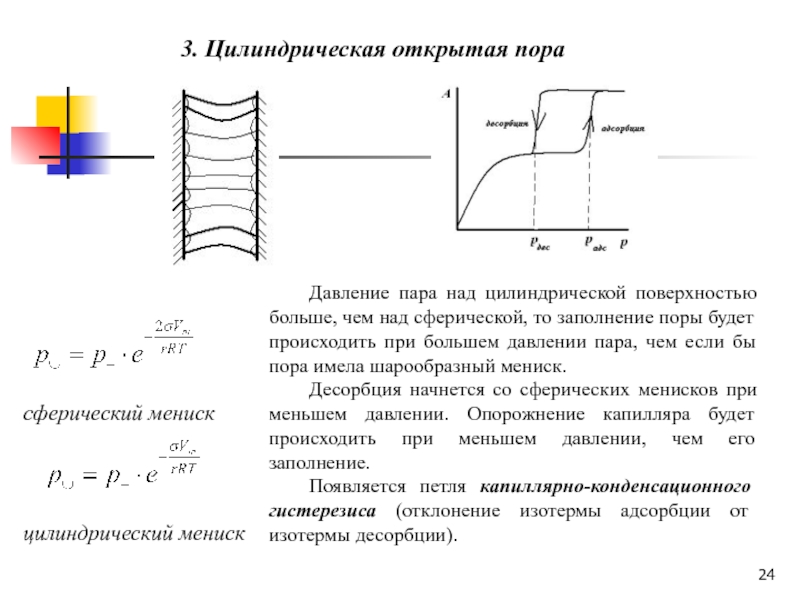
Слайд 243. Цилиндрическая открытая пора
сферический мениск
цилиндрический мениск
Давление пара
над цилиндрической поверхностью больше, чем над сферической, то заполнение поры
будет происходить при большем давлении пара, чем если бы пора имела шарообразный мениск.Десорбция начнется со сферических менисков при меньшем давлении. Опорожнение капилляра будет происходить при меньшем давлении, чем его заполнение.
Появляется петля капиллярно-конденсационного гистерезиса (отклонение изотермы адсорбции от изотермы десорбции).
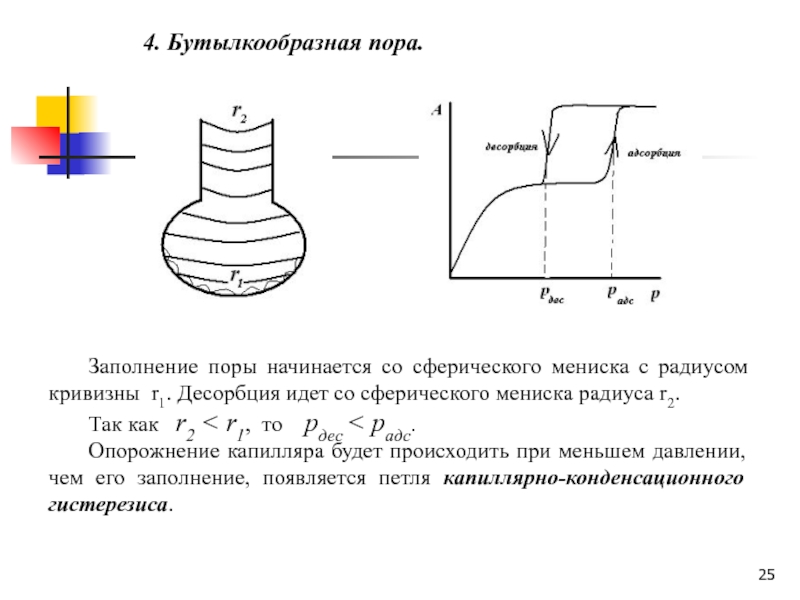
Слайд 254. Бутылкообразная пора.
Заполнение поры начинается со сферического мениска с
радиусом кривизны r1. Десорбция идет со сферического мениска радиуса r2.
Так как r2 < r1, то рдес < радс.
Опорожнение капилляра будет происходить при меньшем давлении, чем его заполнение, появляется петля капиллярно-конденсационного гистерезиса.
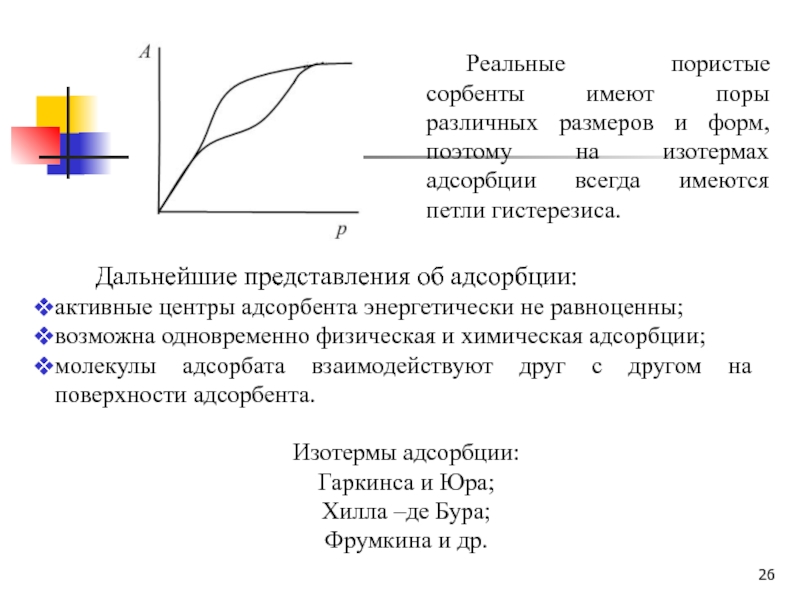
Слайд 26 Реальные пористые сорбенты имеют поры различных размеров и форм, поэтому
на изотермах адсорбции всегда имеются петли гистерезиса.
Дальнейшие представления об
адсорбции:активные центры адсорбента энергетически не равноценны;
возможна одновременно физическая и химическая адсорбции;
молекулы адсорбата взаимодействуют друг с другом на поверхности адсорбента.
Изотермы адсорбции:
Гаркинса и Юра;
Хилла –де Бура;
Фрумкина и др.