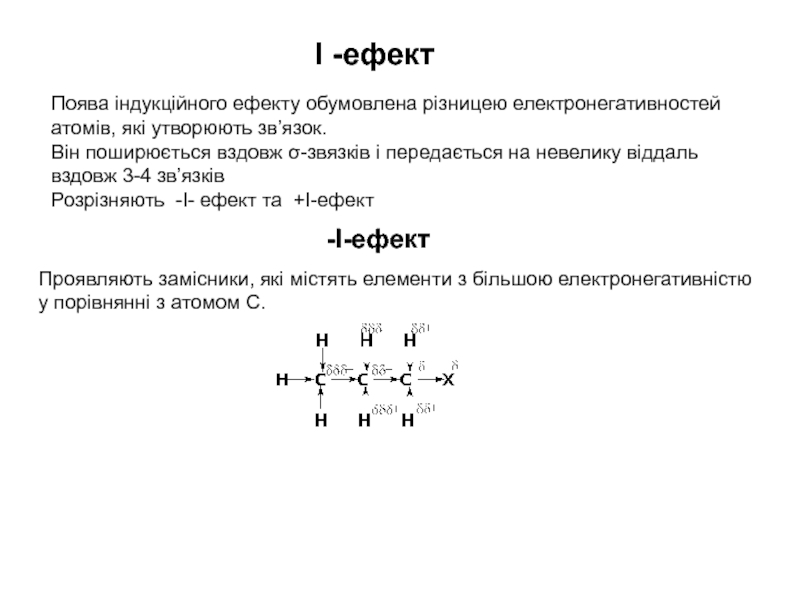
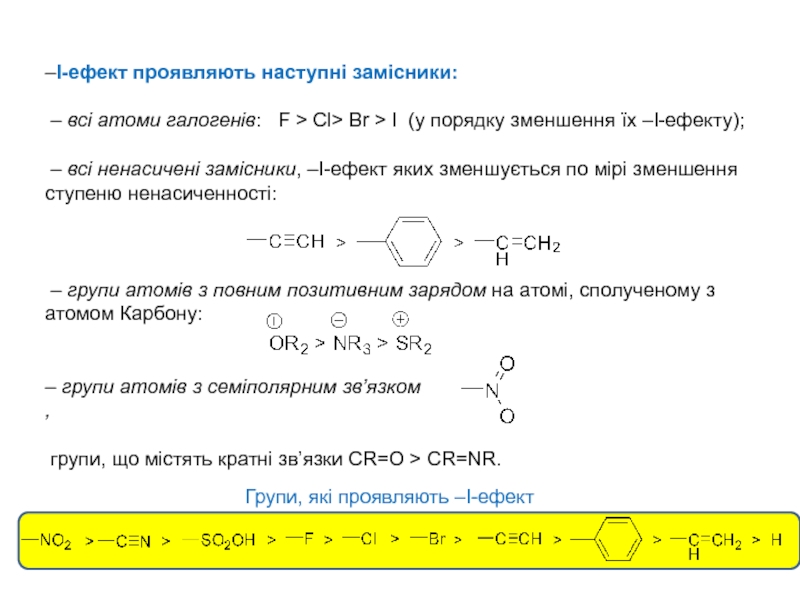
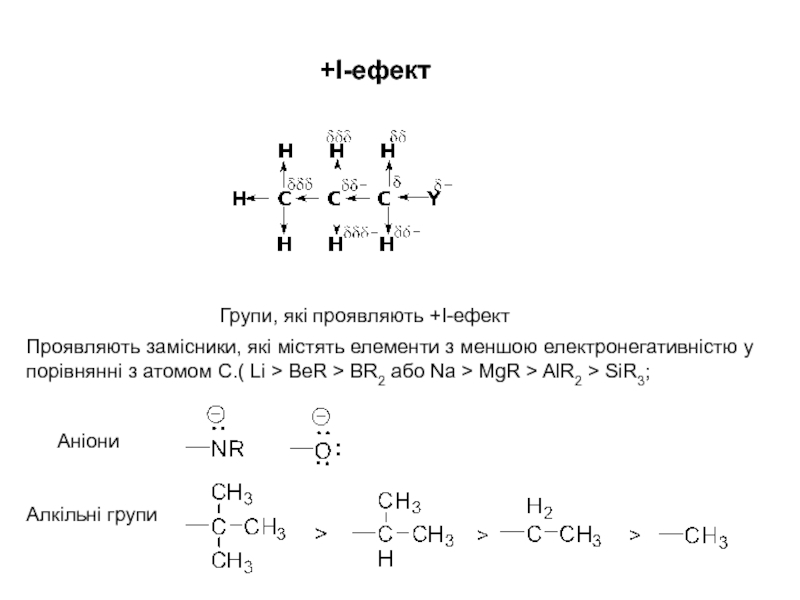
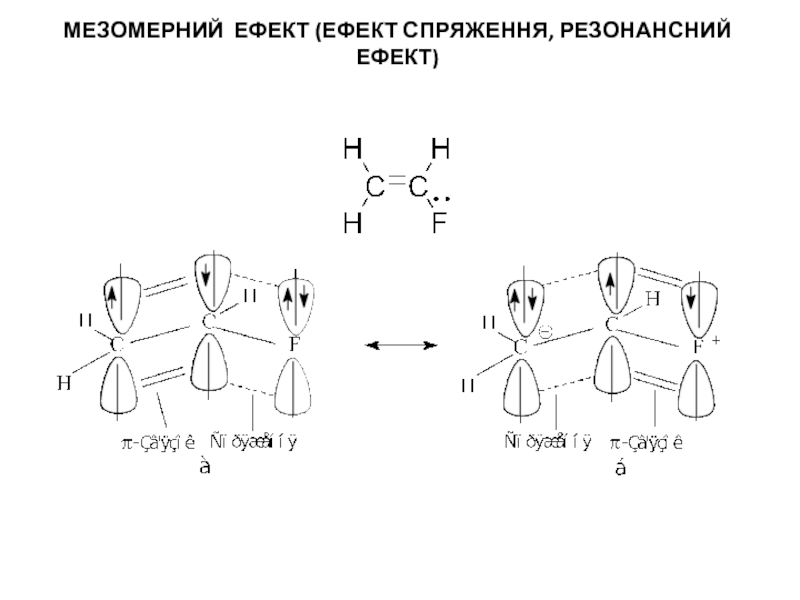
процесами, в яких відбувається розщеплення одних зв’язків та утворення інших,
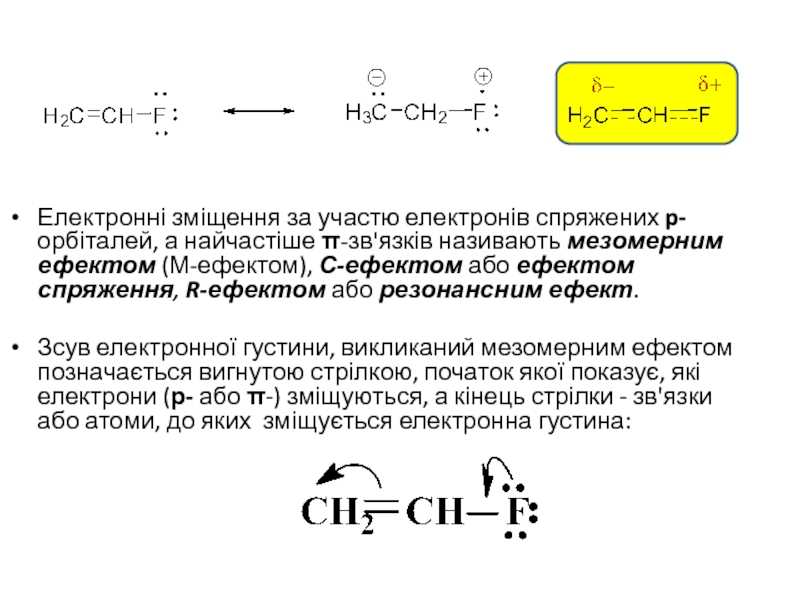
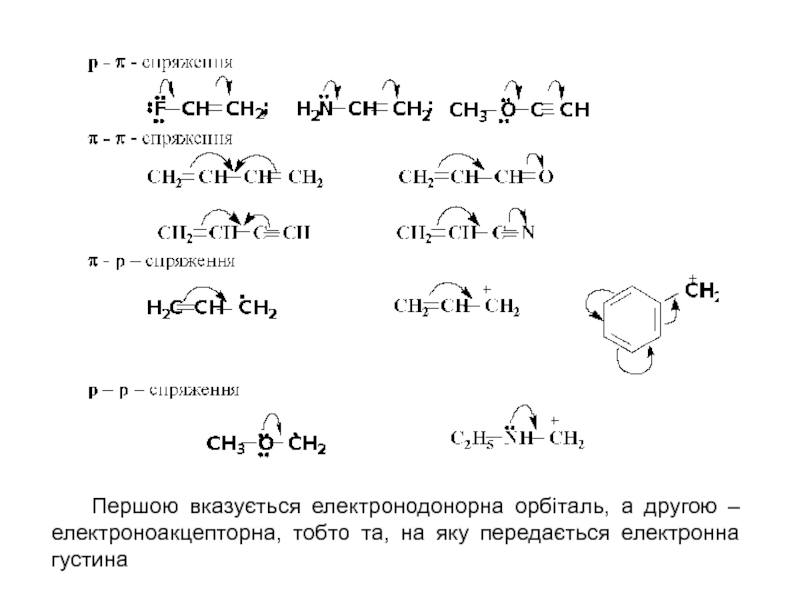
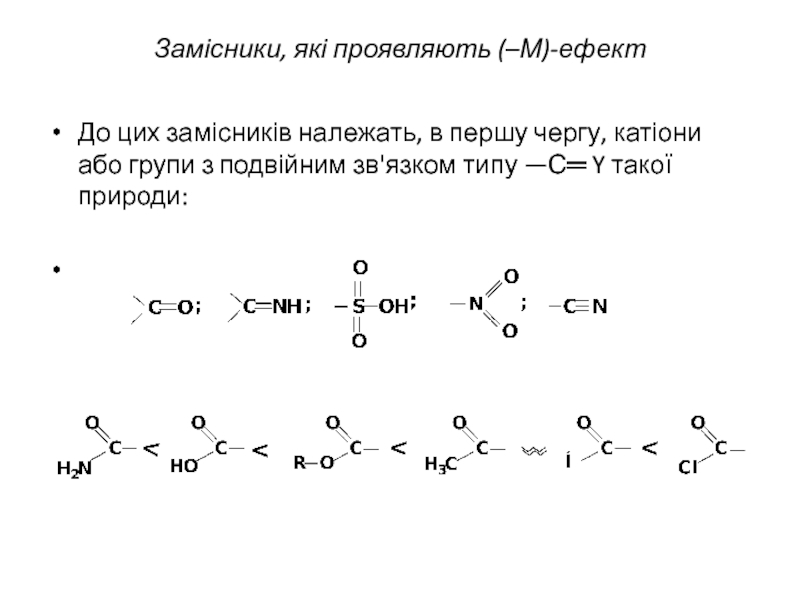
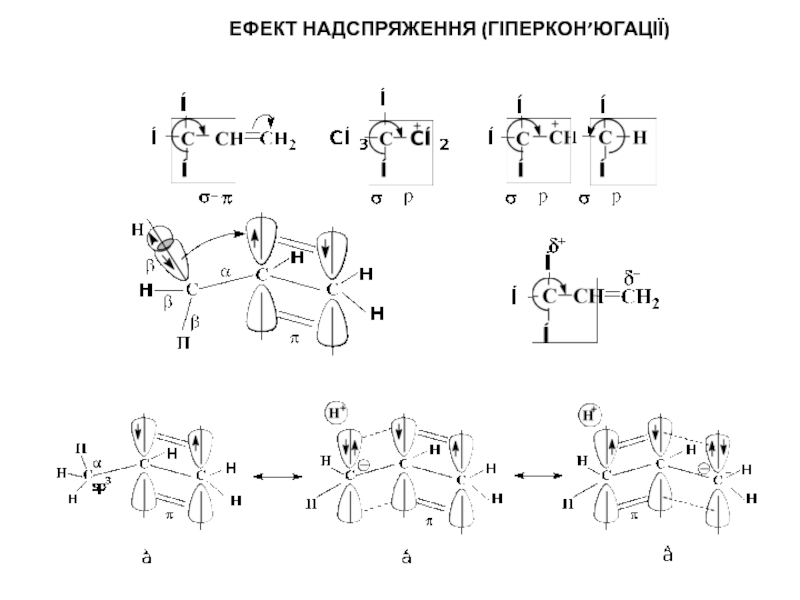
то напрямок хімічної реакції суттєво залежить від розподілу електронної густини в молекулах реагуючих речовин.Електрони не розподілені рівномірно по всій молекулі. Навіть в формально нейтральних молекулах є місця з підвищеним негативним зарядом і є місця з підвищеним позитивним зарядом. Отже молекули, а також у більшій чи меншій мірі поляризовані. Розподіл електронної густини в молекулі залежить від взаємного впливу атомів.