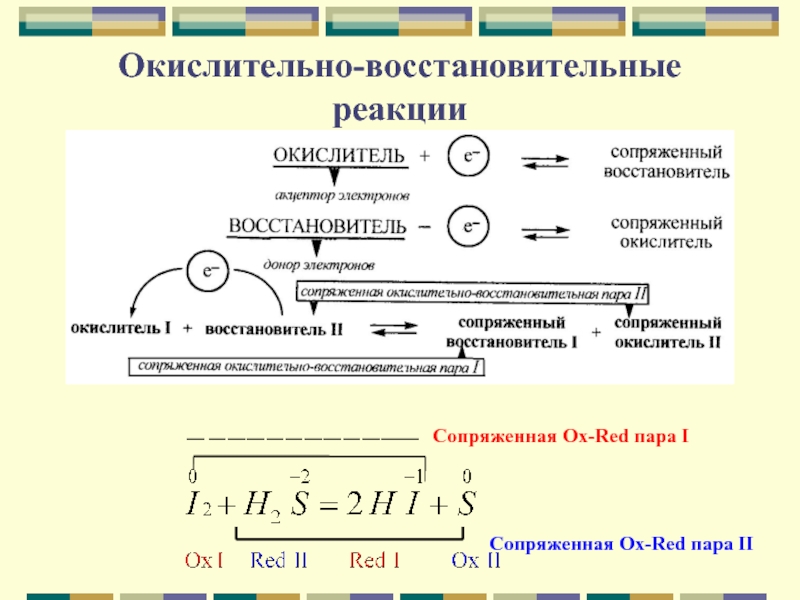
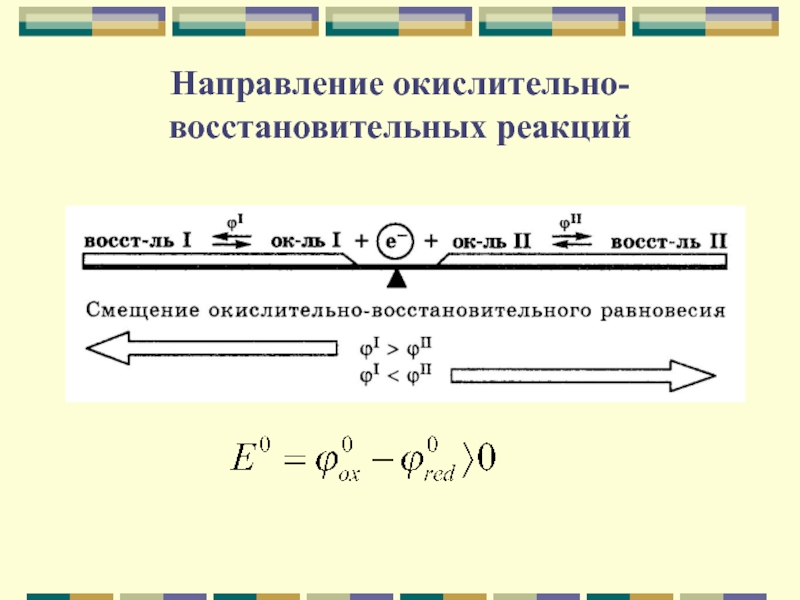
молекул или ионов к другим
Окисление – процесс отдачи электронов атомом,
молекулой или ионом.Восстановление – процесс присоединения электронов атомом, молекулой или ионом.
e
Mg0 - 2e → Mg2+
2Н+ + 2e → Н2