CH2COOH
HN
CH2COOH
Нитрилотриуксусная кислота – комплексон I, трилон А:
CH2COOH
N CH2COOH
CH2COOH
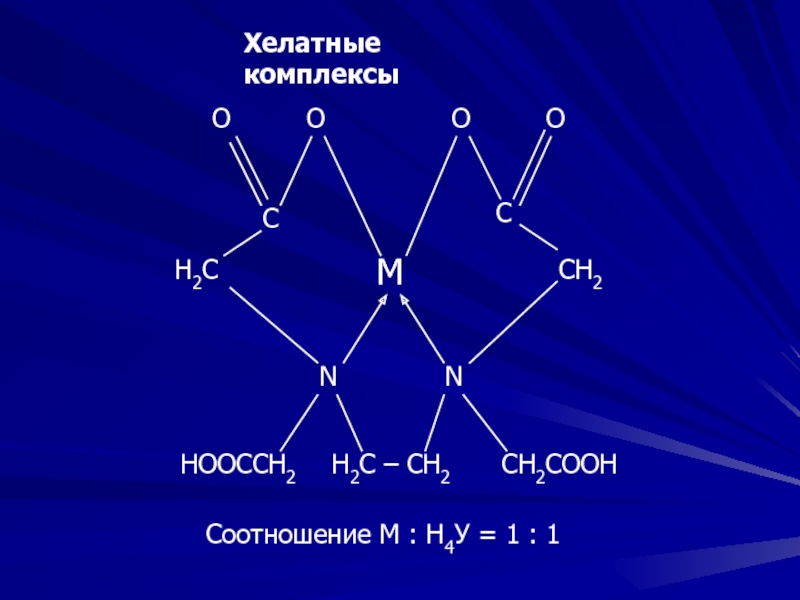
Этилендиаминтетрауксусная кислота – ЭДТУ, комплексон II
(динатриевая соль – ЭДТА, комплексон III) - Н4У :
HOOCH2C CH2COOH
N – CH2 – CH2 - N
HOOCH2C CH2COOH