Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Уральский государственный аграрный университет д.х.н., проф. Хонина Татьяна
Содержание
- 1. Уральский государственный аграрный университет д.х.н., проф. Хонина Татьяна
- 2. Органическая химия ч.1. Алифатические углеводороды
- 3. План1. Введение в органическую химию. Теория строения
- 4. п.1. Введение в органическую химию.
- 5. п.1. Введение в органическую химию.
- 6. 4
- 7. Теория строения органических веществ А.М. Бутлерова 1. Атомы
- 8. Изомерия6
- 9. Гомологи7
- 10. п.2. Классификация органических веществКлассификация по типу углеродного
- 11. Классификация органических веществ (продол.) Классификация по
- 12. п.3. Углеводороды. Углеводороды. Классификация углеводородов10
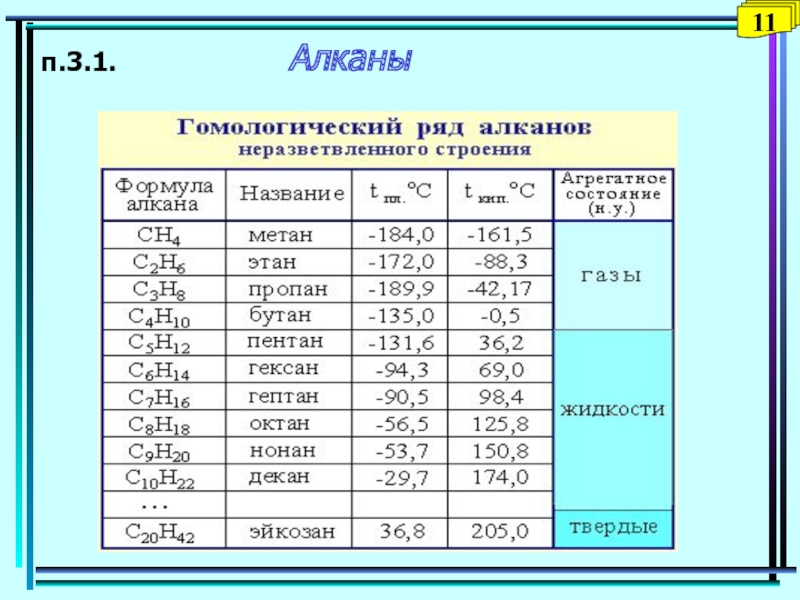
- 13. п.3.1. Алканы11
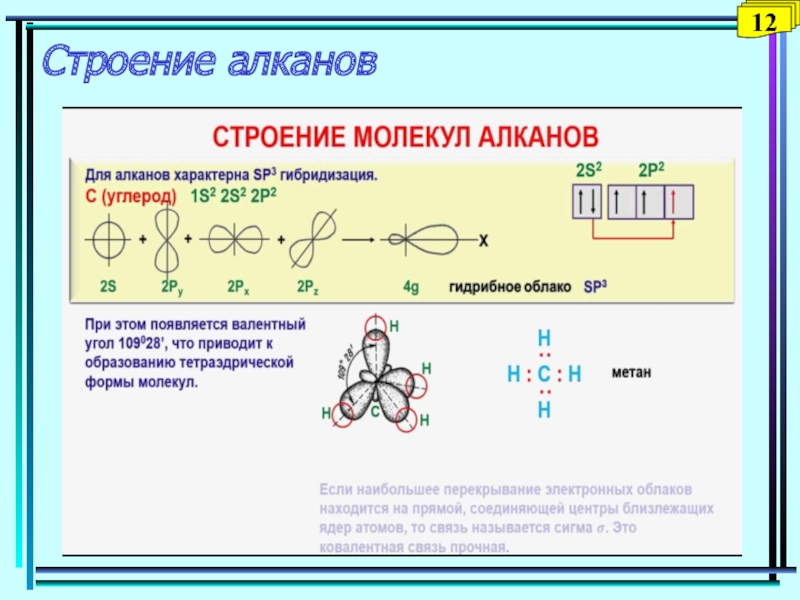
- 14. Строение алканов12
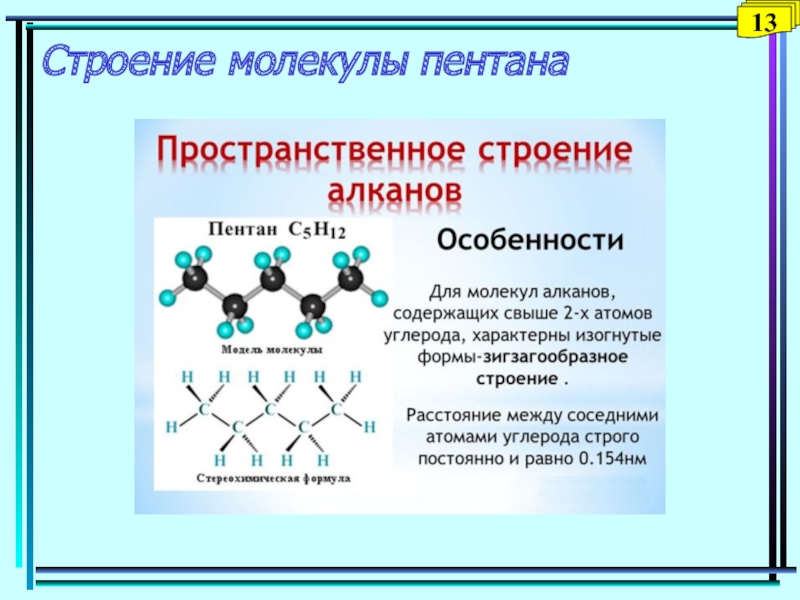
- 15. Строение молекулы пентана13
- 16. Изомерия. НоменклатураИзомерия углеродного скелета ( у пентана 3 изомера: н-пентан, 2-метилбутан, 2,2-диметилпропан)Номенклатура14
- 17. Методы получения алкановАлканы, как правило, получают разделением
- 18. 16
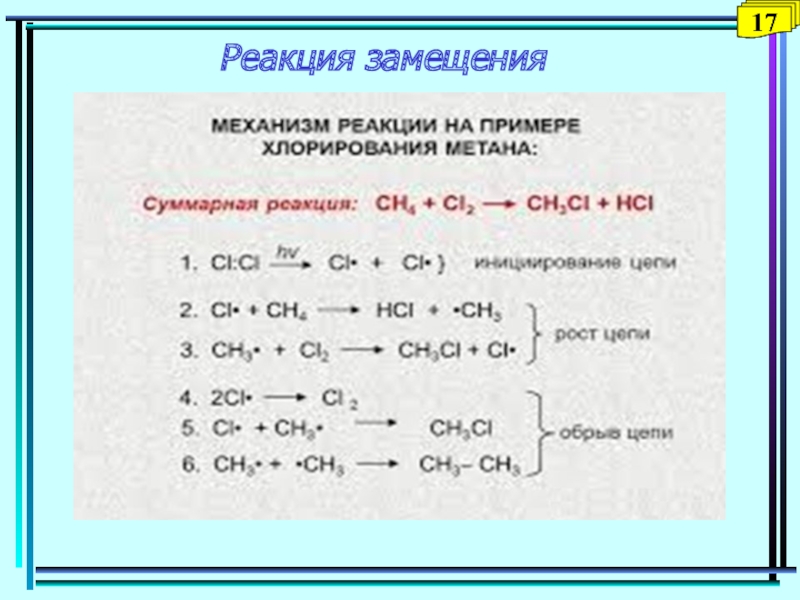
- 19. Реакция замещения1417
- 20. Непредельные
- 21. Изомерия и номенклатураСтРУКТУРНАЯПРОСТРАНСТВЕННАЯИЗОМЕРИЯ20
- 22. Методы получения алкенов1. Дегидрирование алканов:
- 23. Химические свойства алкенов1. Присоединение водорода:
- 24. Правило Марковникова В.В.Водород галогенводорода присоединяется к более
- 25. Реакции окисленияГорение:
- 26. Реакция полимеризации Процесс соединения многих одинаковых молекул в более крупные молекулы называется реакцией полимеризации.25
- 27. Алкадиены26
- 28. Алкины. АцетиленАлкины – углеводороды, содержащие кроме σ-связей
- 29. Методы получения алкинов Общий способ получения алкинов –
- 30. Химические свойства ацетилена
- 31. Химические свойства ацетилена (прод.) 3. Реакция гидратации (реакция
- 32. Химические свойства ацетилена (прод.) 4. Реакция замещения Атом
- 33. Органическая химияЧ.2.Ароматические углеводороды
- 34. План1. Понятие ароматичности. Правило Хюккеля. 2. Номенклатура
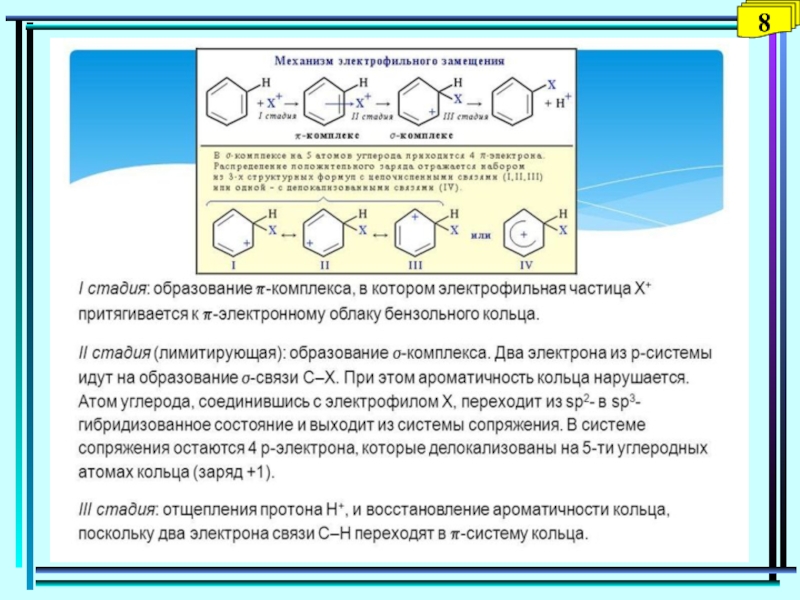
- 35. П.1. Понятие ароматичности. Правило Хюккеля
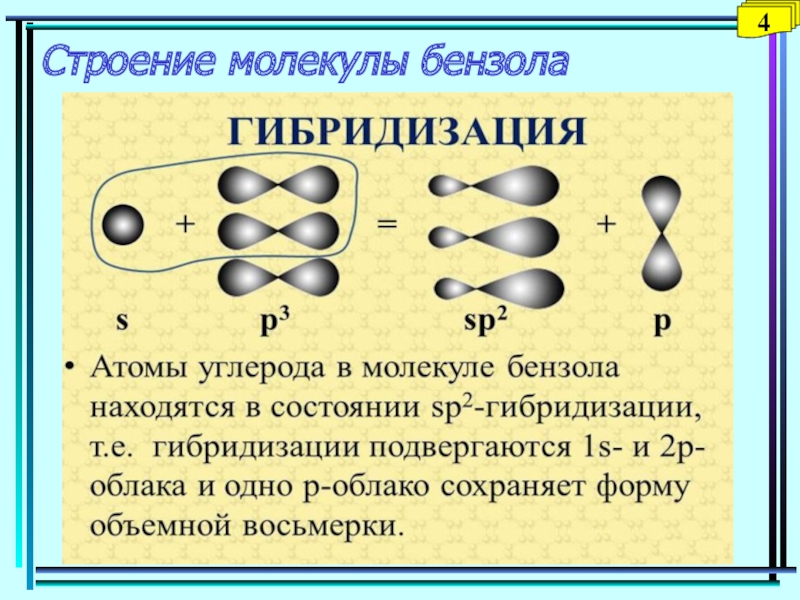
- 36. Строение молекулы бензола4
- 37. Правило Хюккеля Для образования устойчивой ароматической системы
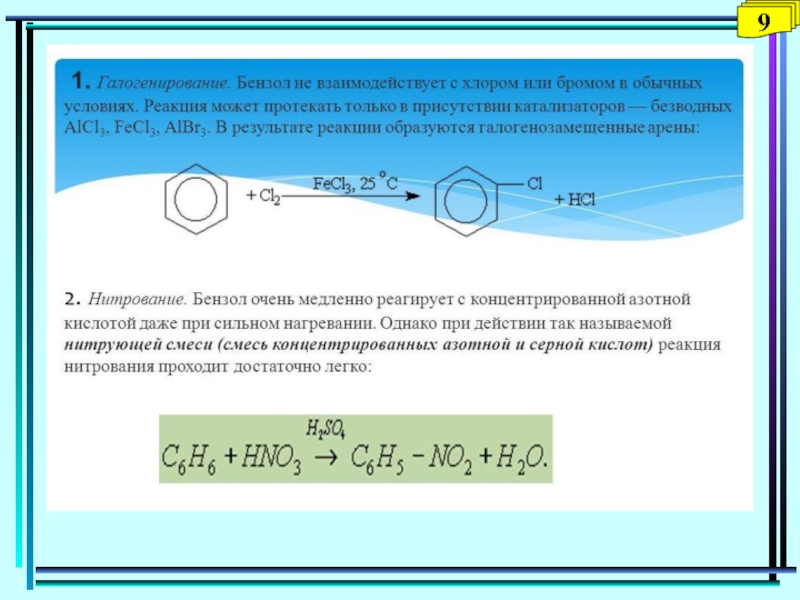
- 38. Методы получения бензола6
- 39. 7
- 40. 8
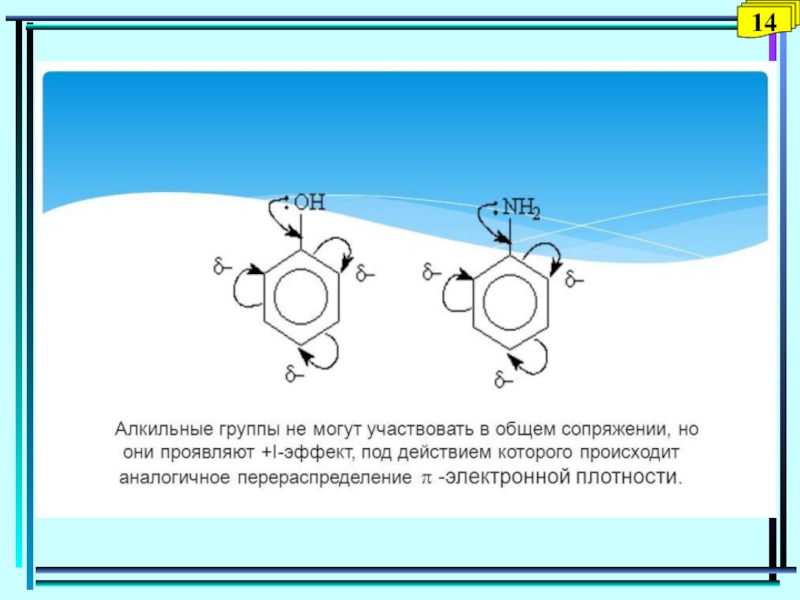
- 41. 9
- 42. 10
- 43. 11
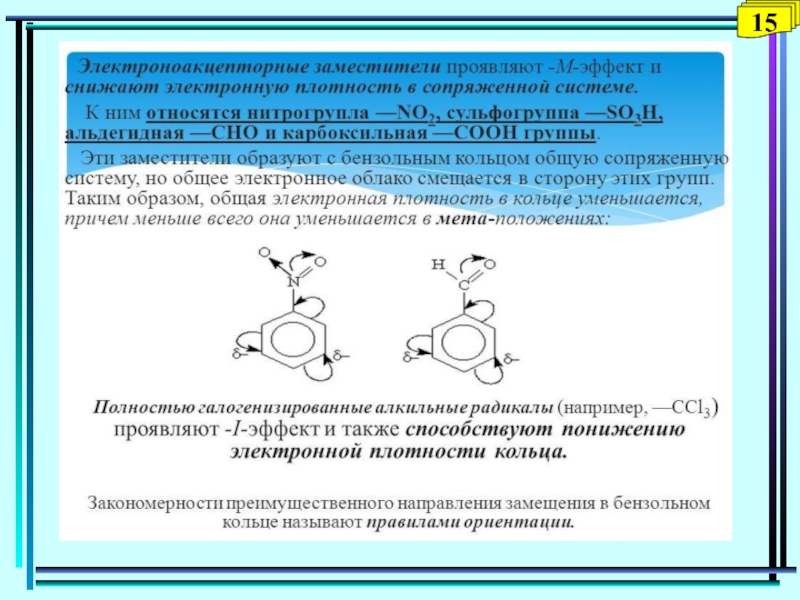
- 44. 12
- 45. 13
- 46. 14
- 47. 15
- 48. 16
- 49. 17
- 50. 18
- 51. 19
- 52. 20
- 53. 21
- 54. 22
- 55. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Уральский государственный
аграрный университет
д.х.н., проф. Хонина Татьяна Григорьевна
Органическая химия
ч.1.
Алифатические углеводороды
Слайд 3План
1. Введение в органическую химию. Теория строения А.М. Бутлерова. Основные
понятия: гомологи, изомеры, радикалы, функциональные группы, индуктивный и мезомерный эффекты.
2. Классификация органических веществ.
3. Углеводороды:
3.1. Предельные углеводороды (алканы).
3.2. Этиленовые углеводороды (алкены).
3.3. Алкадиены.
3.4. Алкины.
2
Слайд 4 п.1. Введение в органическую химию. Теория строения А.М.
Бутлерова. Основные понятия: гомологи, изомеры, радикалы, функциональные группы, индуктивный и
мезомерный эффекты.Органическая химия – химия углеводородов и их производных.
Углеводороды (УВ) – простейшие органические вещества, молекулы которых состоят из атомов только двух элементов: С и Н (СН4, С4Н10).
Производные УВ – продукты замещения атомов «Н» в молекулах УВ на другие атомы или группы атомов.
3
Слайд 5 п.1. Введение в органическую химию. Теория строения А.М.
Бутлерова. Основные понятия: гомологи, изомеры, радикалы, функциональные группы, индуктивный и
мезомерный эффекты.Органическая химия – химия углеводородов и их производных.
Углеводороды (УВ) – простейшие органические вещества, молекулы которых состоят из атомов только двух элементов: С и Н (СН4, С4Н10).
Производные УВ – продукты замещения атомов «Н» в молекулах УВ на другие атомы или группы атомов.
3
Слайд 7Теория строения органических веществ А.М. Бутлерова
1. Атомы в молекулах соединены
друг с другом не беспорядочно, а в определенной последовательности, согласно
их валентности.2. Свойства веществ зависят не только от того, атомы каких элементов и в каком количестве входят в состав молекул, но и от последовательности соединения атомов в молекулах, т.е. от их химического строения.
3. Атомы или группы атомов, входящих в состав молекулы, взаимно влияют друг на друга. Это взаимное влияние определяет свойства веществ.
4. Строение молекул может быть установлено на основе изучения их химических свойств. И наоборот: зная строение вещества, можно предсказать его свойства.
5
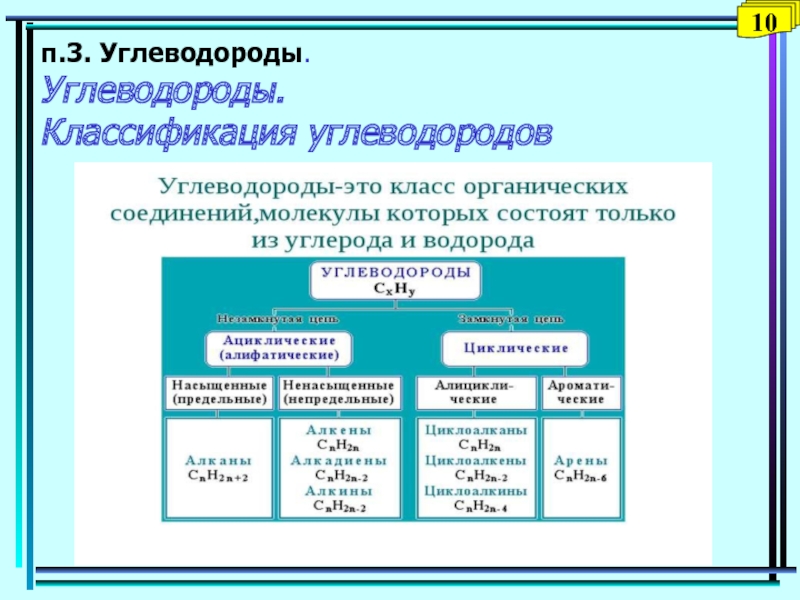
Слайд 10п.2. Классификация органических веществ
Классификация по типу углеродного скелета
В зависимости от
строения углеродного скелета органические соединения разделяют на ациклические – соединения
с открытой (незамкнутой) углеродной цепью и циклические.Ациклические соединения могут быть как насыщенными, так и ненасыщенными.
Циклические соединения – соединения с замкнутой цепью – в зависимости от природы атомов, составляющих цикл, делят на карбоциклические и гетероциклические.
Карбоциклические соединения содержат в цикле только атомы углерода и делятся на две существенно различающиеся по химическим свойствам группы: алифатические циклические (сокращенно алициклические) и ароматические. Гетероциклические соединения содержат в цикле, кроме атомов углерода, один или несколько атомов других элементов – гетероатомов.
8
Слайд 11Классификация органических веществ (продол.)
Классификация по типу функциональной группы
В
большинстве органических соединений, кроме атомов углерода и водорода, содержатся атомы
других элементов (не входящие в скелет). Эти атомы или их группировки, во многом определяющие физические и химические свойства органических соединений, называют функциональными группами.Важнейшие функциональные группы:
−F, −Cl, −Br, −I (галоген) галогенпроизводные
−OH (гидроксил) спирты, фенолы
>C=O (карбонил) альдегиды, кетоны
−COOH (карбоксил) карбоновые кислоты
−NH2, >NH, >N− (аминогруппа) амины
−NO2 (нитрогруппа) нитросоединения
−SO3H (сульфогруппа) сульфокислоты
9
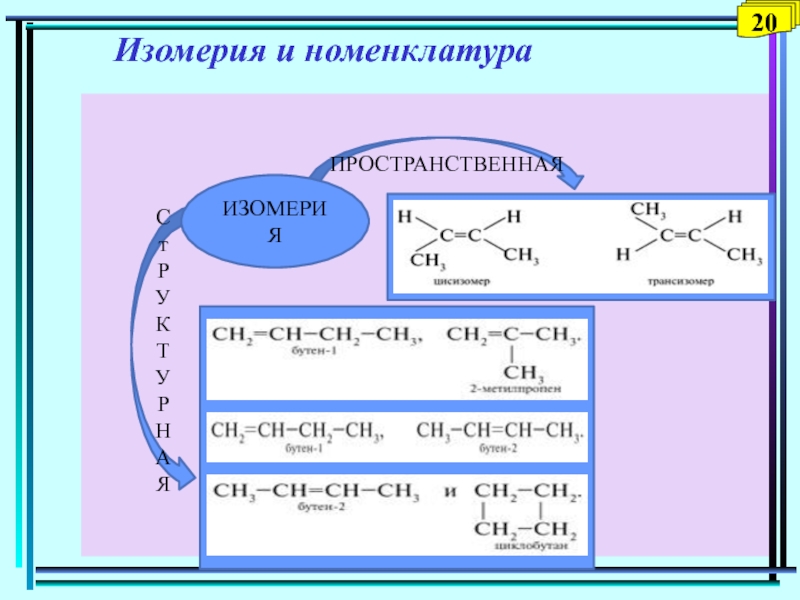
Слайд 16 Изомерия. Номенклатура
Изомерия углеродного скелета ( у пентана 3
изомера: н-пентан, 2-метилбутан, 2,2-диметилпропан)
Номенклатура
14
Слайд 17Методы получения алканов
Алканы, как правило, получают разделением природных смесей углеводородов.
Лабораторных способов получения немного:
1. Гидрирование алкенов
Сn Н2n + Н2 →
Сn H2n+22. Взаимодействие галогеналканов с активными металлами (Реакция Вюрца)
2 RBr + 2 Na → R—R + 2 NaBr
3. Термическое декарбоксилирование солей органических кислот t
R−COONa + NaOH → R−H + Na2CO3
15
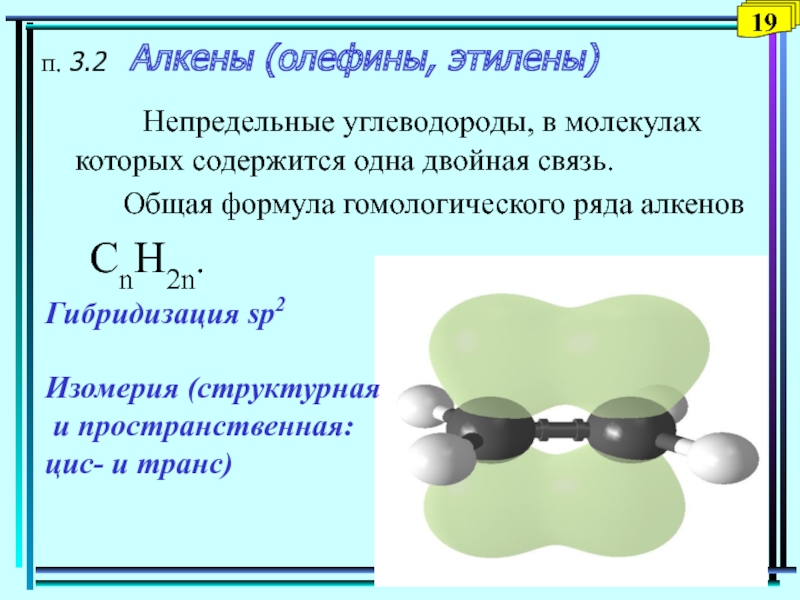
Слайд 20 Непредельные углеводороды, в молекулах
которых содержится одна двойная связь.
Общая
формула гомологического ряда алкенов CnH2n.
Гибридизация sp2
Изомерия (структурная
и пространственная:
цис- и транс)
п. 3.2 Алкены (олефины, этилены)
19
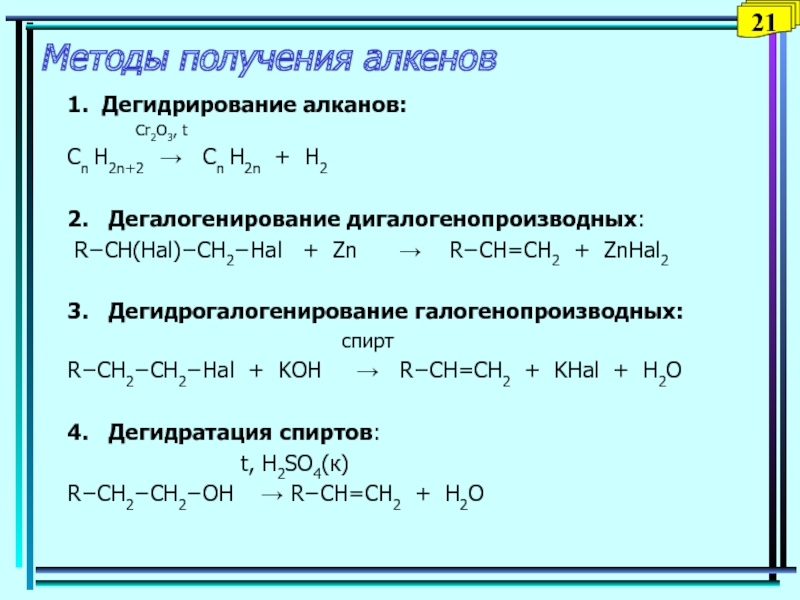
Слайд 22Методы получения алкенов
1. Дегидрирование алканов:
Cr2O3, t
Сn H2n+2 → Cn H2n
+ H22. Дегалогенирование дигалогенопроизводных:
R−CH(Hal)−CH2−Hal + Zn → R−CH=CH2 + ZnHal2
3. Дегидрогалогенирование галогенопроизводных:
спирт
R−CH2−CH2−Hal + KOH → R−CH=CH2 + KHal + H2O
4. Дегидратация спиртов:
t, H2SO4(к)
R−CH2−CH2−OH → R−CH=CH2 + H2O
21
Слайд 23Химические свойства алкенов
1. Присоединение водорода:
Н2С=СН2 + H2 → Н3С—СН3
2.
Присоединение галогенов: Н2С=СН2 + Cl2 → ClH2C—CH2Cl
3. Присоединение галогеноводородов:
H2С=СН2 + НВr → Н3С—CH2Вr
4. Присоединение воды (реакция гидратации):
H2С=СН2 + Н2О → Н3С—CH2ОН
22
Слайд 24Правило Марковникова В.В.
Водород галогенводорода присоединяется к более гидрогенизированному атому углерода
при двойной связи, а галоген – к менее гидрогенизированному.
H3C—CH=CH2 + H—Br → H3C—CH—CH3|
Br
Реакция идет по ионному механизму.
23
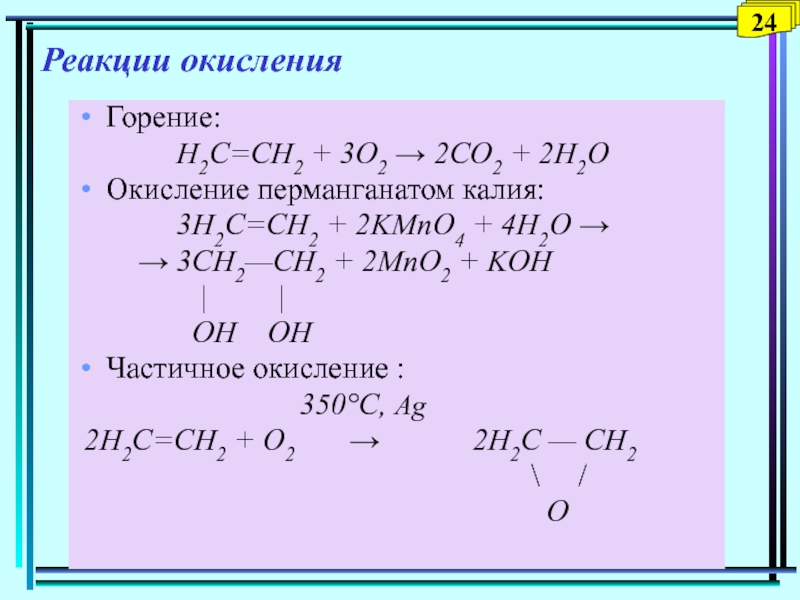
Слайд 25Реакции окисления
Горение:
Н2С=СН2
+ 3O2 → 2СO2 + 2Н2O
Окисление перманганатом калия:
3H2C=CH2 + 2KMnO4 + 4H2O →→ 3CH2—CH2 + 2MnO2 + KOH
| |
OH OH
Частичное окисление :
350°C, Ag
2Н2С=СН2 + O2 → 2Н2С — СН2
\ /
О
24
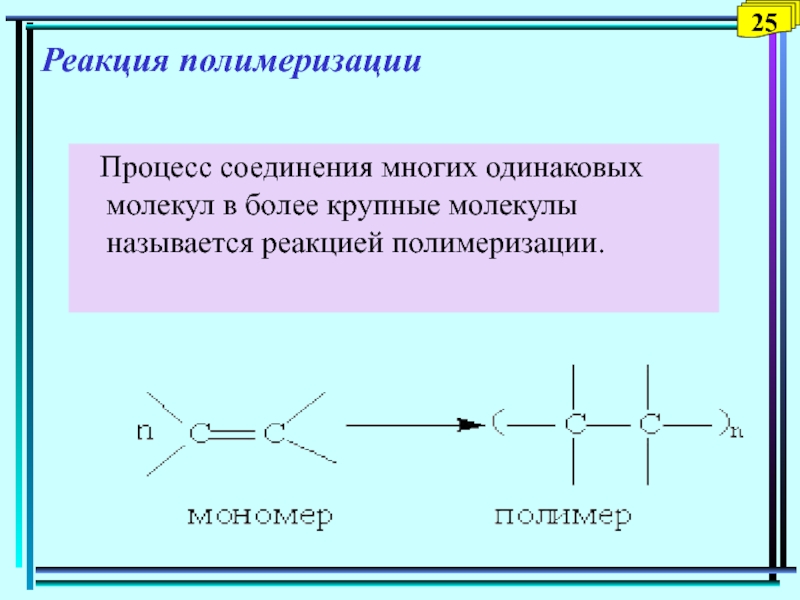
Слайд 26Реакция полимеризации
Процесс соединения многих одинаковых молекул в более
крупные молекулы называется реакцией полимеризации.
25
Слайд 28Алкины. Ацетилен
Алкины – углеводороды, содержащие кроме σ-связей две π-связи (тройную
связь) у одной пары углеродных атомов. Первый представитель этого класса
веществ – ацетилен HC≡CH, в связи с чем алкины также называют ацетиленовыми углеводородами. Общая формула гомологического ряда алкинов Сn Н2n−2 (изомерны алкадиенам).4.1. Номенклатура и изомерия алкинов
Названия ацетиленовых углеводородов образуются от названий соответствующих предельных углеводородов заменой окончания –ан на –ин.
Для алкинов характерны изомерия углеродного скелета и изомерия положения тройной связи:
CH≡C−CH2−CH2−CH3 CH≡C−CH−CH3 3-метилбутин-1
Пентин-1 |
CH3−C≡C−CH2−CH3 CH3
и пентин-2
2
27
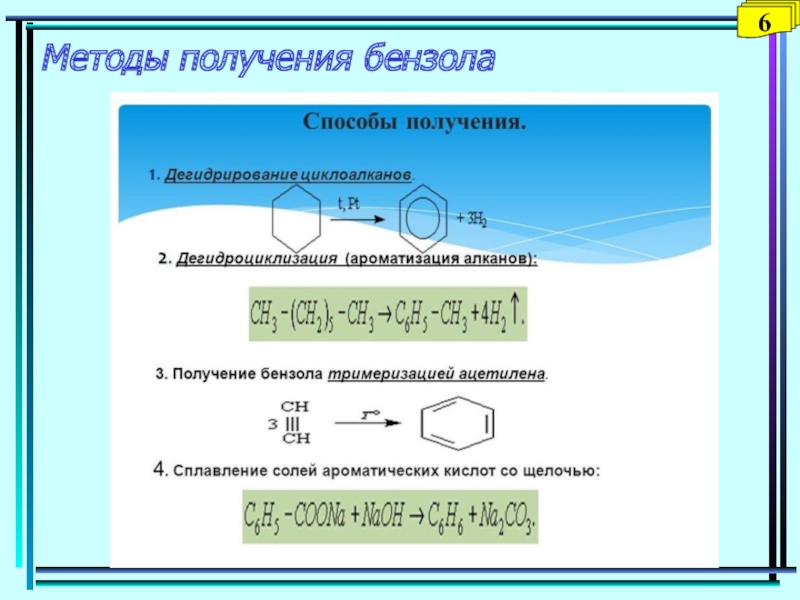
Слайд 29Методы получения алкинов
Общий способ получения алкинов – отщепление двух молекул
галогеноводорода от дигалогеналканов, которые содержат два атома галогена либо у
соседних (а), либо у одного атома углерода (б), под действием спиртового раствора щелочи:спирт
а) R−CH(Hal)−CH2(Hal) + 2 KOH → R−C≡C−H + 2 KHal + 2 H2O
спирт
б) R−CH2−C(Hal)2−CH3 + 2 KOH → R−C≡C−CH3 + 2 KHal + 2H2O
Ацетилен получают высокотемпературным крекингом метана
1500º
2 СН4 → Н−С≡С−Н + 3 Н2,
а также гидролизом карбида кальция, образующегося при высоких температурах из оксида кальция и углерода:
СаО + 3 С → СаС2 + СО ; СаС2 + 2 Н2О → Н−С≡С−Н + Са(ОН)2
28
Слайд 30Химические свойства ацетилена
1.Реакция
галогенирования
CH≡CH + 2Br 2 →
CHBr2−CHBr21,1,2,2-тетрабромэтан
Алкины, так же как и алкены, обесцвечивают бромную воду.
2. Реакция гидрогалогенирования
Эти реакции, как правило, проводят в присутствии катализаторов. Для несимметричных алкинов на каждой стадии присоединение идет по правилу Марковникова:
AlBr3
CH3−C≡CH + HBr → CH3−CBr=CH2
2-бромпропен
CH3−CBr=CH2 + HBr → CH3−CBr2−CH3
2,2-дибромпропан
29
Слайд 31Химические свойства ацетилена (прод.)
3. Реакция гидратации (реакция Кучерова)
Вода присоединяется к
алкинам с образованием неустойчивых продуктов − енолов, которые быстро изомеризуются
в карбонильные соединения. Реакция протекает в присутствии сульфата ртути HgSO4 :Hg2+
R−C ≡C−R1 + H2O → [ R−C = CH−R1 ] → R− C=O
| | OH СН2 − R1
неустойчивая
«енольная форма «кето-форма»
Реакция гидратации ацетилена по Кучерову имеет промышленное значение, в результате образуется уксусный альдегид:
CH ≡CH + H2O → [ CH2=CH] → CH3−C=O
| | OH H
30
Слайд 32Химические свойства ацетилена (прод.)
4. Реакция замещения
Атом водорода, находящийся у
углерода в sp-гибридном состоянии, достаточно подвижен и способен замещаться на
атомы металлов. Поэтому алкины, в отличие от алкенов, способны образовывать соли – ацетилениды:СН≡СН + NaNH2 → СН≡ СNa + NH3
ацетиленид натрия
HC≡CH + 2 [Ag(NH3)2]OH → Ag−C≡C−Ag↓ + 2 NH3 + 2 H2O
ацетиленид дисеребра
Ацетилениды тяжелых металлов Ag, Cu, Hg представляют собой не истинные соли, а ковалентно построенные соединения, нерастворимые в воде, взрывоопасные в сухом виде.
5. Реакция гидрирования (→этан)
6. Реакция тримеризации (→бензол)
7. Реакция окисления (горения)
31
Слайд 34План
1. Понятие ароматичности. Правило Хюккеля.
2. Номенклатура и изомерия производных
бензола.
3. Методы получения бензола.
4. Химические свойства бензола.
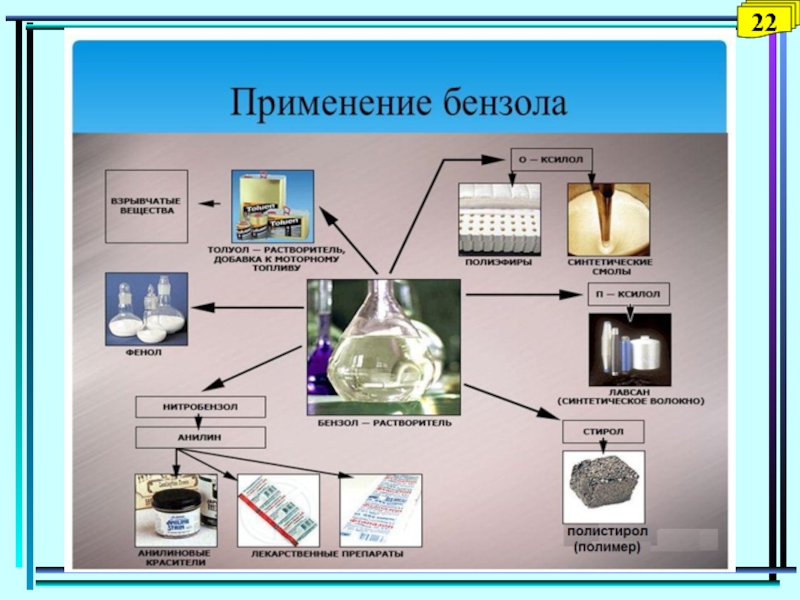
5. Применение бензола.
2
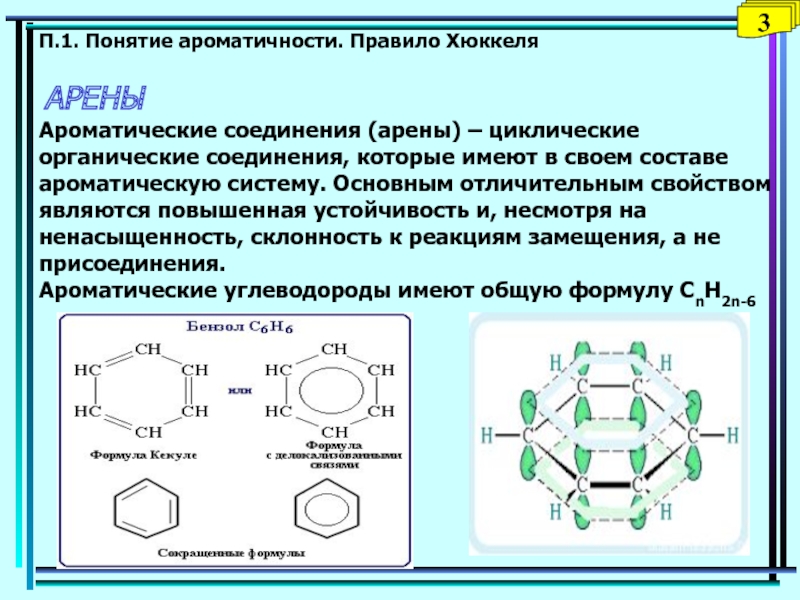
Слайд 35П.1. Понятие ароматичности. Правило Хюккеля АРЕНЫ Ароматические соединения (арены) – циклические
органические соединения, которые имеют в своем составе ароматическую систему. Основным
отличительным свойством являются повышенная устойчивость и, несмотря на ненасыщенность, склонность к реакциям замещения, а не присоединения. Ароматические углеводороды имеют общую формулу СnH2n-63
Слайд 37Правило Хюккеля
Для образования устойчивой ароматической системы необходимо, чтобы p-электроны формально
группировались в 3, 5, 7 и т. д. двойных связей;
математически это выражается правилом Хюккеля: повышенной термодинамической стабильностью обладают циклические соединения, имеющие плоское строение и содержащие в замкнутой системе сопряжения (4n + 2) электронов, где n – натуральный ряд чисел.Примеры: нафталин, антрацен (написать на доске)
5