Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Уральский государственный аграрный университет д.х.н., проф. Хонина Татьяна
Содержание
- 1. Уральский государственный аграрный университет д.х.н., проф. Хонина Татьяна
- 2. План лекции Введение. Предмет науки химия. Основные
- 3. п1. Введение. Предмет науки химия. Основные
- 4. 4п.2. Строение вещества. Строение атома. Качественная и
- 5. Особенности микромираКвантование энергии: энергия микрообъекта изменяется не
- 6. 6п. 3. Строение электронных оболочек атомов. Квантовые
- 7. Главное квантовое число n.Энергетические уровни7
- 8. Орбитальное квантовое число l. Энергетические подуровни. Формы
- 9. Формы электронных орбиталей9
- 10. Магнитное квантовое число (ml) ml =
- 11. Формы электронных орбиталей11
- 12. Спиновое квантовое число s12ms характеризует собственный механический момент движения электрона (обусловленный вращением вокруг собственной оси)
- 13. Клечковский Всеволод Маврикиевич (1900 -1972) Россия, 1961Правило
- 14. Вольфганг Эрнст Паули (1900 – 1958)Австрия, 1940
- 15. Фридрих Хунд(1896 – 1997)Германия\Правило Хунда:При данном значении
- 16. 16Электронная формула (конфигурация) атома –
- 17. 17п.5. Периодический закон Д.И. Менделеева.
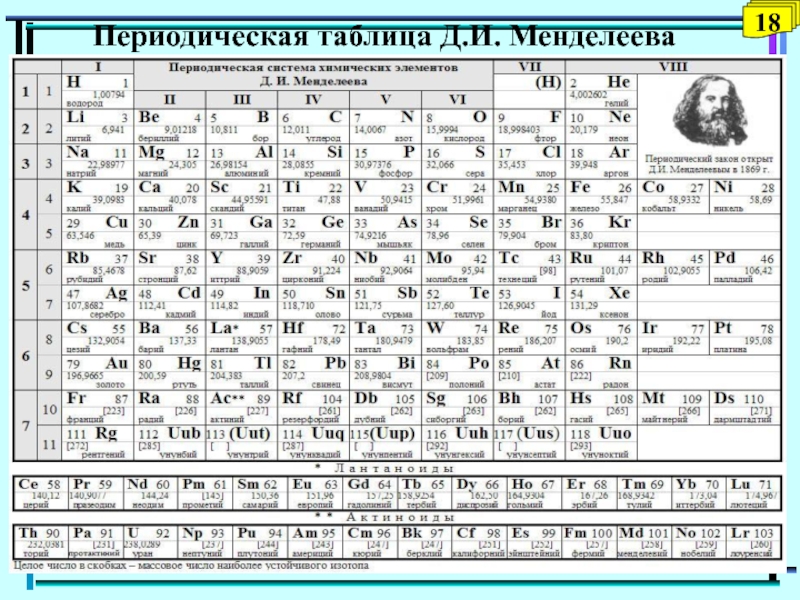
- 18. Периодическая таблица Д.И. Менделеева18
- 19. Периодический закон"Свойства простых тел, а также формы
- 20. Периодический закон сегодня:"Свойства химических элементов, а также
- 21. Периодическая система химических элементовПериодическая система химических
- 22. 22
- 23. ПериодичностьПериодичность – это повторяемость химических и физических
- 24. ПериодичностьВертикальная периодичностьзаключается в повторяемости свойств химических элементов
- 25. 25Cвойства атомов: энергия ионизации энергия
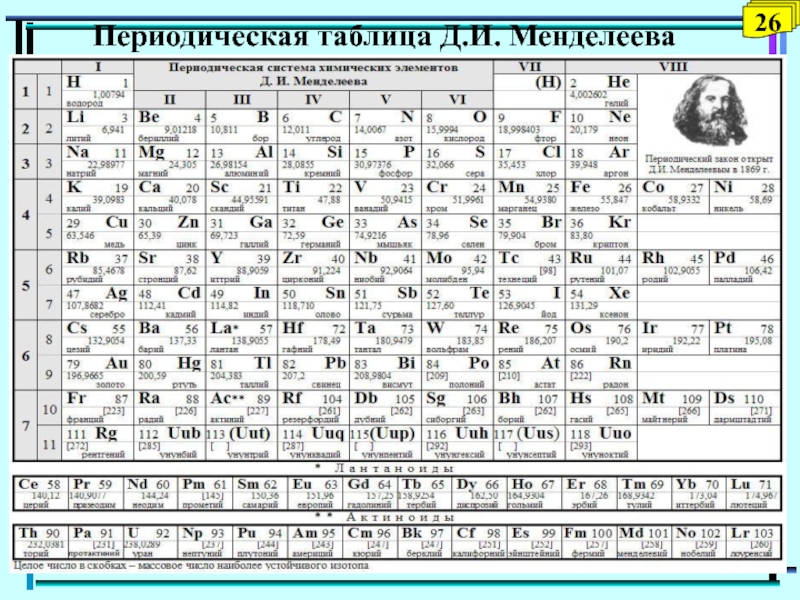
- 26. Периодическая таблица Д.И. Менделеева26
- 27. Энергия ионизации Энергия (потенциал) ионизации атома Ei -
- 28. Сродство к электронуСродство атома к электрону Ee
- 29. Электроотрицательность(абсолютная электроотрицательность)Относительная электроотрицательность: Li = 1
- 30. Изменение свойств атомов слева направо (в малых
- 31. П.6. Электронные s-,p-,d- и f- семейства устанавливают
- 32. Литература Кафедра химии УрГАУ/ ВКонтактеVk.com/club86527277 Тел кафедры: 221-41-03 1.
- 33. 33Вопросы к экзамену по общей и неорганической
- 34. 34Вопросы к экзамену (продолжение)9. Основные законы химии:
- 35. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Уральский государственный
аграрный университет
д.х.н., проф. Хонина Татьяна Григорьевна
Введение в общеобразовательную
научную дисциплину ХИМИЯ
Слайд 2План лекции
Введение. Предмет науки химия. Основные разделы и понятия.
Материя, вещество. Физические и химические свойства вещества.
Строение вещества. Строение атома.
Качественная и количественная характеристика состава атомов. 3. Строение электронных оболочек атомов. Квантовые числа. Энергетические уровни и подуровни, атомные электронные орбитали.
4. Правила составления электронных формул и схем строения электронных оболочек атомов (принцип минимальной энергии, правила Клечковского, Хунда, принцип Паули).
5. Периодический закон Д.И. Менделеева. Сущность периодического закона. Строение периодической системы.
6. Семейства s-, p-, d- и f- элементов.
2
Слайд 3 п1. Введение. Предмет науки химия. Основные разделы и понятия.
Материя, вещество. Физические и химические свойства вещества Химия –
наука, изучающая состав, строение и свойства вещества Основные понятия химии Материя, вещество Простые с сложные вещества Физические и химические свойства вещества Разделы химии Молекула – наименьшая частица простого или сложного вещества, сохраняющая его химические свойства Атом – наименьшая частица простого вещества, сохраняющая его химические свойства3
Слайд 44
п.2. Строение вещества. Строение атома. Качественная и
количественная характеристика состава атомов
Квантово- механическая модель атома
Атом – сложная
система взаимодействующих элементарных частиц, состоящая из ядра и электронной оболочкиЯдро атома –сложное образование, состоящее из положительно заряженных элементарных частиц – протонов и нейтральных (незаряженных) – нейтронов
Совокупность атомов с одинаковым зарядом ядра называется химическим элементом (118)
Изотопы – атомы химических элементов, имеющие одинаковый заряд ядра (число протонов), но различное число нейтронов.
Слайд 5Особенности микромира
Квантование энергии: энергия микрообъекта изменяется не непрерывно, а дискретно,
порциями (квантами)
Корпускулярно-волновой дуализм микрообъекта – сочетание свойств частицы и волны
Вероятностный
подход к описанию процессов микромира5
Слайд 66
п. 3. Строение электронных оболочек атомов. Квантовые числа. Энергетические
уровни и подуровни, атомные электронные орбитали
Квантовые числа
Главное квантовое число
(n) – характеризует уровень энергии электрона (энергетический уровень Eур.) и средние размеры электронной оболочки. Чем меньше значение n, тем меньше энергия уровня и средний размер электронной оболочки. Орбитальное квантовое число (l) – характеризует подуровень энергии электрона (энергетический подуровень Eподур.) и форму электронного облака. Чем меньше значение l, тем меньше энергия подуровня. Форма электронных облаков различна: s, p, d и f – электроны.
Магнитное квантовое число (ml ) – характеризует ориентацию электронного облака (s, p, d и f) в атомном пространстве .
Спиновое квантовое число (ms ) характеризует собственный механический момент движения электрона
Слайд 8Орбитальное квантовое число l. Энергетические подуровни. Формы электронных орбиталей l =
0, 1, 2, 3…… (n-1) Значения l Обозначения атомных
электронных орбиталей (и электронов) 0 s 1 p 2 d 3 f l характеризует энергию электрона данного подуровня и форму атомной электронной орбитали8
Слайд 10Магнитное квантовое число (ml) ml = -l…… -1, 0, +1……+l Значения l
Значения ml
10
ml характеризует ориентацию электронной орбитали в атомном пространстве; число орбиталей равно количеству значений ml для каждого энергетического подуровня.
Слайд 12Спиновое квантовое число
s
12
ms характеризует собственный механический момент движения
электрона (обусловленный вращением вокруг собственной оси)
Слайд 13
Клечковский
Всеволод Маврикиевич
(1900 -1972)
Россия, 1961
Правило Клечковского:
Электрон занимает в
основном состоянии
уровень не с минимально возможным значением n, а
с наименьшим значением суммы (n + l ). Энергетические подуровни с одинаковыми значениями (n + l) заполняются по мере увеличения значения n:1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p
(n+l): 1 2 3 3 4 4 5 5 5 6 6 6 7 7 7 7 8 8 8
l=0 (s) l=1 (p) l=2 (d) l=3 (f)
13
п.4. Правила составления электронных формул и схем строения электронных оболочек атомов (принцип минимальной энергии, правила Клечковского, Хунда, принцип Паули).
Слайд 14
Вольфганг Эрнст Паули
(1900 – 1958)
Австрия, 1940
Лауреат нобелевской премии
(1945)
Принцип Паули:
В атоме не может быть двух
электронов, у которых все четыре квантовых числа были бы одинаковы. Электроны должны различаться значениями хотя бы одного квантового числа.14
Слайд 15
Фридрих Хунд
(1896 – 1997)
Германия
\
Правило Хунда:
При данном значении l (т. е.
в пределах определенного энергетического подуровня) электроны располагаются таким образом, чтобы
их суммарный спин был максимальным.15
Слайд 16
16
Электронная формула (конфигурация) атома – это условная запись,
в которой все электроны атома распределены по энергетическим уровням и
подуровням1H: 1s1 2He: 1s2
10Ne: 1s22s22p6 18Ar: 1s22s22p6 3s23p6
22Ti 1s22s22p6 3s23p6 4s23d2
118 Og: 1s2 2s22p6 3s23p6 4s23d104p6 5s24d10 5p6
6s24f14 5d106p6
7s25f146d10 7p6
118 Og: [Rn]
7s25f146d10 7p6
Слайд 17
17
п.5. Периодический закон Д.И. Менделеева. Сущность периодического закона.
Строение периодическая системы.
Распределение электронов согласно пр.
Количество элементов Клечковского в 7 горизонтальных в периоде:
рядах(периодах):
1s2 , 2 (HHe)
2s2 , 2p6, 8 (LiNe)
3s2 , 3p6 , 8 (NaAr)
4s2 , 3d10, 4p6 , 18 (KKr)
5s2 , 4d10 , 5p6 , 18 (RbXe)
6s2 , 4f14 , 5d10 , 6p6 , 32 (CsRn)
7s2 , 5f14 , 6d10 , 7p6 32 (FrOg)
Максимальное число электронов на энергетическом уровне 2n2
(фактически распределение по уровням: 2, 8, 18, 32, 32, 18, 8 ).
(
Слайд 19Периодический закон
"Свойства простых тел, а также формы и свойства соединений
элементов находятся в периодической зависимости (или, выражаясь алгебраически, образуют периодическую
функцию) от величины атомных весов элементов».МЕНДЕЛЕЕВ Дмитрий Иванович (8.02.1834 - 2.02.1907)
19
Слайд 20Периодический закон сегодня:
"Свойства химических элементов, а также образуемых ими простых
и сложных веществ находятся в периодической зависимости от заряда ядра".
Заряд ядра атома определяет число электронов.
Электроны заселяют атомные орбитали таким образом, что строение внешней электронной оболочки периодически повторяется.
Это выражается в периодическом изменении химических свойств элементов и их соединений.
20
Слайд 21 Периодическая система химических элементов
Периодическая система химических элементов - естественная
классификация химических элементов, являющаяся табличным выражением периодического закона Д.И. Менделеева.
Прообразом Периодической системы химических элементов послужила таблица, составленная Д.И. Менделеевым 1 марта 1869 г.
В 1870 г. Менделеев назвал систему естественной, а в 1871 г. - периодической.
Формы периодической таблицы: короткопериодная, длиннопериодная
21
Слайд 23Периодичность
Периодичность – это повторяемость химических и физических свойств элементов и
их соединений по определенному направлению периодической системы при изменении порядкового
номера элементов.Виды периодичности: вертикальная, горизонтальная.
23
Слайд 24Периодичность
Вертикальная периодичность
заключается в повторяемости свойств химических элементов в вертикальных столбцах
Периодической системы и обусловливает объединение элементов в группы. Элементы одной
группы имеет однотипные электронные конфигурации.Горизонтальная периодичность заключается в появлении максимальных и минимальных значений свойств простых веществ и соединений в пределах каждого периода.
24
Слайд 25
25
Cвойства атомов:
энергия ионизации
энергия сродства к электрону
электроотрицательность
атомный и ионный радиус
металлические свойства
неметаллические свойства
Характер и причины изменения свойств
атомов: металлических и неметаллических свойств, радиусов, энергии ионизации, энергии сродства к электрону, электроотрицательности атомов - в периодах и группах периодической системы определяются строением электронных оболочек атомовСлайд 27Энергия ионизации
Энергия (потенциал) ионизации атома Ei - минимальная энергия, необходимая
для удаления электрона из атома:
Х = Х+ + е−;
Ei Значения Ei (кДж/моль):
H 1312,1
K 418,7 F 1680,8 He 2372
Rb 403,0 Cl 1255,5 Ne 2080
Cs 375,7 Br 1142,6 Ar 1520
Ei уменьшается сверху вниз (главные подгруппы);
Ei в периодах (малые) –увеличивается слева направо.
27
Слайд 28Сродство к электрону
Сродство атома к электрону Ee – способность атомов
присоединять добавочный электрон и превращаться в отрицательный ион.
Мерой сродства
к электрону служит энергия, выделяющая при присоединении электрона к нейтральному атому, при этом: Х + е− = Х− ; Ee
Значения Ee (кДж/моль)
Ee возрастает слева направо (в малых периодах);
уменьшается сверху вниз (в главных подгруппах)
Пример: F −345,7; Cl: −366,7.
28
Слайд 29Электроотрицательность
(абсолютная электроотрицательность)
Относительная электроотрицательность:
Li = 1
F = 4
Лайнус-Карл ПОЛИНГ
(28.02.1901 – 19.08.1994)
Одна из
самых распространенных – шкала электроотрицательности Оллреда – Рохова 29
Слайд 30Изменение свойств атомов слева направо (в малых периодах):
заряд ядер атомов увеличивается; число
электронных слоев (энергетических уровней) не изменяется; число электронов на внешнем электроном слое увеличивается от 1 до 8; радиус атомов уменьшается; прочность связи электронов внешнего слоя с ядром увеличивается; энергия ионизации увеличивается; сродство к электрону увеличивается; электроотрицательность увеличивается; металлические свойства уменьшаются; неметалличность возрастает. Изменение свойств атомов сверху вниз (в главных подгруппах): число электронных слоев атомов увеличивается; число электронов на внешнем слое атомов одинаково; радиус атомов увеличивается; прочность связи электронов внешнего слоя с ядром уменьшается; энергия ионизации уменьшается; сродство к электрону уменьшается; электроотрицательностьуменьшается; металлические свойства увеличиваются; неметалличность уменьшается.30
Слайд 31П.6. Электронные s-,p-,d- и f- семейства устанавливают связь между положением элемента
в периодической системе и электронным строением его атома; от того,
какой энергетический подуровень заполняется последним, различают 4 электронных семейства: s-, p-, d- и f. S-Элементы – семейство химических элементов, у которых при заполнении электронных подуровней последний электрон заполняет s-подуровень внешнего энергетического уровня. Это главные подгруппы I и II групп. ns1,2; (n=1-7). 14 s-элементов. Р-Элементы – семейство химических элементов, у которых при заполнении электронных подуровней последний электрон заполняет р-подуровень внешнего энергетического уровня. Это элементы главных подгрупп III – VIII групп. ns2nр1-6 . (n=2-7). 36 р-элементов. d-Элементы – заполняется d-подуровень предвнешнего уровня. Это элементы побочных подгрупп; входят в 4-7 периоды. ns2(n-1)d1-10 ; (n=4-7). 40 d-элементов. f- Элементы – заполняется f-подуровень предпредвнешнего уровня (3-ий снаружи). Это элементы 6 и 7 периодов, соответственно, лантаноиды: № 58 (церий) - №71(лютеций) и актиноиды: №90 (торий) - №103 (лоуренсий). ns2(n-2)f1-14; (n=6,7). 28 f- элементов31
Слайд 32Литература
Кафедра химии УрГАУ/ ВКонтакте
Vk.com/club86527277
Тел кафедры: 221-41-03
1. О.С. Габриелян и
др. Химия. Учебное пособие/.
М.: Академия, 2012.
2. И.К. Циткович. Курс
аналитической химии. – Изд. “Лань”, 2007.
3. И.И. Грандберг. Н.Л. Нам. Органическая химия.-
Дрова, 2009.
Дополнительная:
Г.П. Хомченко, И.К. Циткович. Неорганическая
химия. – М.. Высшая школа, 2009.
Методические указания для самостоятельной работы
32
Слайд 3333
Вопросы к экзамену
по общей и неорганической химии
1. Понятия: материя,
вещество. Предмет науки химия
2. Качественная и количественная характеристика состава атомов
3.
Строение электронных оболочек атомов. Квантовые числа. Энергетические уровни и подуровни, атомные электронные орбитали.4. Правила составления электронных формул и схем строения электронных оболочек атомов (принцип минимальной энергии, правила Клечковского, Хунда, принцип Паули)
5. Сущность периодического закона. Причина периодической повторяемости химических свойств и количественных характеристик атомов с увеличение зарядов их ядер
6. Строение периодической системы химических элементов Д.И.Менделеева. Характер и причины изменения металлических и неметаллических свойств, радиусов, энергии ионизации, энергии сродства к электрону, электроотрицательности атомов в периодах и группах периодической системы
7. Основные типы химической связи (ковалентная, ионная, металлическая), механизм их образования и свойства
8. Классы сложных неорганических соединений. Состав, номенклатура, химические свойства и реакции оксидов, кислот, оснований и солей
Слайд 3434
Вопросы к экзамену (продолжение)
9. Основные законы химии: закон сохранения массы
вещества, закон постоянства состава вещества, закон Авогадро и два следствия
из него. Применение этих законов для вычисления состава, массы и объема веществ10. Основы термохимии. Тепловой эффект химической реакции, изменение энтальпии химической реакции. Закон Гесса. Пример расчета изменения энтальпии реакции
11. Понятия скорости гомогенной и гетерогенной реакций. Зависимость скорости химической реакции от концентрации реагирующих веществ, давления, температуры. Закон действия масс, правило Вант-Гоффа.
12. Сущность химического равновесия и условие его наступления. Константа химического равновесия. Определение направления смещение химического равновесия в соответствии с принципом Ле Шателье.
13. Понятие раствор. Типы растворов. Способы выражения состава (концентрации) растворов
14. Теория электролитической диссоциации. Степень и константа диссоциации. Сильные и слабые электролиты
15. Диссоциация воды, ионное произведение воды. Водородный показатель. Шкала рН растворов
16. Реакции ионного обмена, условия их протекания. Порядок составления ионных уравнений
17. Гидролиз солей
18. Сущность окислительно-восстановительных реакций и условие их протекания. Степени окисления атомов и порядок их определения. Составление уравнений окислительно-восстановительных реакции на основе метода электронного баланса
19. Комплексные соединения металлов, их состав и поведение (устойчивость) в растворах. Константа нестойкости комплексных ионов.
20. Химия s,p,d- и f-элементов таблицы Менделеева
21. Химия биогенных элементов. Понятие о микроэлементах.