Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Урок 8м класса
Содержание
- 1. Урок 8м класса
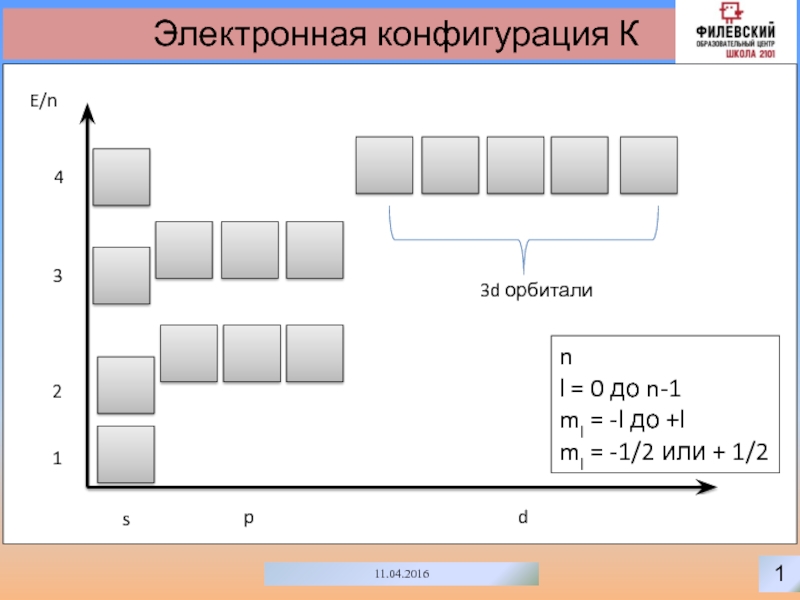
- 2. 111.04.2016Электронная конфигурация КspdE/n1233d орбитали4nl = 0 до
- 3. 211.04.2016Классификация химических элементовИтак, все атомы отличаются по
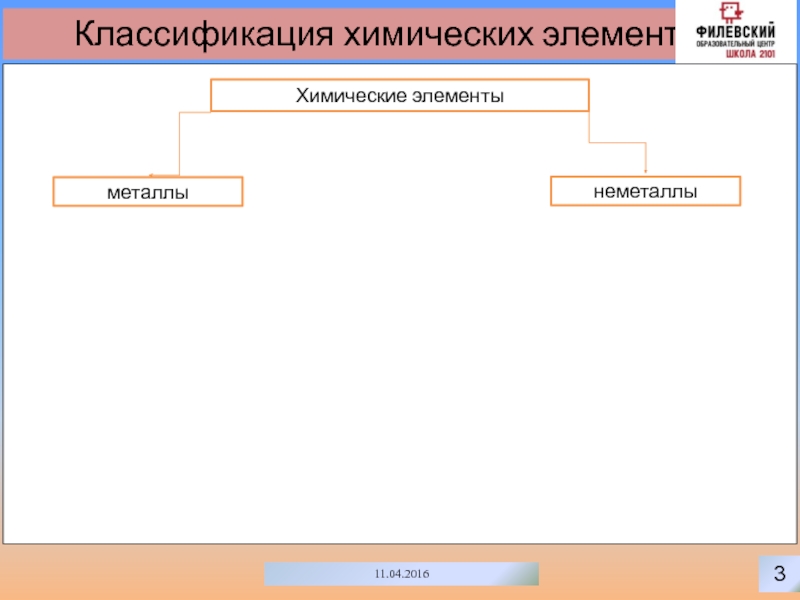
- 4. 311.04.2016Классификация химических элементовХимические элементынеметаллыметаллы
- 5. 311.04.2016Классификация химических элементовХимические элементынеметаллыметаллыКислород О2, азот N2,
- 6. 311.04.2016Классификация химических элементовХимические элементынеметаллыметаллыКислород О2, азот N2,
- 7. 411.04.2016Амфотерные соединенияХимические элементынеметаллыметаллыSO3 + H2O = H2SO4MgO
- 8. 511.04.2016Амфотерные соединенияХимические элементынеметаллыметаллыамфотерныеОксиды и гидроксиды, которые способны
- 9. 611.04.2016Амфотерные соединения
- 10. 711.04.2016Комплексные соединенияКомплексные соединения – сложные вещества, в
- 11. 811.04.2016ПредысторияДо начала XIX века было открыто 33
- 12. 911.04.2016ПредысторияНемецкий химик Иоганн Вольфганг ДёберейнерДёберейнеру удалось установить
- 13. 1011.04.2016ПредысторияФранцузский геолог и химик Александр Эмиль Бегуйе
- 14. 1111.04.2016Периодический закон Д.И. МенделееваLi + H2O =
- 15. 1211.04.2016Периодический закон Д.И. МенделееваВозрастание относительных атомных массОслабление
- 16. 1311.04.2016Периодический закон Д.И. МенделееваДмитрий Иванович заметил, что
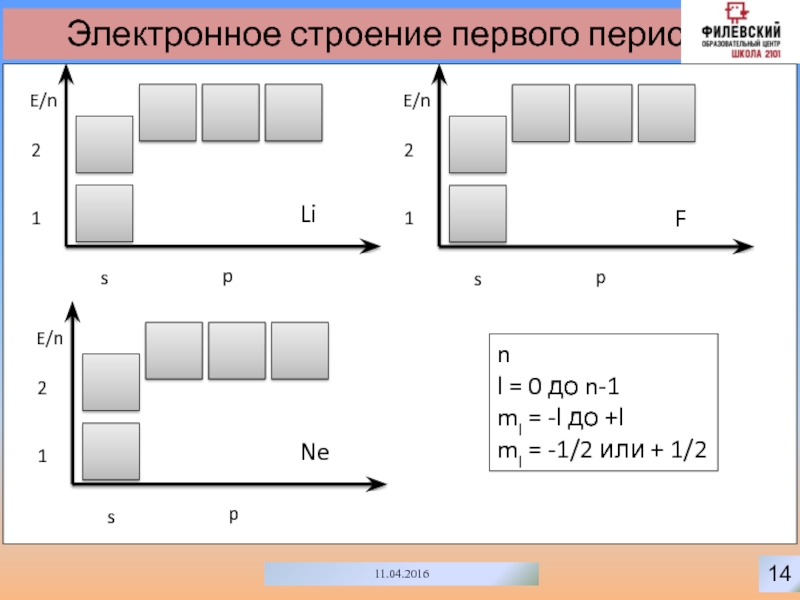
- 17. 1411.04.2016Электронное строение первого периодаspE/n12nl = 0 до
- 18. 1511.04.2016Периодический закон Д.И. МенделееваСвойства химических элементов и
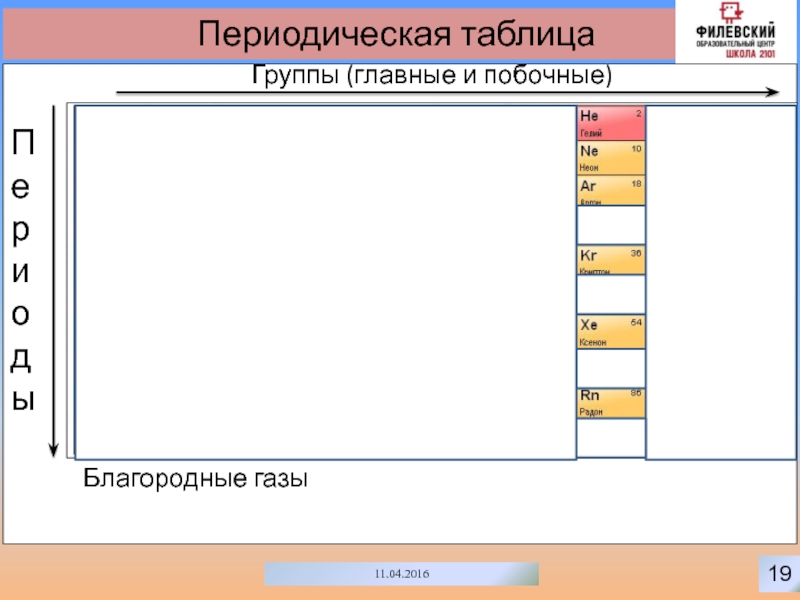
- 19. 1611.04.2016Периодическая таблицаГруппы (главные и побочные)Периоды
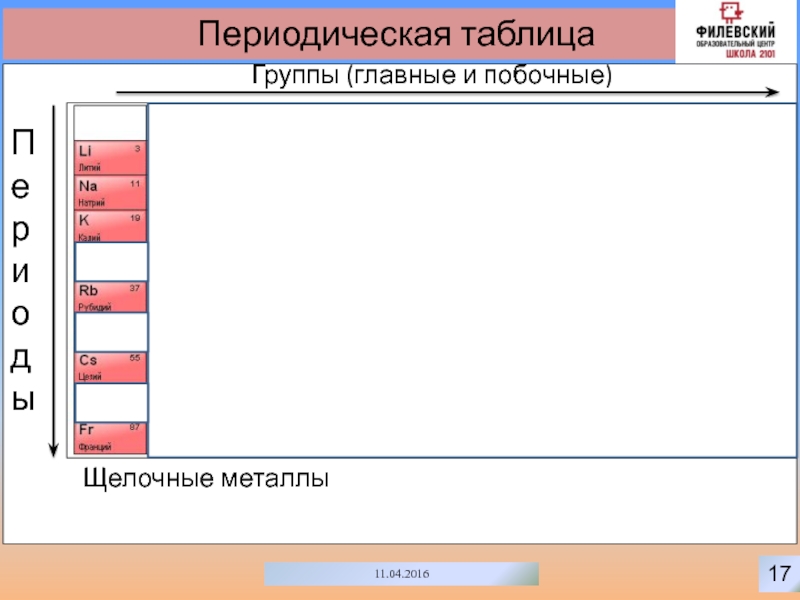
- 20. 1711.04.2016Периодическая таблицаГруппы (главные и побочные)ПериодыЩелочные металлы
- 21. 1811.04.2016Периодическая таблицаГруппы (главные и побочные)ПериодыЩелочно-земельные металлы
- 22. 1911.04.2016Периодическая таблицаГруппы (главные и побочные)ПериодыБлагородные газы
- 23. 2011.04.2016Периодическая таблицаГруппы (главные и побочные)ПериодыПериодическая таблица –
- 24. Скачать презентанцию
Слайды и текст этой презентации
Слайд 32
11.04.2016
Классификация химических элементов
Итак, все атомы отличаются по набору квантовых чисел.
Но как это отражается на элементах?
Какие они бывают?
Слайд 53
11.04.2016
Классификация химических элементов
Химические элементы
неметаллы
металлы
Кислород О2, азот N2, уголь С и
т.д.
Твёрдые, жидкие, газообразные
Металлическим блеском не обладают
Изоляторы
Хрупкие
Золото Au, серебро Ag,
свинец Pb и др. Твёрдые вещества
Имеют металлический блеск
Хорошие проводники
Ковкие
Слайд 63
11.04.2016
Классификация химических элементов
Химические элементы
неметаллы
металлы
Кислород О2, азот N2, уголь С и
т.д.
Твёрдые, жидкие, газообразные
Металлическим блеском не обладают
Изоляторы
Хрупкие
Золото Au, серебро Ag,
свинец Pb и др. Твёрдые вещества
Имеют металлический блеск
Хорошие проводники
Ковкие
?
Слайд 74
11.04.2016
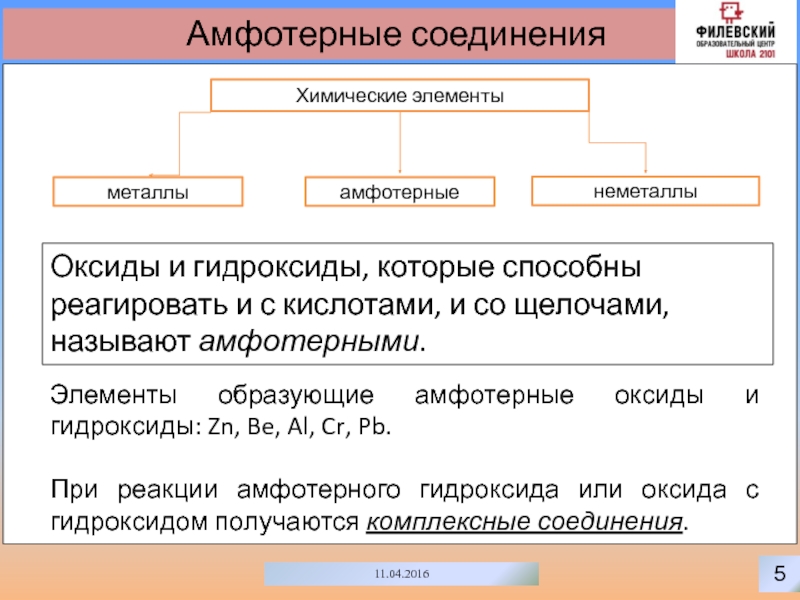
Амфотерные соединения
Химические элементы
неметаллы
металлы
SO3 + H2O = H2SO4
MgO + H2O =
Mg(OH)2
Но:
AlCl3 + 3KOH = Al(OH)3 + 3KCl
ZnCl2 + 2NaOH = Zn(OH)2 + 2NaCl Al(OH)3 + 3HCl = AlCl3 + 3H2O Zn(OH)2 + 2HCl = ZnCl2 + 2H2O
Al(OH)3 + NaOH = 2Na[Al(OH)4] Zn(OH)2 + 2NaOH = Na2[Zn(OH)4]
Слайд 85
11.04.2016
Амфотерные соединения
Химические элементы
неметаллы
металлы
амфотерные
Оксиды и гидроксиды, которые способны реагировать и с
кислотами, и со щелочами, называют амфотерными.
Элементы образующие амфотерные оксиды и
гидроксиды: Zn, Be, Al, Cr, Pb.При реакции амфотерного гидроксида или оксида с гидроксидом получаются комплексные соединения.
Слайд 107
11.04.2016
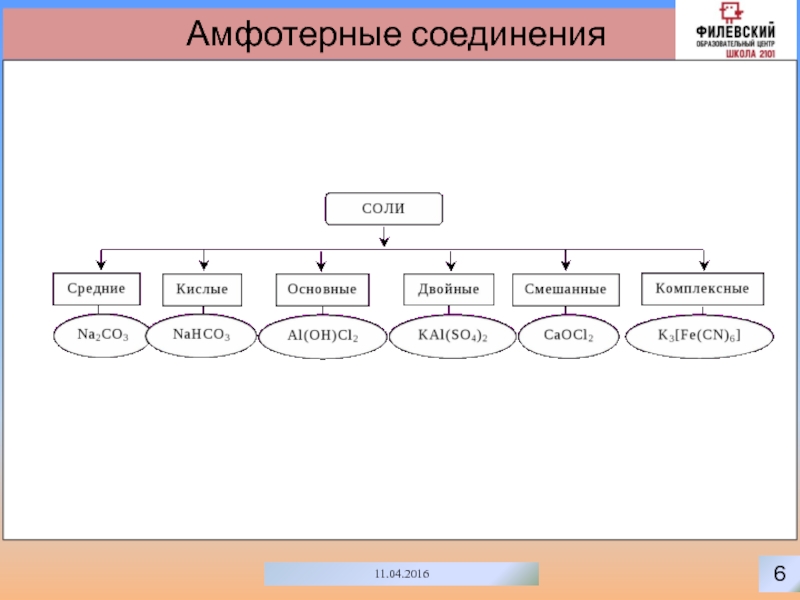
Комплексные соединения
Комплексные соединения – сложные вещества, в которых можно выделить
центральный атом (комплексообразователь) и связанные с ним молекулы и ионы
– лиганды. Центральный атом и лиганды образуют комплекс (внутреннюю сферу), который при записи формулы комплексного соединения заключают в квадратные скобки. Число лигандов во внутренней сфере называют координационным числом. Молекулы и ионы, окружающие комплекс, образуют внешнюю сферу.K3[Fe(CN)6]
Слайд 118
11.04.2016
Предыстория
До начала XIX века было открыто 33 элемента.
К примеру:
C, Pb, Au, Ag, Fe, Sb, Hg, S, Sn, As,
Zr, Bi, P, Co, Pt, Ni, N, Sr, O, H.В период с 1801 по 1869 были открыты ещё 28 элемента!
К примеру: Nb, Ta, La, Ce, Rh, Pd, Os, Ir, Na, K, Mg, Ca, B, I, Li, Se, Cd, Al, Si, и даже Ru.
Химики собирали информацию о химических и физических свойствах каждого элемента, но классифицировать её не удавалось очень долго…
Слайд 129
11.04.2016
Предыстория
Немецкий химик
Иоганн Вольфганг Дёберейнер
Дёберейнеру удалось установить первые закономерности в
изменении свойств элементов. Он заметил, что если расположить три сходных
по химическим свойствам элемента в порядке возрастания их атомных весов, то атомный вес второго (среднего) элемента будет равен среднему арифметическому атомных весов первого и третьего. В 1817 Дёберейнер установил такую закономерность для первой «триады» — щёлочно-земельных металлов: кальция, стронция и бария.Слайд 1310
11.04.2016
Предыстория
Французский геолог и химик Александр Эмиль Бегуйе де Шанкуртуа
Шанкуртуа известен
тем, что в 1862 предложил систематизацию химических элементов, основанную на закономерном изменении атомных масс —
т. н. «земную спираль». Шанкуртуа нанёс на боковую поверхность цилиндра, размеченную на 16 частей, линию под углом 45°, на которой поместил точки, соответствующие атомным массам элементов. Таким образом, элементы, атомные веса которых отличались на 16, или на число, кратное 16, располагались на одной вертикальной линии. При этом точки, отвечающие сходным по свойствам элементам, часто оказываются на одной вертикальной линии.Слайд 1411
11.04.2016
Периодический закон Д.И. Менделеева
Li + H2O = Li(OH)
Be+ NaOH+H2O = Na2[Be(OH)4]
Mg3B2
+ 6HCl = B2H6 + 3MgCl2; B2O3 + 3H2O =
2H3BO3Бороводород, соли бораны; борная кислота
H2O + CO2 = H2CO4
2NO2+H2O=HNO3+HNO2
2F2 + 2H2O = 4HF + O2
[Cl 2 + H2O = HCl + HClO (холод)]
Слайд 1512
11.04.2016
Периодический закон Д.И. Менделеева
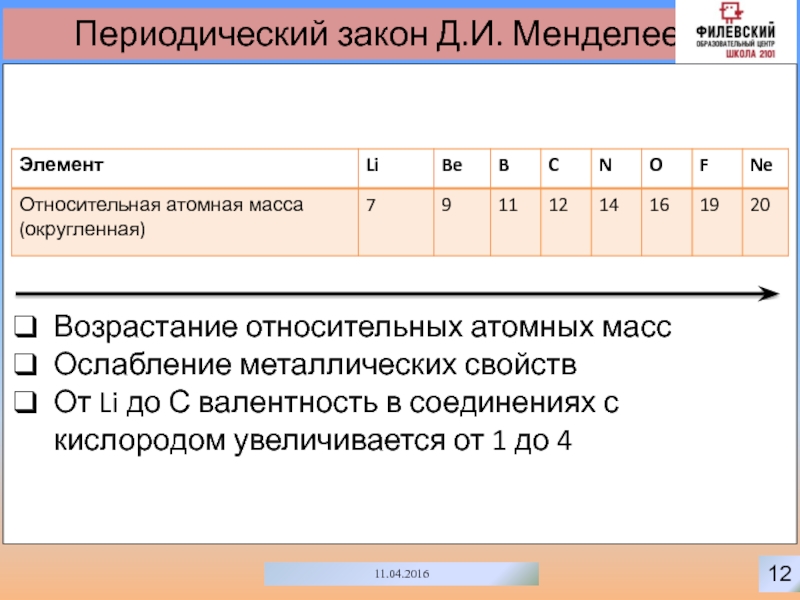
Возрастание относительных атомных масс
Ослабление металлических свойств
От Li
до С валентность в соединениях с кислородом увеличивается от 1
до 4Слайд 1613
11.04.2016
Периодический закон Д.И. Менделеева
Дмитрий Иванович заметил, что наблюдается повторяемость свойств
элементов предыдущего ряда и последующего: Na подобен Li, Mg –
Be, Al – B и т. д.Давайте сравним относительные атомные массы Ar, K, Co, Ni.
Ar – 39.948
K – 39.0983
Co – 58.933
Ni – 58.69








![Урок 8м класса 1111.04.2016Периодический закон Д.И. МенделееваLi + H2O = Li(OH)Be+ NaOH+H2O = Na2[Be(OH)4]Mg3B2 + 1111.04.2016Периодический закон Д.И. МенделееваLi + H2O = Li(OH)Be+ NaOH+H2O = Na2[Be(OH)4]Mg3B2 + 6HCl = B2H6 + 3MgCl2; B2O3](/img/thumbs/ea9e946ed689b0c3c3078fd40e9262ed-800x.jpg)