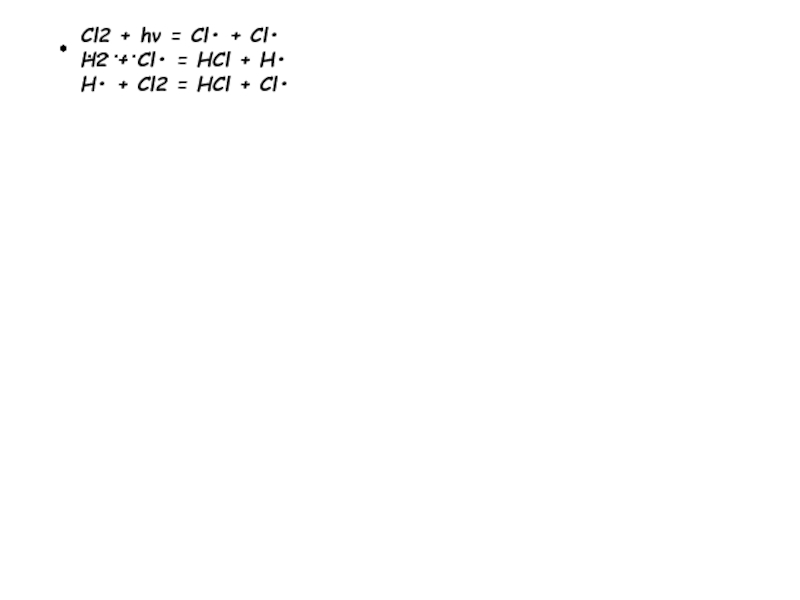Слайд 1В 1923 г. И. Бренстед и Т. Лоури предложили общую
протолитическую теорию кислот и оснований.
Кислота - молекула или ион,
способные отдавать катион водорода (протон). Кислота - донор протонов.
СН3СООH H+ + СН3СОО–
слабая сопряж. к-та сопряж. основание
Основание — молекула или ион, способные присоединять катион водорода (протон). Основание - акцептор протонов.
ОН- + Н+ = Н2О NH3 +Н+= = NH4+
отдавая протон, кислота превращается в основание, которое называют сопряженным этой кислоте
А мфолиты — молекулы или ионы, способные как отдавать, так и присоединять протон, а следовательно, вступать в реакции, характерные как для кислот, так и для оснований.
Н2О + НС1 = Н3О+ + СГ
основание кислота
Н2О + NH3 = NH4+ + ОН-
кислота основание
Амфолитами являются
=====гидроксиды некоторых металлов (Zn, Al, Pb, Sn, Cr):
====гидроанионы многоосновных кислот, например НСОз-, НРО4 2-.
====соединения, молекулы которых содержат две различные кислотно-основные группы, H2N—CHR—СООН
основание кислота
Слайд 2ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ И ИОННОЕ ПРОИЗВЕДЕНИЕ ВОДЫ
Н2О Н+ +
ОН–
Константа диссоциации воды при 25С равна:
В 1 литре воды содержится
1000/18=55,6 молей
[Н+] [ОН–] = = К [Н2О] = 1,8 10–16 55,6 = 10–14 моль/л = KW,
где KW — ионное произведение воды.
Если концентрации [Н+] и [ОН–] равны, что соответствует нейтральному раствору, то [Н+] = [ОН–] = 10–7 моль/л.
Слайд 3
Водородным показателем называют величину, численно равную отрицательному десятичному логарифму
активности [или концентрации] водородных ионов и выраженную в грамм-ионах на
литр или в молях на литр.
lg KW = lg[Н+] + lg[ОН–] = lg 10–14
Беря логарифмы с обратным знаком, получим:
рН + рОН = 14
Следовательно, рН и рОН являются сопряжёнными величинами: если рН = 3, то рОН = 14 – 3 = 11.
рН крови = 7,3-7,4
рН желудочного сока = 0,9-1,5 [взр.],
=======новорожденных — 7,0;
========у детей 4-7 лет — 2,5;
======== у детей 14 лет — 2,0
рН слюны = 7,3-7,9
Слайд 4Методы определения рН растворов.
Для определения рН растворов используют
---- индикаторный
- применяется в том случае, когда необходимо быстро и приблизительно
оценить рН исследуемого раствора.
нельзя определить рН мутных и окрашенных растворов. Ионометрический метод позволяет определить этот показатель с. большей точностью (0,01 ед. рН).
можно определить рН мутных, окрашенных и любых других водных растворов
Слайд 5Индикаторы — это органические соединения, слабые кислоты или основания, анионы
которых имеют одну окраску, а недиссоциированные молекулы — другую.
HInd
H+ + Ind–
При [HInd] = [Ind–]
[Н+] = Кинд, тогда рК = рКинд.
рКинд является точкой перехода индикатора, она равна тому значению рН, при котором индикатор диссоциирован наполовину: [HInd] = [Ind–].
Зоной перехода индикатора называется область между двумя значениями рН, в которой происходит заметное изменение окраски индикатора.
Чем меньше зона перехода индикатора, тем чувствительнее индикатор.
Универсальный индикатор — это смесь индикаторов со смежными зонами перехода.
Слайд 6Для количественной характеристики кислотных свойств растворов пользуются величинами
общей,
активной
и потенциальной кислотности,
[Н+]общ, [Н+]акт, [Н+]пот в моль/л.
Общая кислотность
- это концентрация всех катионов Н+ (свободных и связанных), имеющихся в растворе равна сумме молярных концентраций эквивалентов всех кислот (сильных и слабых), находящихся в растворе:
[Н+]общ = сумме C I (1/z к-ты)
Активная кислотность — это концентрация свободных катионов Н+, pН = -lg [H+] = -lg [Н+]акт
Потенциальная кислотность - это концентрация катионов Н+, связанных в молекулы или ионы слабых кислот, имеющихся в растворе.
[Н+]пот = [Н+]общ - [Н+]акт
[Н+]пот = сумме Ci(1/z слабой к-ты)
Слайд 7Активную кислотность можно определить четырьмя способами:
1. Кондуктометрический.
2. Титриметрический - с
индикатором диметиламидоазобензолом ограничен, т.к. применим только к растворам сильных кислот,
где концентрация ионов водорода достаточно высока, например, в желудочном соке.
3. Потенциометрический — наиболее современный, точный и универсальный метод определения активной кислотности
4. Колориметрический [colour — цветной].
== позволяют определить рН с точностью до 0,1.
==только для бесцветных, прозрачных, слабомутных и слабоокрашенных жидкостей,.
Слайд 8Все колориметрические методы определения концентрации водородных ионов основаны на законе
Ламберта-Бера, :
для двух растворов, одинаково поглощающих свет, произведение толщины
слоя раствора [d] на концентрацию раствора [С] при прочих равных условиях есть величина постоянная:
dC = d1C1
Из этого закона вытекает принцип, лежащий в основе всей колориметрии:
«Если при одинаковой толщине слоёв растворы одного и того же вещества имеют одинаковую окраску, то они имеют и одинаковую концентрацию».
Слайд 9
Буферными системами называются растворы, способные стойко сохранять постоянство концентрации
ионов водорода как при добавлении кислот или щелочей,
так и
при разведении.
Состав буферных систем.
а/ из слабой кислоты и её соли, образованной сильным основанием;
б/ из слабого основания и его соли, образованной сильной кислотой.
Буферная система а) типа содержит слабую кислоту и избыток сопряжённого основания:
СН3СООH H+ + СН3СОО–
слабая сопряж. к-та сопряж. основание
Буферная система б) типа слабое основание и избыток сопряжённой с ним кислоты:
NH3 + H+ NH4+
слабое сопряж. основание сопряж. кислота
Слайд 10рН буферных смесей.
Кислый буфер
СН3СООH
H+ + СН3СОО–
Прологарифмируем и получим уравнение Гендерсона-Гассельбальха:
рН = рКа
+ lg [акцептор протона]
[донор протона]
рН = рКа + lg [соль]
[кислота
Слайд 11Основной буфер -NH4ОН + NH4C1
рН = рКВ + lg [соль]
[основание
Слайд 12Общий механизм действия буферных растворов
НА Н+ + А–
а/ А–
+ Н+ НА [при добавлении сильной кислоты]
б/ НА + ОН–
Н2О + А– [при добавлении щелочи]
Рассмотрим этот механизм на примере ацетатного буфера.
а/ При добавлении HCl происходит взаимодействие с СН3СООNa:
СН3СООNa СН3СОО– + Na+
СН3СОО– + Na+ + H+ + Cl– Na+ + Cl– + СН3СООН
б/ При добавлении щелочи :
СН3СООН + Na+ + OH– СН3СОО– + Na+ + Н2О
Слайд 13При разбавлении буферных растворов
концентрации всех компонентов уменьшаются.
Но так
как они изменяются одинаково, то их отношение остается неизменным.
Величина
константы диссоциации слабого электролита также не изменяется при разведении.
Слайд 14 Буферной емкостью (В) называется число моль-эквивалентов сильной кислоты или
щелочи, которые нужно добавить к 1 литру буферного раствора, чтобы
изменить величину рН на единицу.
Слайд 15Какие факторы определяют буферную ёмкость?
1. Наибольшей буферной ёмкостью обладают концентрированные
буферные растворы,.
2. Из двух буферных растворов с одинаковой концентрацией буферная
ёмкость будет больше у того раствора, у которого соотношение компонентов равно единице или близко к единице
3. при разбавлении рН раствора не меняется, но его буферная ёмкость падает.
Слайд 16Кинетика сложных реакций.
Сложные реакции подразделяются на параллельные, последовательные, сопряжённые и цепные.
А.
Параллельные реакции — связанная система реакций, имеющих одни и те
же исходные реагенты, но различные продукты реакции. Скорость системы параллельных реакций равна сумме скоростей отдельных реакций:
v1 4KCl + 6O2
4KClO3 vобщ = v1 + v2
v2 3KClO4 + KCl
Б. Последовательные реакции — связанная система реакций, в которой продукты предыдущих стадий расходуются в последующих реакциях.
Скорость реакции= скорости самой медленной (лимитирующей) стадии.
2NO + O2 = N2O4
v1
1/ 2NO ↔ [NO]2
v2
2/ [NO]2 + O2 ↔ N2O4
Слайд 17В. Сопряжённые реакции —реакции, каждая из которых происходит только при
условии протекания другой реакции, причем обе реакции имеют общий промежуточный
продукт
1/ 6FeO + 2H2CrO4 = 3Fe2O3[катализатор!] + Cr2O3 + 2H2O
2/ 6HI + 2H2CrO4 = 3I2 + Cr2O3 + 5H2O
Г. Цепные реакции — связанная система сложных реакций, протекающих последовательно, параллельно и сопряжённо с участием свободных радикалов [горение, взрывы, фотохимические реакции].
Основные стадии реакции:
а/ зарождение цепи;
б/ разветвление цепи;
в/ продолжение цепи;
г/ обрыв цепи.
Слайд 18Цепные реакции можно подразделить на неразветвлённые и разветвлённые. неразветвлённая реакция:
Cl2
+ hν = Cl• + Cl•
H2 + Cl• = HCl
+ H•
H• + Cl2 = HCl + Cl•
К разветвленным реакциям - полимеризации, крекинг, сгорание топлива в двигателях, окисление и др., например, ядерные цепные реакции
Слайд 19фотохимические реакции — реакции, происходящие под действием лучей света [видимых,
инфракрасных, ультрафиолетовых].
Эффективность фотохимической реакции определяется так называемым квантовым выходом γ:
γ = число молекул продукта реакции
Фотохимические реакции бывают различных типов: а/ синтез вещества [фотосинтез] и б/ разложение веществ под действием света [фотолиз :
hν
2HCl → H2 + Cl2
Фотосинтез, происходящий в растениях — сложный окислительно-восстановительный процесс, сочетающий фотохимические реакции с ферментативными.
|
CO2 + 2H2O → [H—C—OH]n + O2
|
число поглощённых квантов
Слайд 20…….
Cl2 + hν = Cl• + Cl•
H2 + Cl• =
HCl + H•
H• + Cl2 = HCl + Cl•
Слайд 21Кислоты — жёсткие: H+, Li+, Na+, K+, Mn2+, Cr3+, Fe3+,
Co3+, Mg2+, Ca2+;
мягкие: Cu+, Ag+, Au+, Pt2+, Pt4+, Hg2+, Cd2+.
Основания
— жёсткие: H2O, OH–, NH3, RNH2, Cl–, PO43–, SO42–;
мягкие: SCN–, R1S–, R2S, H–, S2O3 2–, SH.
правило:
Устойчивые комплексы образуются между жёсткой кислотой и жёстким основанием или между мягкой кислотой и мягким основанием.
Слайд 22Комплексообразователи и лиганды нашего организма.
:
Ca 2+ < Mg 2+
Mn 2+ < Fe 2+ < Cd 2+ < Co
2+ < Zn 2+ < Ni 2+ < Cu2+
- [Na+ и К+] присутствуют в основном в свободном виде,.
- Са2+, Мg2+ существуют как в свободном виде, так и в виде комплексов.
- Ионы тяжёлых металлов — Fe2+,. — легче связываются с атомами азота и серы, например, в порфиринах.
Слайд 23. Общие понятия об активном центре металлоферментов.
ферменты представляют собой комплексные
соединения с металлами, ионы которых определяют активный центр фермента и
пространственную структуру [конформацию] фермента. Кроме того, в силу хелатного эффекта они придают прочность белкам.
В состав ферментов входят микроэлементы:
Mn — в состав 12 ферментов;
Fe — в состав 70 ферментов;
Cu — в состав 30 ферментов;
Zn — в состав более 100 ферментов;
Мо и Со — в состав нескольких ферментов.
Слайд 24Значение комплексов в медицине.
Биохимик Дж.Вуд писал:. Биохимия — это координационная
химия живых систем».
В медицине применяются:
1. Лекарственные препараты на основе комплексов
металлов в онкологии, психиатрии, при воспалительных заболеваниях.
2. Радиодиагностика — использование комплексов металлов, меченых радиоактивными изотопами для выяснения путей перемещения лекарств.
3. Радиотерапия — направление радиоактивного изотопа в поражённый участок с целью локального воздействия на него.
4. Хелатотерапия — при металлотоксикозах и металлоаллергических заболеваниях.


![В 1923 г. И. Бренстед и Т. Лоури предложили общую протолитическую теорию кислот Водородным показателем называют величину, численно равную отрицательному десятичному логарифму активности Водородным показателем называют величину, численно равную отрицательному десятичному логарифму активности [или концентрации] водородных ионов и выраженную](/img/thumbs/f894522a47c8000290c4141e164e680a-800x.jpg)


![В 1923 г. И. Бренстед и Т. Лоури предложили общую протолитическую теорию кислот Для количественной характеристики кислотных свойств растворов пользуются величинами общей, активной и Для количественной характеристики кислотных свойств растворов пользуются величинами общей, активной и потенциальной кислотности, [Н+]общ, [Н+]акт, [Н+]пот](/img/thumbs/748ba42ffd6e5b31025151a12e73e9f0-800x.jpg)




![В 1923 г. И. Бренстед и Т. Лоури предложили общую протолитическую теорию кислот Основной буфер -NH4ОН + NH4C1рН = рКВ + lg [соль] Основной буфер -NH4ОН + NH4C1рН = рКВ + lg [соль]](/img/thumbs/9f66ac18c3d34abe04cad4d3e6f01cf3-800x.jpg)







![В 1923 г. И. Бренстед и Т. Лоури предложили общую протолитическую теорию кислот фотохимические реакции — реакции, происходящие под действием лучей света [видимых, инфракрасных, фотохимические реакции — реакции, происходящие под действием лучей света [видимых, инфракрасных, ультрафиолетовых].Эффективность фотохимической реакции определяется так называемым](/img/thumbs/8daaf6eab80e710535211093acfa3047-800x.jpg)