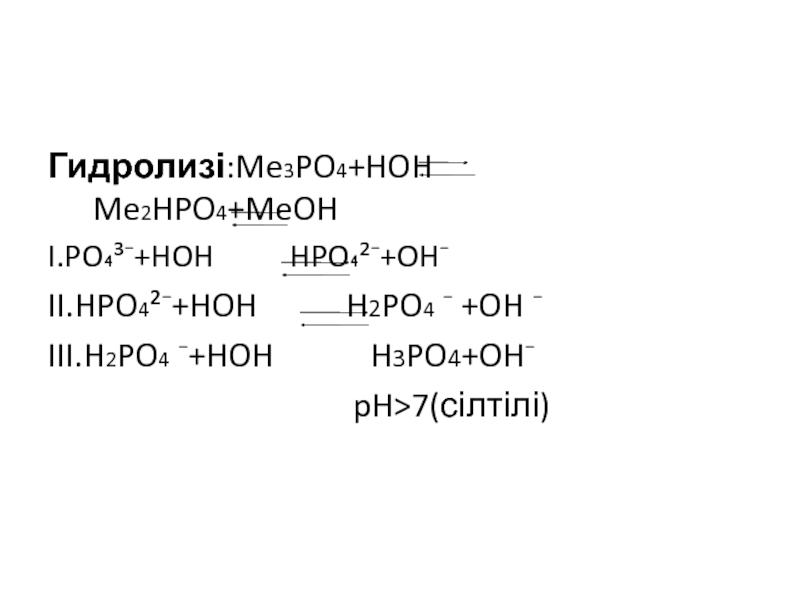
…3s² 3p³
Мышьяк As …4s² 4p³
Сурьма Sb …5s² 5p³
Висмут Bi …6s² 6p³
AR
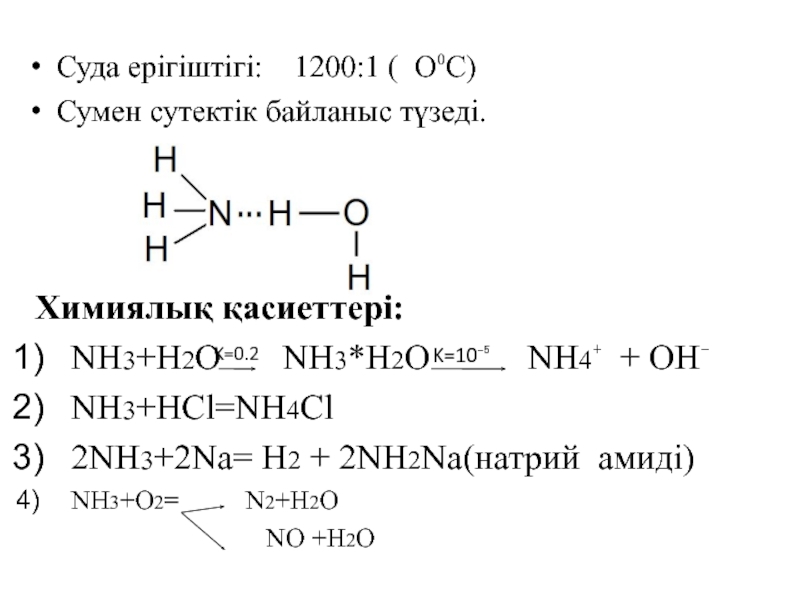
Сутектік қосылыстары
ns² np³
N P As Sb Bi
ө с е д і
К е м и д і
Иондану энергиясы
Бейметалдық қасиеттері кемиді металдық қасиеттері артады.
NH3 PH3 AsH3 SbH3
Т ұ р а қ т ы л ы ғ ы а з а я д ы
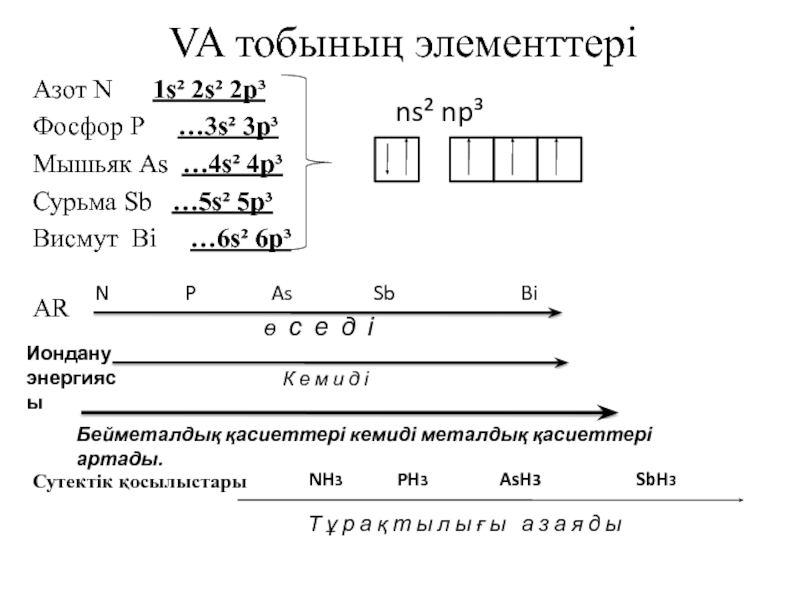
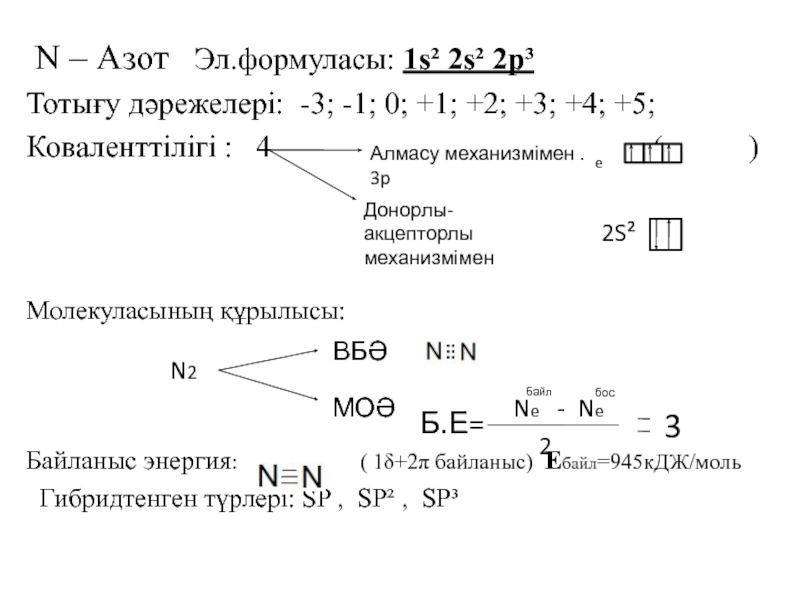

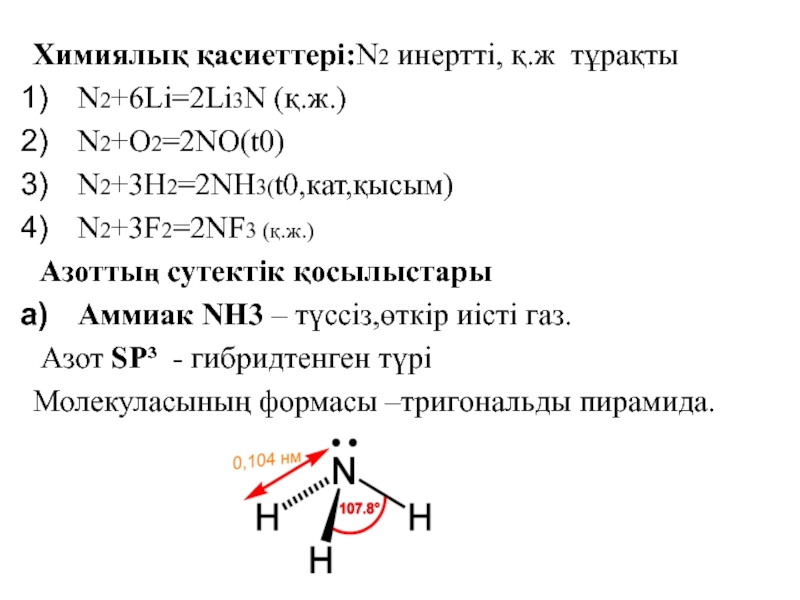




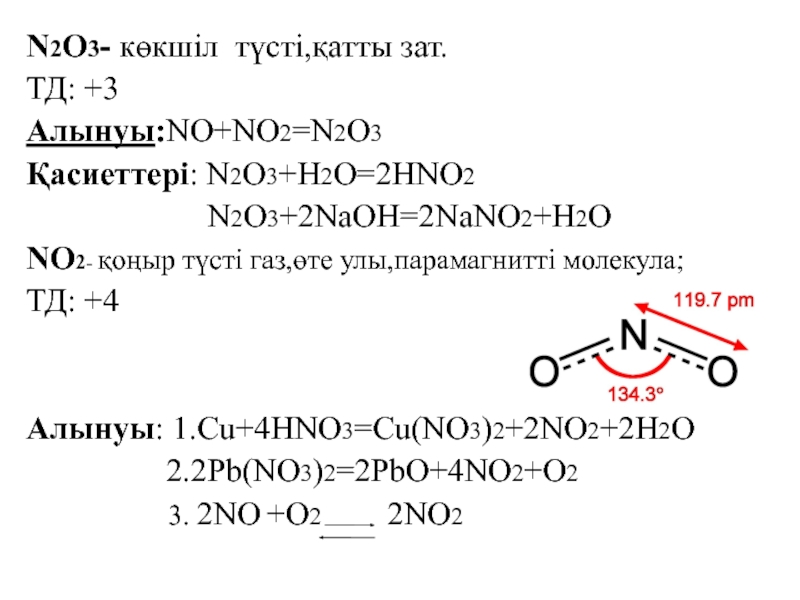
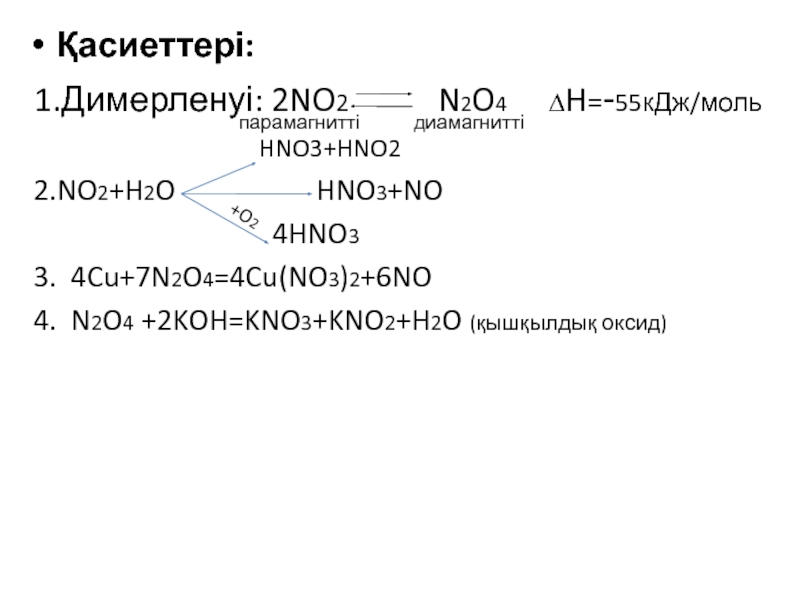
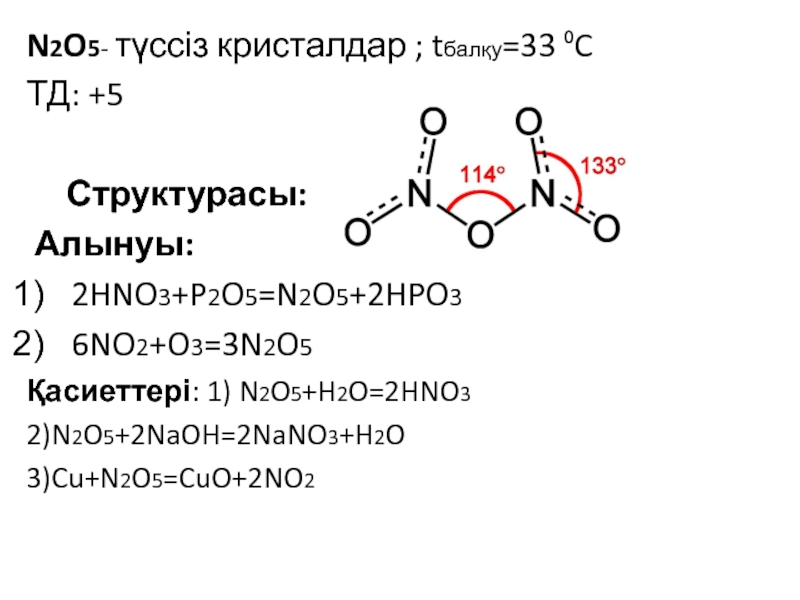
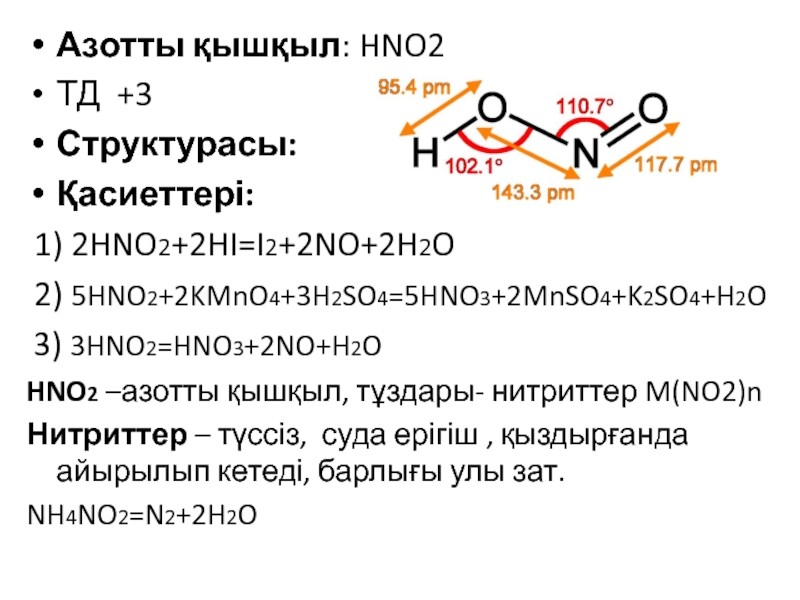
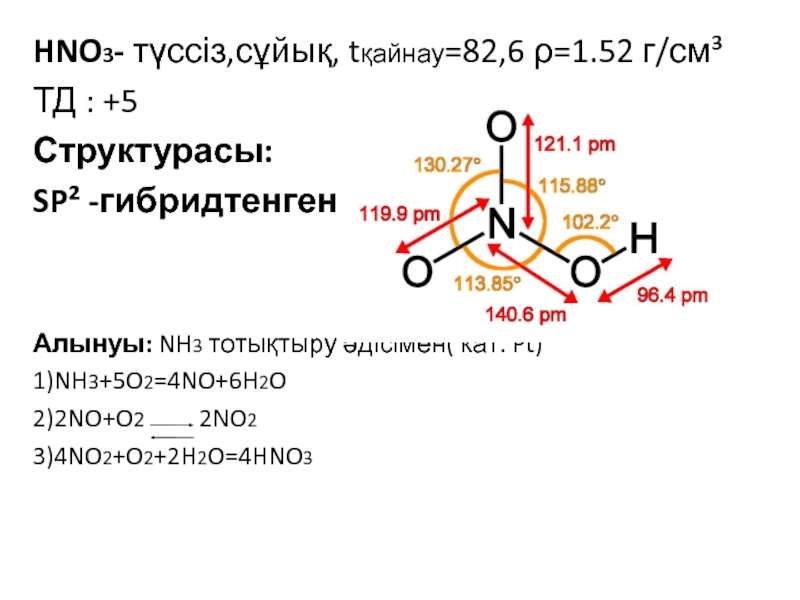

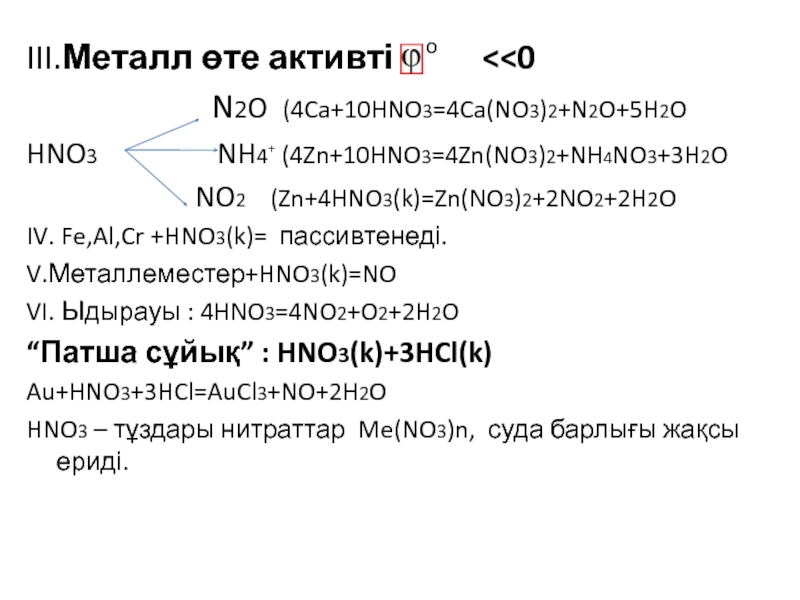
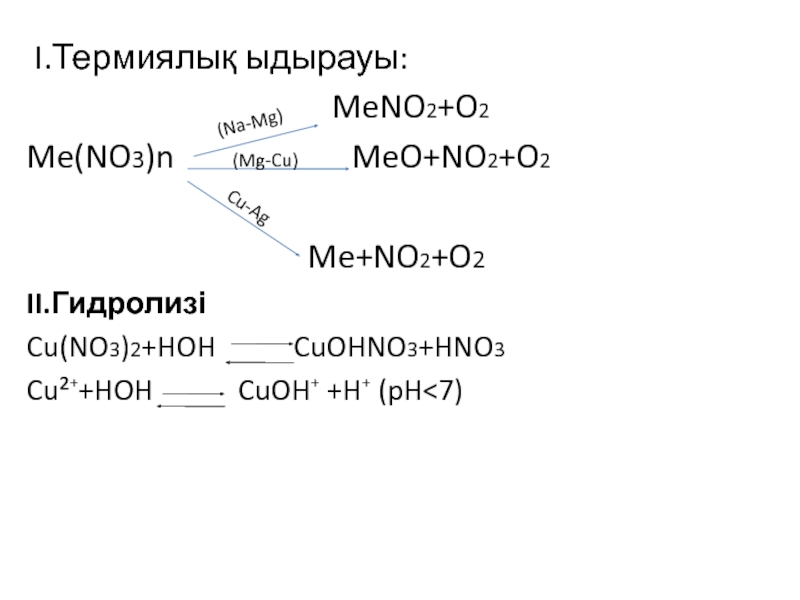


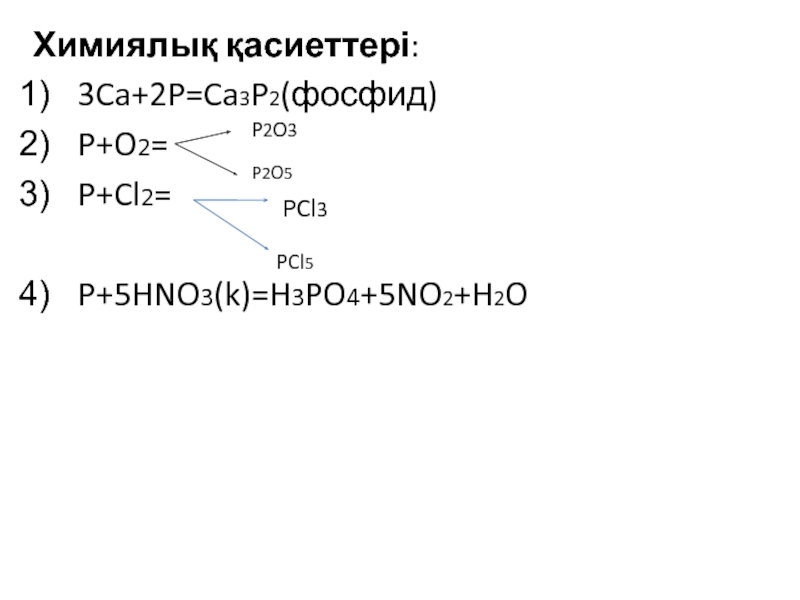

![VA тобыны ң элементтері Химиялық қасиеттері:Сумен: P2O3+3H2O=2H3PO3 H2[HPO3] P2O5+3H2O=2H3PO4(ортофосфор қышқылы) Химиялық қасиеттері:Сумен: P2O3+3H2O=2H3PO3 H2[HPO3] P2O5+3H2O=2H3PO4(ортофосфор қышқылы)](/img/tmb/3/215254/1bf0ea693b579548937a4ea88afd7b0b-800x.jpg)