Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Водные растворы в условиях промышленного производства и их стандартизация
Содержание
- 1. Водные растворы в условиях промышленного производства и их стандартизация
- 2. Классификация ЖЛФ по назначениюДля внутреннего применения (микстуры)Для
- 3. Дисперсологическая характеристика ЖЛФИстинные растворыРастворы ВМСКоллоидные растворыСуспензииЭмульсииКомбинированные системы (настои, отвары)
- 4. Растворы - это жидкие гомогенные системы, состоящие
- 5. Классификация растворов в зависимости от растворителей (примеры)
- 6. 1. Растворением твердых, жидких или газообразных лекарственных
- 7. Преимущества медицинских растворов1. Быстрее всасываются и оказывают
- 8. Недостатки медицинских растворов 1. Номенклатура ограничена, включает
- 9. Технологическая схема производства медицинских растворовВР.2.1. Измельчение
- 10. ТП.3.1. Растворение лекарственных веществТП.3.2. Доведение растворителем до
- 11. УМО.5.1. Розлив во
- 12. 1. Подготовительная стадия Проводят расчеты в
- 13. 2. РастворениеРастворение - это диффузионно-кинетический процесс, протекающий
- 14. Контактирование поверхности твердого тела с растворителем, сопровождающееся
- 15. Растворение осуществляется в реакторах, герметически закрытых аппаратах,
- 16. Способы перемешиванияМеханическое (мешалки)Пневматическое (барботирование)Гравитационное (разность плотности растворителя и раствора)УЗЦиркуляционное
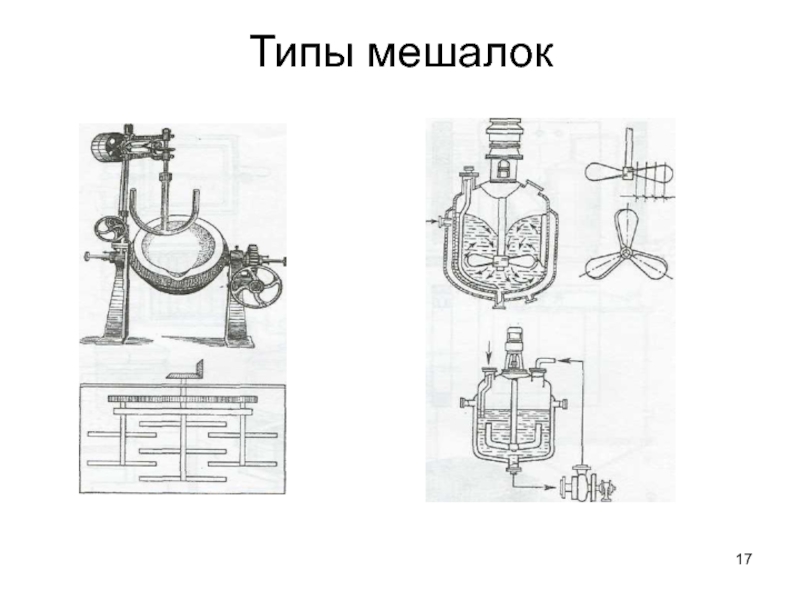
- 17. Типы мешалок
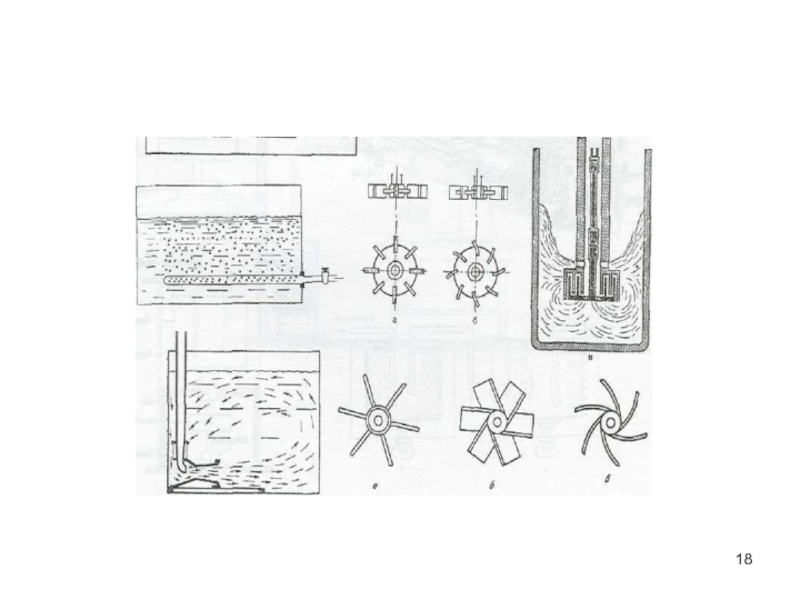
- 18. Слайд 18
- 19. 3. Очистка растворов. Разделение жидких гетерогенных системВыбор
- 20. Отстаивание - это разделение под действием сил
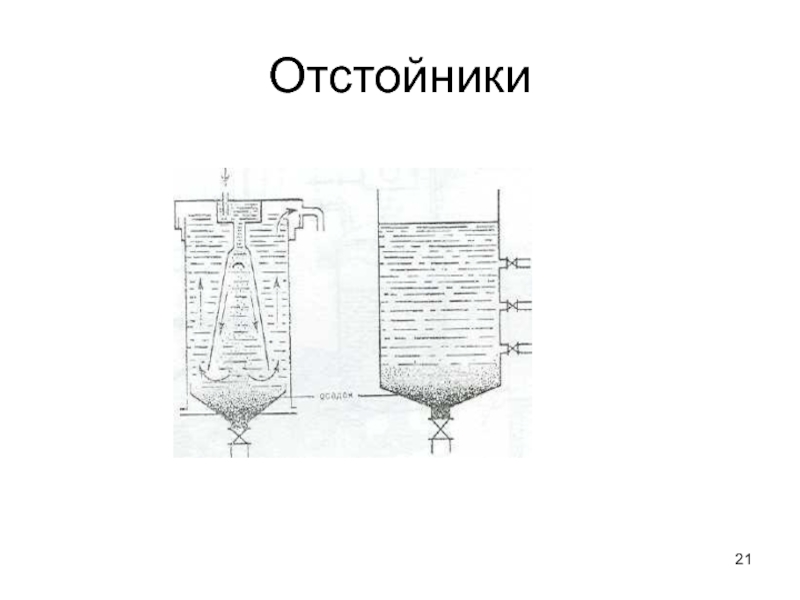
- 21. Отстойники
- 22. Фильтрование - это процесс разделения неоднородных систем
- 23. Виды фильтрованияГрубая фильтрация – частицы размером 50
- 24. Классификация фильтровальных перегородокПо материалам - хлопчатобумажные - шерстяные - синтетические - стеклянные - керамические - металлические - металлокерамические
- 25. 2. По структуре - гибкие - негибкие3. По физическим
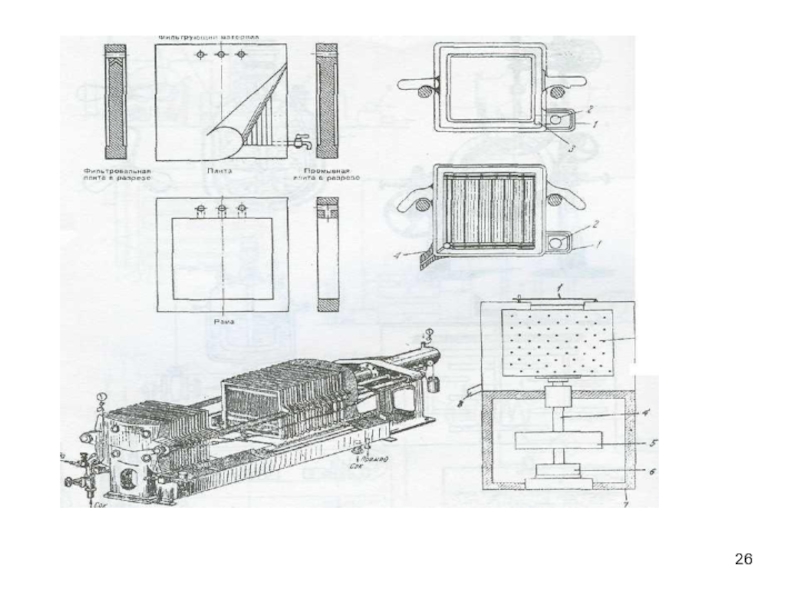
- 26. Слайд 26
- 27. Слайд 27
- 28. Центрифугирование - разделение фаз под действием центробежной силы. Используются центрифуги отстойные, фильтрующие, суперцентрифуги
- 29. Слайд 29
- 30. ОСТ 91500.05.001-00 Стандарты качества ЛС Растворы
- 31. 9. Посторонние примеси (родственные соединения)10. Размеры
- 32. Водные фармацевтические растворы Примеры
- 33. Жидкость Бурова представляет собой раствор моноосновной уксусно-алюминиевой
- 34. Сущность электрохимического способа получения жидкости Бурова заключается
- 35. В околоанодном пространстве происходит образование гидрата окиси
- 36. Установка для электролиза (получение жидкости Бурова электрохимическим методом)Рис. РИС.2 Установка для электролиза
- 37. Технологический процесс состоит из 3 стадийПодготовка электролита
- 38. Химический способ получения жидкости Бурова Квасцов алюмокалиевых……………………..46,5
- 39. Химический способ получения раствора основного ацетата алюминия1. Подготовка
- 40. Схема получения жидкости Бурова1 – бак, 2
- 41. Технологический процесс приготовления раствора состоит
- 42. К охлажденному прозрачному раствору квасцов при перемешивании
- 43. Растворение осадка в кислоте уксусной Промытый
- 44. Раствор основного ацетата свинца (Solutio Plutnbi subacetatis)Описание.
- 45. Химический способ получения свинцового уксуса (раствора свинца
- 46. Технологический процесс состоит из четырех стадийПолучение основной
- 47. Фильтрование. Жидкость фильтруют сквозь складчатый фильтр
- 48. Химический способ получения раствора свинца ацетата основного
- 49. В колбу с обратным холодильником помещают 10
- 50. Скачать презентанцию
Слайды и текст этой презентации
Слайд 2Классификация ЖЛФ по назначению
Для внутреннего применения (микстуры)
Для наружного применения (полоскания,
примочки, растирания, клизмы и т.д.)
Слайд 3Дисперсологическая характеристика ЖЛФ
Истинные растворы
Растворы ВМС
Коллоидные растворы
Суспензии
Эмульсии
Комбинированные системы (настои, отвары)
Слайд 4Растворы - это жидкие гомогенные системы, состоящие из растворителя и
одного или нескольких компонентов, распределенных в растворе в виде ионов
или молекул.Слайд 61. Растворением твердых, жидких или газообразных лекарственных веществ в растворителе
(растворы: этанола, кислот, щелочей, аммиака, глицерина, перекиси водорода, формальдегида, сахара,
эфирных масел в воде; лекарственных веществ в маслах, этаноле, воде, глицерине и т.д.)2. Перегонкой эфиромасличного сырья с водяным паром (ароматные воды: кориандровая, мятная, укропная, горькоминдальная)
3. Химическим способом (основной ацетат алюминия, основной ацетат свинца)
4. Электрохимическим способом (основной ацетат алюминия)
Классификация растворов по способу получения:
Слайд 7Преимущества медицинских растворов
1. Быстрее всасываются и оказывают резорбтивное действие по
сравнению с твердыми пероральными лекарственными формами.
2. Исключается раздражающее действие концентрированных
лекарственных веществ.3. С помощью растворов можно регулировать терапевтический эффект: путем изменения концентрации лекарственных веществ, изменения значения рН среды и вязкости, добавлением вспомогательных веществ.
4. Технологический процесс приготовления растворов достаточно простой.
Слайд 8Недостатки медицинских растворов
1. Номенклатура ограничена, включает препараты массового производства.
2.
Они не портативны, неустойчивы при хранение за счет гидролиза, окисления,
микробной контаминации.3. Срок годности ограничен.
4. Подвергаются микробной контаминации.
5. Для фасовки требуют флаконы из химически стойкого стекла (НС-1; НС-2) или другого индифферентного материала.
6. Большой объем упаковки.
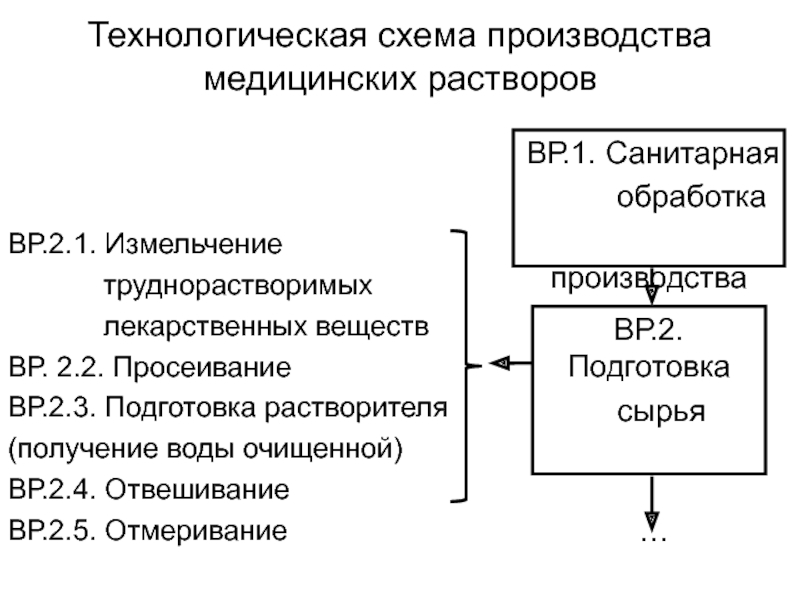
Слайд 9Технологическая схема производства медицинских растворов
ВР.2.1. Измельчение
труднорастворимых
лекарственных веществ
ВР.
2.2. Просеивание ВР.2.3. Подготовка растворителя
(получение воды очищенной)
ВР.2.4. Отвешивание
ВР.2.5. Отмеривание
ВР.1. Санитарная
обработка
производства
ВР.2. Подготовка
сырья
…
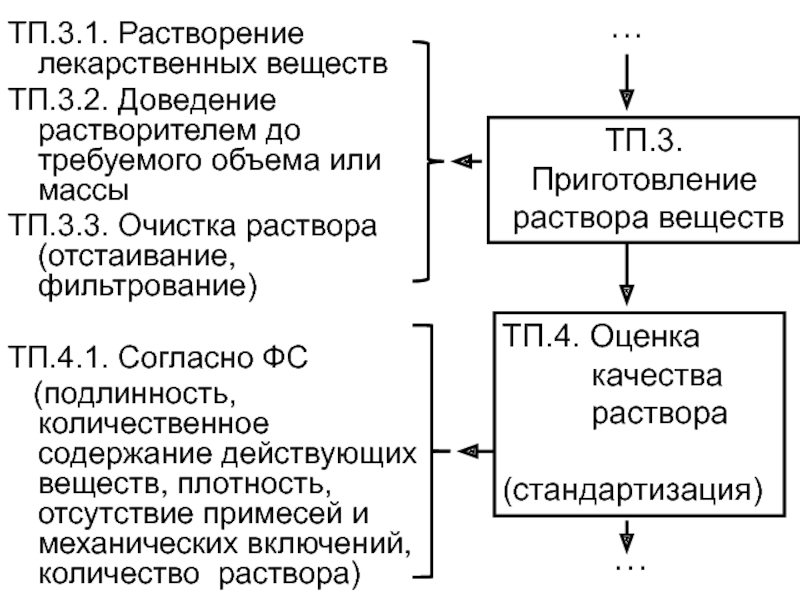
Слайд 10ТП.3.1. Растворение лекарственных веществ
ТП.3.2. Доведение растворителем до требуемого объема или
массы
ТП.3.3. Очистка раствора (отстаивание, фильтрование)
ТП.4.1. Согласно ФС
(подлинность,
количественное содержание действующих веществ, плотность, отсутствие примесей и механических включений, количество раствора) ТП.3.
Приготовление
раствора веществ
ТП.4. Оценка
качества
раствора
(стандартизация)
…
…
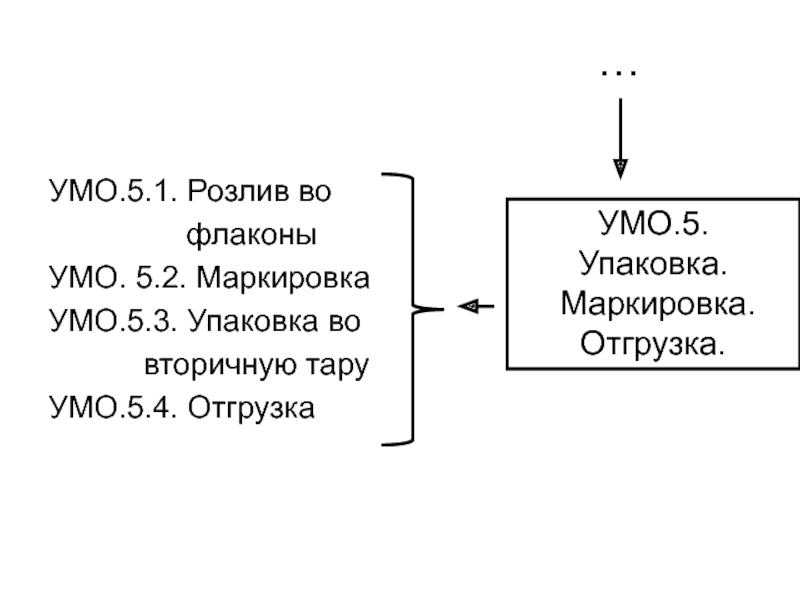
Слайд 11УМО.5.1. Розлив во
флаконы
УМО. 5.2. Маркировка
УМО.5.3. Упаковка во
вторичную таруУМО.5.4. Отгрузка
УМО.5.
Упаковка.
Маркировка. Отгрузка.
…
Слайд 12 1. Подготовительная стадия
Проводят расчеты в соответствии с НД. Подготавливают
лекарственные вещества и растворитель (измельчают, отмеривают, взвешивают).
Проводят контроль: определяют
соответствие лекарственных веществ и растворителя требованиям НД.Слайд 132. Растворение
Растворение - это диффузионно-кинетический процесс, протекающий при соприкосновении растворяемого
в-ва с растворителем.
Получение растворов из жидких веществ протекает без
особых трудностей, как их простое смешивание. Растворение твердых веществ, особенно медленно и труднорастворимых - это сложный процесс, который условно можно разделить на несколько стадий:
Слайд 14Контактирование поверхности твердого тела с растворителем, сопровождающееся смачиванием, адсорбцией и
проникновением растворителя в микропоры частиц твердого тела;
Взаимодействие молекул растворителя со
слоями вещества на поверхности раздела фаз, сопровождающееся сольватацией молекул или ионов и их отрывом;Переход сольватированных молекул или ионов в жидкую фазу;
Выравнивание концентраций во всех слоях растворителя.
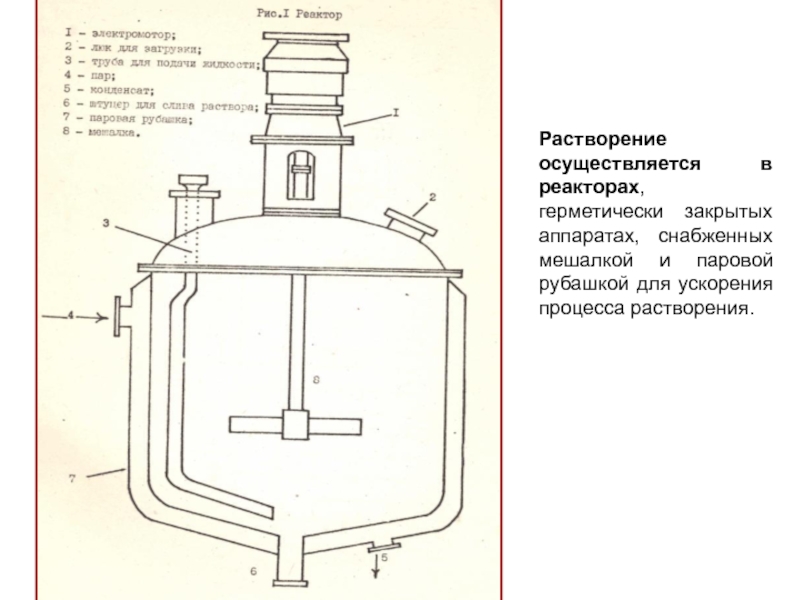
Слайд 15Растворение осуществляется в реакторах, герметически закрытых аппаратах, снабженных мешалкой и
паровой рубашкой для ускорения процесса растворения.
Слайд 16Способы перемешивания
Механическое (мешалки)
Пневматическое (барботирование)
Гравитационное (разность плотности растворителя и раствора)
УЗ
Циркуляционное
Слайд 193. Очистка растворов.
Разделение жидких гетерогенных систем
Выбор способа и условий
очистки от механических включений связан со свойствами исходных дисперсных систем
- суспензий, эмульсий.Основные применяемые в технологии растворов способы разделения - это отстаивание, фильтрование и центрифугирование.
Слайд 20Отстаивание - это разделение под действием сил тяжести
Разделение фаз
под действием силы тяжести.
Осуществляется в отстойниках постоянного и периодического типа
действияИспользуется для предварительной очистки
Недостаток отстаивания - малая производительность и длительность.
Слайд 22Фильтрование - это процесс разделения неоднородных систем (взвесей) с помощью
пористых перегородок - фильтров.
Требования к фильтрующему материалу:
задерживать частицы
требуемого размера;обладать химической устойчивостью и механической прочностью
не изменять физико-химических с-в фильтрата;
обеспечивать возможность регенерации;
быть доступными и дешевыми
Слайд 23Виды фильтрования
Грубая фильтрация – частицы размером 50 и более мкм
Тонкая
фильтрация – 1-50 мкм
Микрофильтрация (стерильная ) – 0,5-5 мкм
Микрофильтрация (удаление
пирогенов) – 0,001 – 0,1 мкмСлайд 24Классификация фильтровальных перегородок
По материалам
- хлопчатобумажные
- шерстяные
- синтетические
- стеклянные
- керамические
- металлические
-
металлокерамические
Слайд 252. По структуре
- гибкие
- негибкие
3. По физическим свойствам
- сжимаемые
- несжимаемые
-
зернистые
4. По принципу работы
- при атмосферном давлении
- при вакууме
(нутч-фильтры)- при избыточном давлении (друк-фильтры, позволяют фильтровать вязкие, легколетучие и с большим сопротивлением осадка жидкости.)
Слайд 28Центрифугирование
- разделение фаз под действием центробежной силы.
Используются центрифуги
отстойные, фильтрующие, суперцентрифуги
Слайд 30ОСТ 91500.05.001-00 Стандарты качества ЛС Растворы для внутреннего и
наружного применения
1. Название препарата на русском языке
2. MHН на
русском языке3. Состав
4. Описание (внешний вид, цвет, запах)
5. Подлинность
6. Значение рН
7. Плотность
8. Вязкость
Слайд 319. Посторонние примеси (родственные соединения)
10. Размеры частиц (в случае
суспензии, эмульсии)
11. Определение объема
12. Микробиологическая чистота
13. Количественное определение
14. Упаковка
15. Маркировка
16.
Транспортирование17. Хранение
18. Срок годности
19. Фармакологическая группа
Слайд 33Жидкость Бурова
представляет собой раствор моноосновной уксусно-алюминиевой соли с плотностью
1,044-1,048.
Описание. Бесцветная прозрачная жидкость кислой реакции со слабым запахом
уксусной кислоты.Получение. Электрохимический и химический способы.
Количественное определение. Основной уксусноалюминиевой соли должно быть 7,6-9,2%.
Хранение. В хорошо закупоренных флаконах, в прохладном месте.
Применение. Вяжущее и противовоспалительное средство для полосканий, примочек, спринцеваний при воспалительных заболеваниях кожи и слизистых оболочек.
Слайд 34Сущность электрохимического способа получения жидкости Бурова заключается в анодном растворении
алюминия в 8% уксусной кислоте.
Уксусная кислота, являясь слабым электролитом, в
водном растворе частично диссоциирует:CНЗСООН → СНЗСОО- + Н+
В то же время диссоциирует вода: Н2O → Н++ ОН-
На катоде идет разряд ионов водорода: 6Н++ 6е-→ЗН2
На аноде происходит растворение алюминия(переход металлического алюминия в ионное состояние):
2А1—6е- → 2Аl+++
Слайд 35В околоанодном пространстве происходит образование гидрата окиси алюминия и взаимодействие
его с уксусной кислотой:
Аl (ОН) з+2СН3СOOН →Аl(ОН) (СН3СОО) 2+2Н2O
непосредственное образование основной уксусно-алюминиевой соли: Аl+++ + 2СН3СOO- + OН- →Аl (ОН) (СНзСОО) 2
или в молекулярной форме:
2 Al + 2H2O + 4СНзСООН →2Аl(ОН) (СН3СОО)2+3 Н2O
2X26,97=53,94 4X60,05=240,20 2x162,10 = 324,20
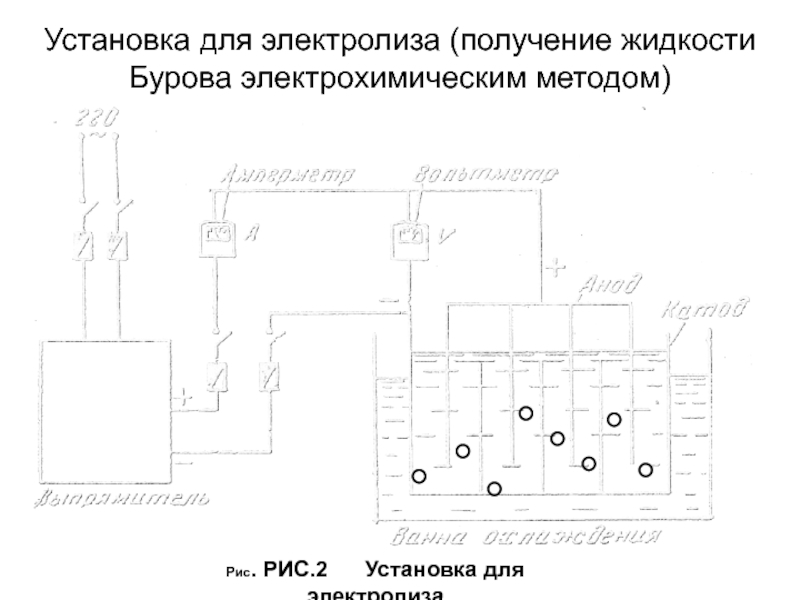
Слайд 36Установка для электролиза (получение жидкости Бурова электрохимическим методом)
Рис. РИС.2
Установка для электролиза
Слайд 37Технологический процесс состоит из 3 стадий
Подготовка электролита и электродов. Ванну
электролизера и анод обрабатывают 10% раствором соляной кислоты для очистки
поверхности от оксида алюминия, после чего промывают водопроводной и очищенной водой. После в ванну заливают электролит — 8% раствор уксусной кислоты, подключают к выпрямителю и включают ток.Проведение электролиза. Силу тока поддерживают в пределах 1,0-1,25 А, напряжение 4,5-5,5 В, температура электролита 18-20°С. Процесс растворения алюминия продолжается несколько часов до получения плотности электролита 1,040 - 1,046, значение рН при этом 4,0-4,7. После этого ток отключают. Раствор отстаивают и фильтруют.
Стандартизация. Основного ацетата алюминия должно быть 7,6 - 9,2%
Слайд 38Химический способ получения жидкости Бурова
Квасцов алюмокалиевых……………………..46,5 г
Кальция карбоната……………………………..14,5 г
Кислоты
уксусной разведенной (30%)… 39,0 г
Воды очищенной…………………….достаточное количество
Пропись согласно ГФ VIII ст. 338
Слайд 39Химический способ получения раствора основного ацетата алюминия
1. Подготовка исходных материалов:
а) растворение квасцов
в горячей воде;
б) растирание кальция карбоната.
2. Образование осадка гидроксида алюминия и
промывание его от электролитов.3. Растворение гидроксида алюминия в уксусной кислоте
4. Стандартизация раствора.
2 KAl(SO4)2 ⋅ 12H2O + 3CaCO3 → 2А1(ОН)3 + 3CaSO4 + K2SO4 + 3CO2 +21Н2O
2А1(ОН)3 + 4СН3СООН → 2А1(ОН) (СН3СОО)2 + 4Н20
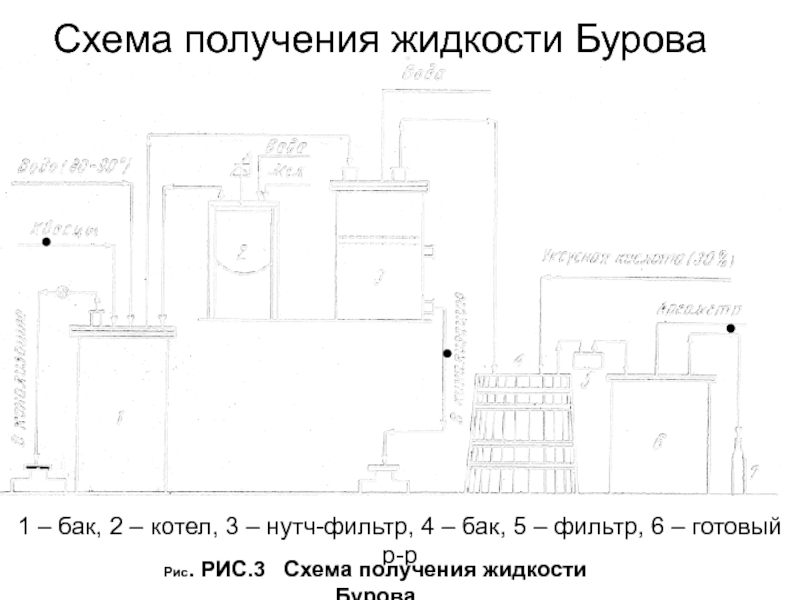
Слайд 40Схема получения жидкости Бурова
1 – бак, 2 – котел, 3
– нутч-фильтр, 4 – бак, 5 – фильтр, 6 –
готовый р-рРис. РИС.3 Схема получения жидкости Бурова
Слайд 41 Технологический процесс приготовления раствора состоит из четырех стадий:
Подготовка
исходных материалов
Получение осадка гидроксида алюминия Осаждение гидроксида алюминия производится
при температуре, не превышающей 20°С. При этом условии получается осадок, легко реагирующий с кислотой уксусной, в то время как из теплых растворов образуется грубодисперсный осадок, трудно растворяющийся в кислоте уксусной.
Слайд 42К охлажденному прозрачному раствору квасцов при перемешивании прибавляют суспензию кальция
карбоната. Смесь перемешивают в течение 20 мин для удаления углекислоты
и доведения реакции до конца. При этом в растворе находится калия сульфат, а в осадке — гидроксид алюминия и кальция сульфат. Полученную смесь отстаивают, прозрачную жидкость сливают, а осадок фильтруют на воронке Бюхнера и промывают водой от электролитов.Полноту удаления калия сульфата проверяют с натрийкобальтгексанитритом Na3[Co(N02)2]6, при этом не должно быть желтого осадка калийкобальтгексанитрита.
Слайд 43Растворение осадка в кислоте уксусной
Промытый почти сухой
осадок смешивают с 39,0 г разведенной 30% кислотой уксусной. В
закрытой емкости смесь оставляют на 2—3 суток.4. Стандартизация.
Концентрированный раствор взвешивают, измеряют объем и определяют плотность. По расчету добавляют воду очищенную до плотности 1,044—1,048.
Основной уксусноалюминиевой соли должно быть 7,6—9,2%.
Слайд 44Раствор основного ацетата свинца (Solutio Plutnbi subacetatis)
Описание. Бесцветная прозрачная или
с незначительным белым осадком жидкость слабощелочной реакции. Плотность 1,225—1,230.
Получение. Двумя
способами при взаимодействии; оксида свинца с ацетатом свинца
оксида свинца с кислотой уксусной.
Количественное определение. Содержание свинца должно быть 16,7—17,4%.
Хранение. В хорошо закупоренных доверху наполненных флаконах.
Применение. Вяжущее средство для обмывания и примочек при ушибах в виде 2% водного раствора; 0,25—0,5% растворы используют при воспалительных заболеваниях кожи и слизистых оболочек.
Слайд 45Химический способ получения свинцового уксуса (раствора свинца ацетата основного)
ФС 42-2072-83
Способ 1
Взаимодействие свинца оксида со свинца
ацетатом с образованием раствора основной уксусно-свинцовой солиРbО+2Рb(СН3СОО)2 ⋅ ЗН2O →[2Pb(CH3COO)2] ⋅ Pb(OH)2 + 2H2O
Свинца ацетата………………….....30 г
Свинца оксида……………………….10 г
Воды очищенной……………………100 мл
Слайд 46Технологический процесс состоит из четырех стадий
Получение основной уксусносвинцовой соли
Свинца ацетат, свинца оксид, измельченный в порошок и примерно 30
мл горячей очищенной воды помещают в емкость и тщательно перемешивают в течение 30 мин до образования белой массы.Растворение основной уксусносвинцовой соли.
По окончании взаимодействия к смеси добавляют остальное количество хорошо прокипяченной горячей очищенной воды и тщательно перемешивают. Жидкость переносят в небольшой флакон, плотно закрывают пробкой и оставляют для отстаивания на 2 суток.
Слайд 47Фильтрование.
Жидкость фильтруют сквозь складчатый фильтр в сухой
флакон, прикрывая воронку стеклом для защиты от доступа углекислого газа
воздуха, во избежание образования основных солей свинца карбоната, не растворимых в воде.Стандартизация.
Прозрачный раствор взвешивают, измеряют объем, определяют плотность и в случае надобности по расчету добавляют свежепрокипяченную воду до плотности 1,223—1,230.
Содержание свинца в препарате должно быть 16,7— 17,4%.
Слайд 48Химический способ получения раствора свинца ацетата основного №2
Способ 2. Взаимодействие
свинца оксида с кислотой уксусной:
РbО + 2СН3СООН → Рb(СН3СОО)2 ⋅
ЗН2OРbО + Рb(СН3СОО)2 ⋅ ЗН20 → [2Pb(CH3COO)2]Pb(OH)2 + 2Н3O
Кислоты уксусной 80% ……………..10 г.
Свинца оксида……….…..................19 г.
Воды очищенной до получения ….100 мл.
Слайд 49В колбу с обратным холодильником помещают 10 г 80% кислоты
уксусной, 2 мл очищенной воды и нагревают на водяной бане
до 60°С, после чего загружают 19 г мельчайшего порошка свинца оксида.Смесь нагревают до 80°С при интенсивном перемешивании до получения жидкости сероватого цвета.
Добавляют 70 мл воды очищенной и нагревают до 80—95°С. Смесь отстаивают 2 суток, быстро фильтруют и стандартизуют (см. способ 1).