изменением цвета реакционной смеси при её встряхивании на воздухе. Например,
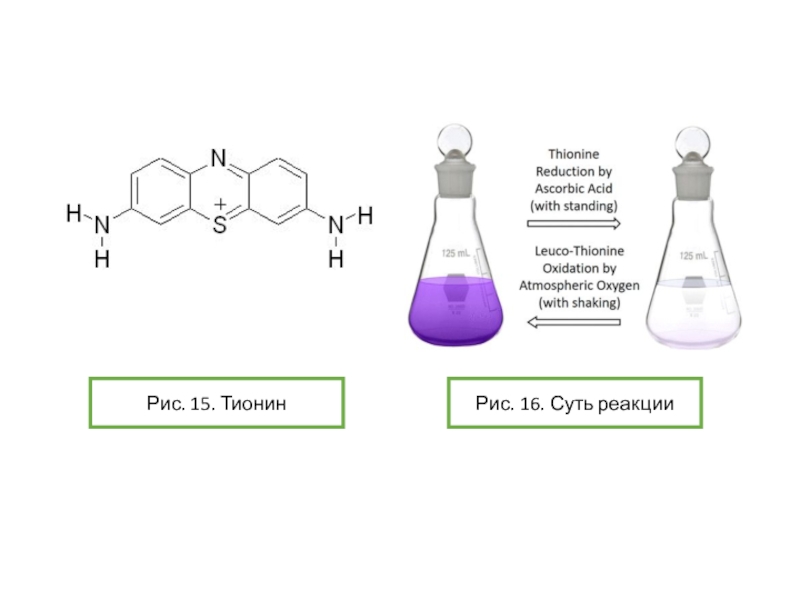
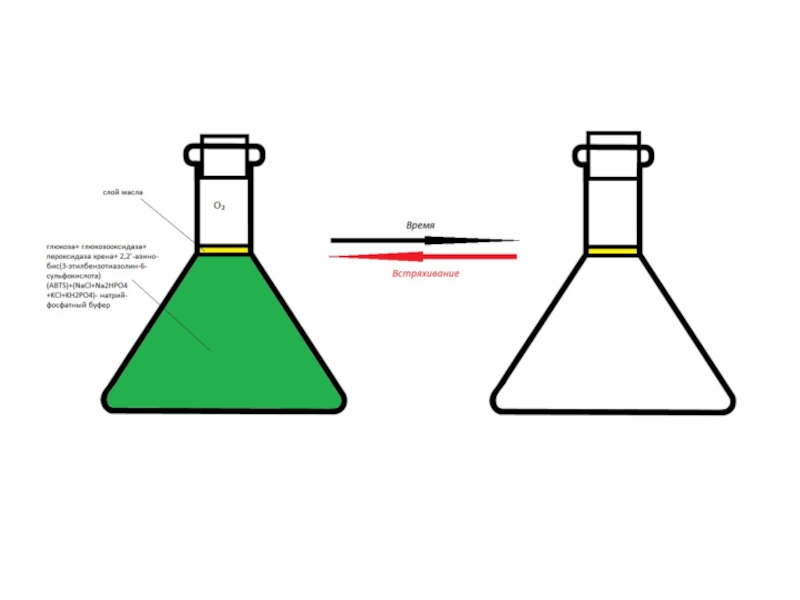
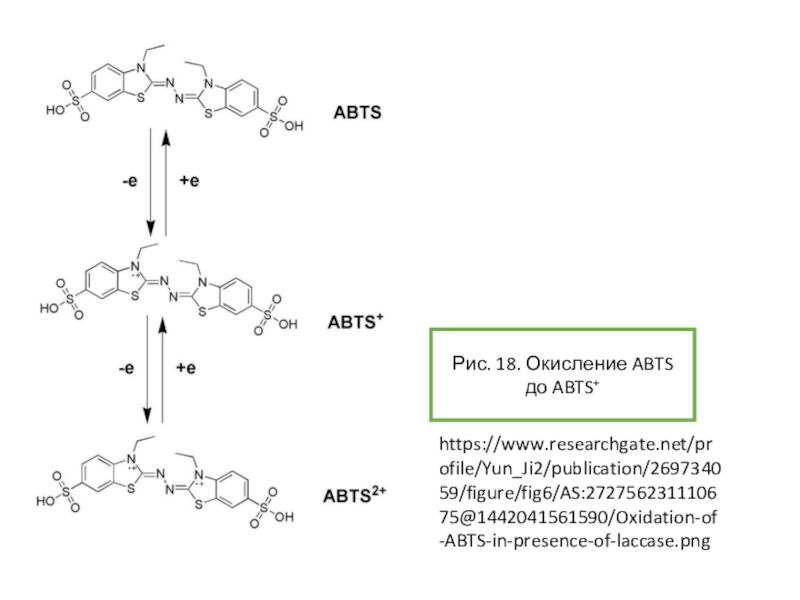
опыт «химический светофор» основан на использовании индигокармина и в нем наблюдаются переходы «желтый-красныйзеленый». Опыт «синяя бутылка» использует в качестве основного вещества краситель метиленовый синий. Однако оба этих опыта требуют использования крепких растворов щелочей и глюкозы. Можно ли заменить данные красители на другие? Предложите обратимо изменяющие цвет системы без крепких растворов щелочей, превращения которых основаны на тех же химических явлениях, что протекают в ходе описанных выше опытов.Условие задачи






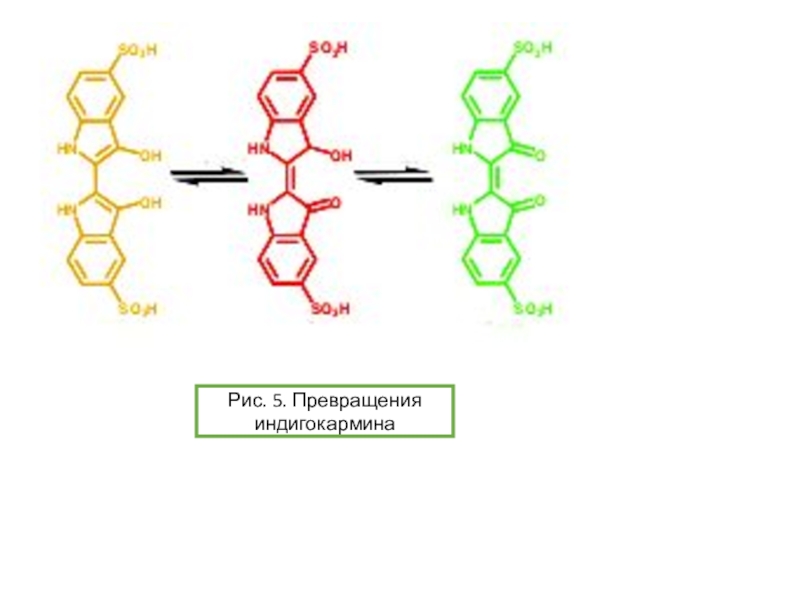
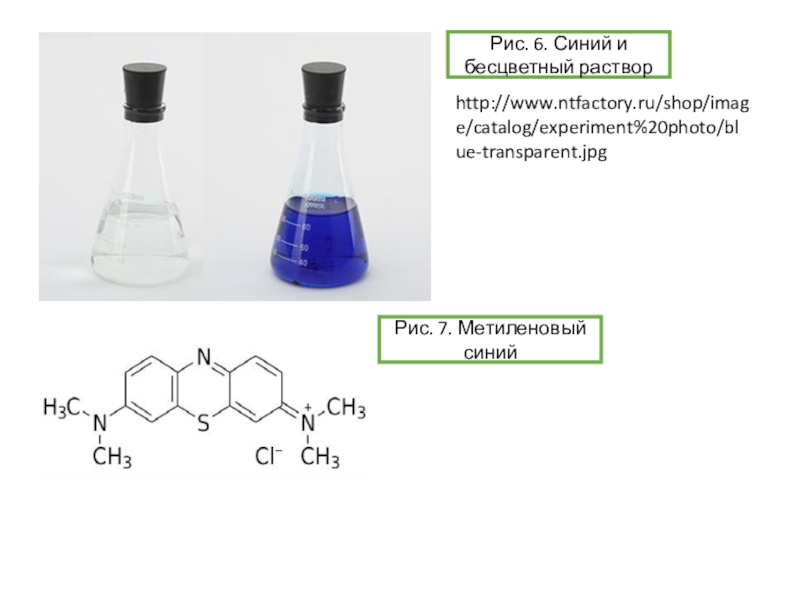
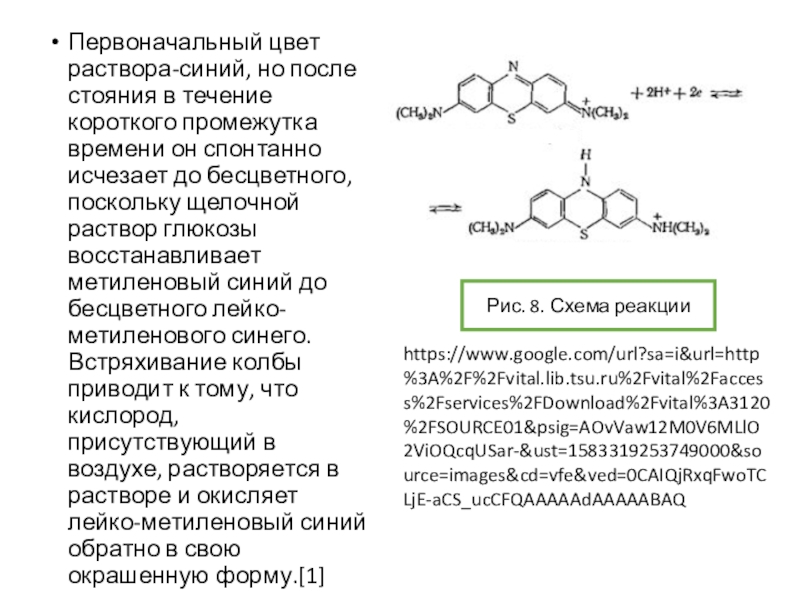
![Задача 12 Окислительно-восстановительные индикаторы Возможные варианты замены индикатора для опыта «синяя бутылка»:-блестящий синий FCF(Е133)-резазурин-тионин[2]Рис. 10. Возможные варианты замены индикатора для опыта «синяя бутылка»:-блестящий синий FCF(Е133)-резазурин-тионин[2]Рис. 10. Блестящий синий FCFhttps://upload.wikimedia.org/wikipedia/commons/thumb/4/48/Acid_Blue_9.svg/1280px-Acid_Blue_9.svg.pngРис. 9. Опыт с](/img/thumbs/dabae384de1bae427262b3d590e0ebb7-800x.jpg)

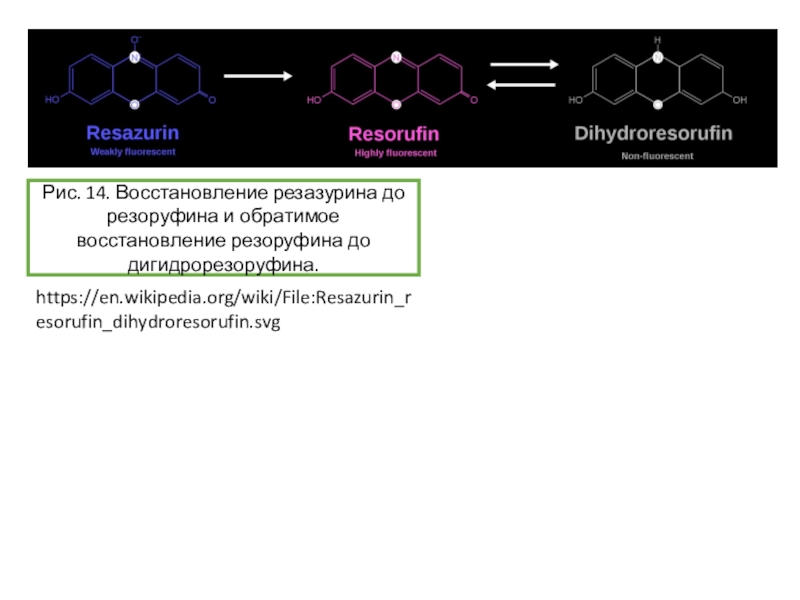




![Задача 12 Окислительно-восстановительные индикаторы Источники информации [1] Summerlin, Lee R. (1988). Chemical demonstrations (2nd ed.). Washington, DC: Источники информации [1] Summerlin, Lee R. (1988). Chemical demonstrations (2nd ed.). Washington, DC: American Chem. Society. p. 127. Dutton, F.](/img/thumbs/5c453b1c44777bb36a6935e4f54c6697-800x.jpg)




















