знаний при решении качественных и расчетных задач;
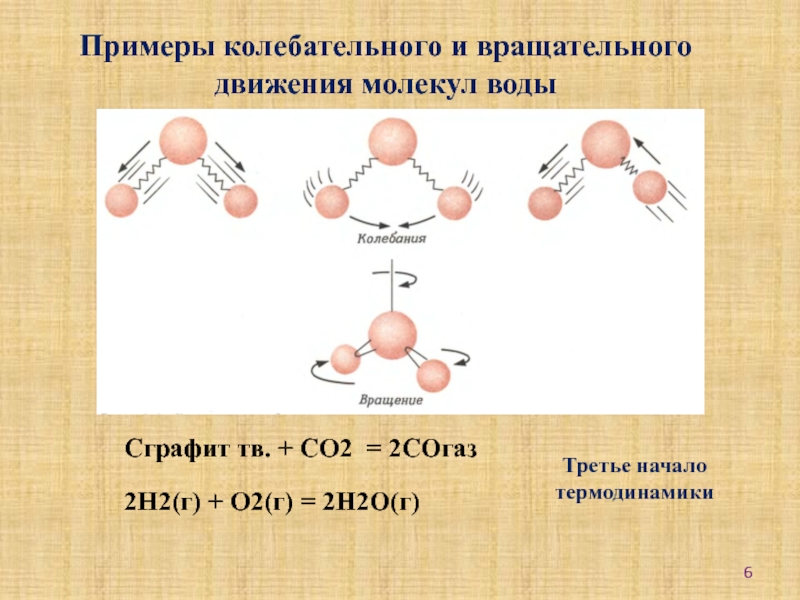
-установление связи между энтальпийным,
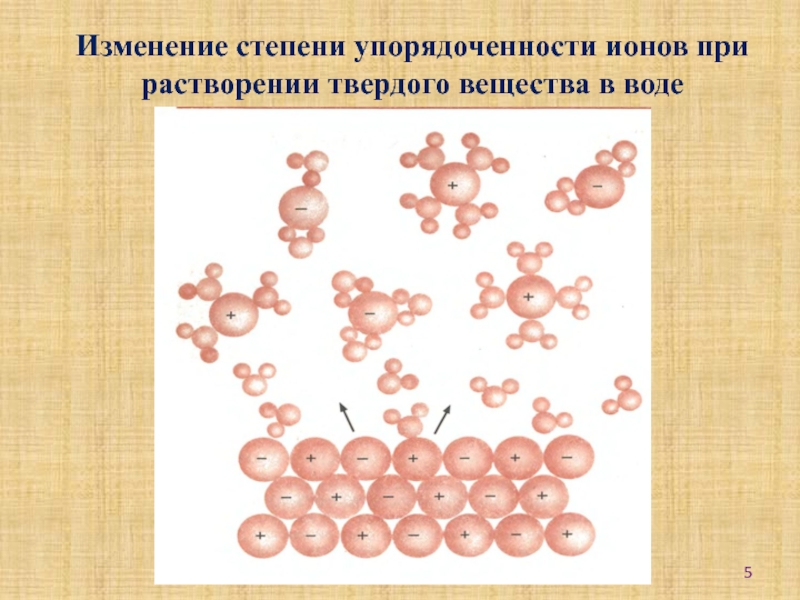
энтропийным факторами и самопроизвольностью прохождения реакций;-научиться оценивать возможность или невозможность самопроизвольного протекания реакций при данных условиях.
Практическое занятие:«Решение задач по термодинамике»
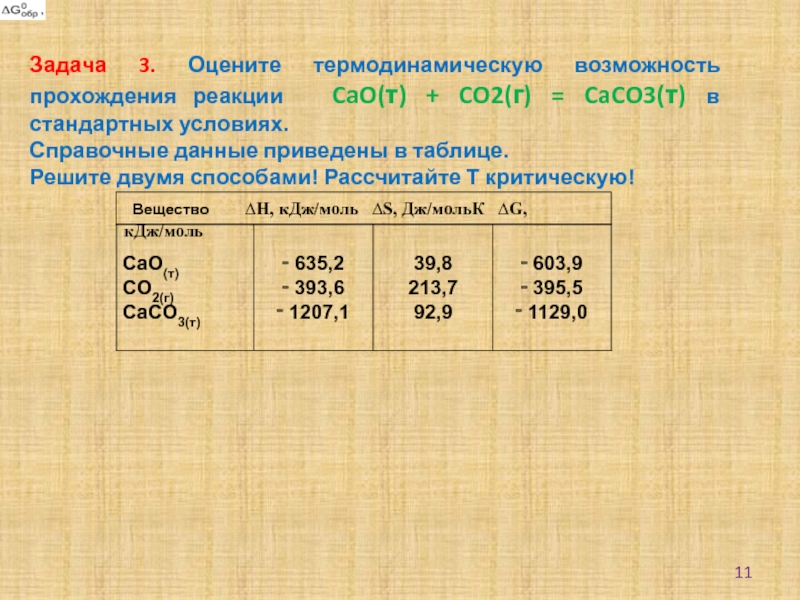
Цель занятия: закрепить умения решать задачи по химической термодинамике, обобщить знания по теме "Энергетические эффекты и направление течения химических реакций".