Слайд 1Задачи, включаемые
в задание 33 тестов ЕГЭ
Слайд 2Общие принципы решения расчетных задач по химии
1 этап: составить уравнение
реакций тех превращений, которые упоминаются в условии задачи.
2 этап: рассчитать
количества и массы «чистых веществ».
3 этап: установить причинно-следственные связи между реагирующими веществами, т.е. определить – количество какого вещества требуется найти и по какому из реагирующих веществ будет производиться расчет.
Слайд 3Общие принципы решения расчетных задач по химии
4 этап: произвести расчеты
по уравнению (-ям) реакций, т.е. рассчитать количество искомого вещества, после
чего найти его массу (или объем газа).
5 этап: ответить на дополнительные вопросы, сформулированные в условии.
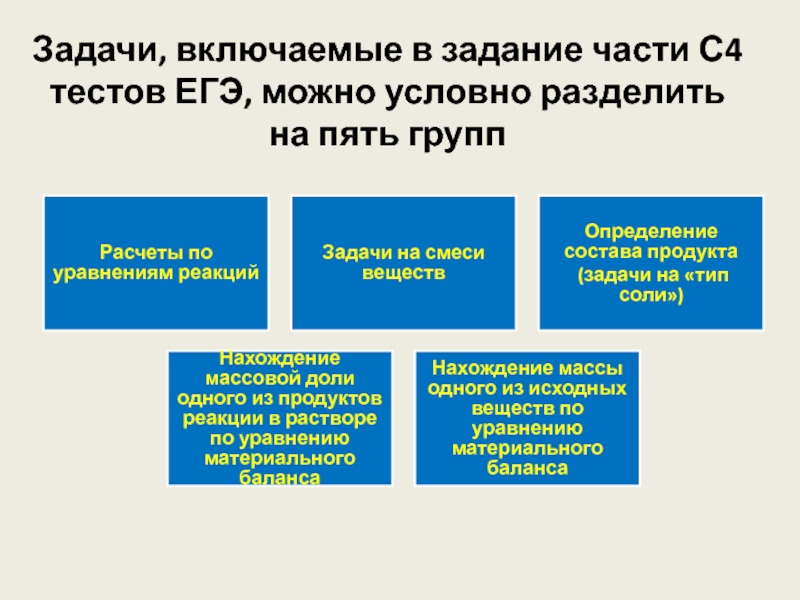
Слайд 4Задачи, включаемые в задание части С4 тестов ЕГЭ, можно условно
разделить
на пять групп
Слайд 5
Расчеты
по уравнениям реакций
К раствору, образовавшемуся в результате взаимодействия 18,2г
фосфида кальция и 400мл 5%-ного раствора соляной кислоты (ρ=1,1г\мл), добавили
193,2г 5%-ного раствора карбоната калия. Определите массу образовавшегося осадка и объем выделившегося газа (н.у.).
Слайд 61) Уравнения реакций:
Ca3P2 + 6HCl = 3CaCl2 +2PH3
(1)
CaCl2 + K2CO3 =CaCO3↓ +2KCl (2).
2)Количества реагирующих веществ
(количества «чистых» реагирующих веществ):
n =mв-ва /Mв-ва; mв-ва=W ∙ mр-ра; mр-ра=ρ∙V
а) количество HCl:
mр-ра (HCl) = 1,1∙400=440г
m (HCl) =0,05 ∙440=22г
n(HCl) =22/36,5≈0,603≈0,6 моль
n(HCl) = W∙ ρ∙V\ Mв-ва =0,05∙1,1∙400∕36,5=0,6 моль
б) количество K2CO3
m (K2CO3) =0,05∙193,5=9,675г
n (K2CO3)=9,675 ∕138≈0,07 моль
в) количество Ca3P2
n (Ca3P2)=18,2∕ 182= 0,1 моль
3)По уравнению (1) (количество CaCl2 и PH3 можно найти либо по Ca3P2, либо по HCl, следовательно, необходимо будет провести проверку на «избыток – недостаток» и производить расчет по «недостатку»)
а) n (Ca3P2) : n(HCl) : n(CaCl2) : n (PH3)=1:6:3:2, следовательно: Ca3P2 и HCl взяты в количествах, соответствующих уравнению реакции (эквимолярные количества) , и прореагируют полностью.
б) n (CaCl2) =3n(Ca3P2)=0,1∙3=0,3 моль
в) n (PH3)= 2n (Ca3P2)=0,1∙2=).2 моль
V(PH3)= n∙Vм =0,2∙22,4=4,48л
4)По уравнению (2)
n (CaCl2): n (K2CO3): n (CaCO3) =1:1:1, следовательно:
а) в избытке CaCl2 в количестве (0,3-0,07) =0,23 моль и
б) n (CaCO3) = n (K2CO3)= 0,07 моль
m(CaCO3)= n∙ Mв-ва=0,07 ∙100=7г.

Слайд 7Задачи на смеси веществ
На нейтрализацию 7,6 г смеси муравьиной и
уксусной кислот израсходовано 35 мл 20%-ного раствора гидроксида калия (ρ=
1,20 г\мл). Рассчитайте массу уксусной кислоты и ее массовую долю в исходной смеси.
Слайд 81) Уравнения реакций:
НСООН + КОН=НСООК + Н2О
(1)
СН3СООН + КОН =
СН3СООК + Н2О (2).
2) Количество КОН:
n =mв-ва /Mв-ва; mв-ва=W ∙ mр-ра; mр-ра=ρ∙V
mр-ра =1,20∙35=42г;
mв-ва =0,2∙42=8,4г;
n (КОН) =8,4∕56=0,15 моль.
3) Пусть в смеси
n (НСООН) =X моль, n (СН3СООН) =У моль, тогда
а) m (НСООН) =X 46г, m(СН3СООН) =У 60г
б) по уравнению (1) n (КОН) = n (НСООН) =X моль
в) по уравнению (2) n (КОН) = n (СН3СООН) =У моль
г) Составляем и решаем систему уравнений
X 46г + У60 =7,6 X =0,1 моль НСООН
X + У =0,15 У =0,05 моль СН3СООН
4) Массовая доля СН3СООН в смеси:
m(СН3СООН) =0,05 ∙ 60 =3г
W(СН3СООН) = m(СН3СООН)∕ m (смеси) = 3∕7,6=0,947≈39,5%
Слайд 9Определение состава продукта реакции (задачи на «тип соли»)
Аммиак, объемом 4,48л
(н.у.) пропустили через 200г 4,9% -ного раствора ортофосфорной кислоты. Назовите
соль, образующуюся в результате реакции, определите ее массу.
Слайд 101) Количество вещества аммиака:
n (NH3) =V∕VM =4,48∕22,4=0,2 моль
2) Масса и
количество вещества Н3РО4:
mв-ва=W ∙ mр-ра; m (Н3РО4)=0,049∙200=9,8г
n =mв-ва /Mв-ва; n(Н3РО4)=9,8∕98=0,1
моль
3) а) NH3+Н3РО4=NH4H2PO4
По уравнению реакции
n (NH3): n(Н3РО4): n(NH4H2PO4) =1:1:1, следовательно,
в избытке NH3 в количестве (0,2-0,1)= 0,1 моль.
n(NH4H2PO4) = n(Н3РО4) =0,1 моль
б) NH3+NH4H2PO4 = (NH4)2 HPO4
По уравнению реакции
n (NH3): n(NH4H2PO4): n((NH4)2 HPO4)=1:1:1, следовательно,
NH3 и NH4H2PO4 прореагируют полностью
n((NH4)2 HPO4)= n (NH3)=0,1 моль
4) Масса гидрофосфата аммония NH4H2PO4
mв-ва =n∙ Mв-ва
m (NH4H2PO4) =0,1 ∙132=13,2г.
Слайд 11Нахождение массовой доли одного из продуктов реакции в растворе по
уравнению материального баланса
Оксид, образовавшийся при сжиганиии18,6г фосфора в 44,8л (н.у.)
кислорода, растворили в 100мл дистиллированной воды. Рассчитайте массовую долю ортофосфорной кислоты в полученном растворе.
Слайд 121) Уравнения реакций:
4Р +5О2 = 2Р2О5
Р2О5 + 3Н2О
= 2 Н3РО4
2) Количества и массы реагирующих веществ:
mр-ра=ρ∙V; n
=mв-ва /Mв-ва; n =V∕VM
а) количество воды
m (Н2О)=1∙100=100г
n (Н2О)= 100∕18=5,56 моль
б) количество фосфора
n (Р) =18,6∕31 = 0,6 моль
в) количество кислорода
n (О2) =44,8∕22,4=2 моль
3) По уравнению (1)
n (Р) : n (О2) : n (Р2О5) =4:5:2, следовательно,
а) в избытке кислород в количестве (2-0,6∙5∕4) =1.25 моль
б) n (Р2О5) = 0,5 n (Р) = 0,6∕2 = 0,3 моль
m(Р2О5) = 0,3∙142=42,6г.
4) По уравнению (2)
n (Р2О5): n (Н3РО4) =1:2
n (Н3РО4) =2 n (Р2О5)=2 ∙0,3 = 0,6 моль,
m(Н3РО4) = 0,6 ∙98=58,8 г.
5) Рассчитываем массовую долю Н3РО4:
W(Н3РО4) = mв-ва(Н3РО4)∕ mр-ра(Н3РО4)
mр-ра(Н3РО4) = m(Р2О5)+ m (Н2О)=42,6+100=142,6г.
W(Н3РО4)=58,8∕142,6=0,4123, или 41,23%
Слайд 13Нахождение массы одного из исходных веществ по уравнению материального баланса
Какую
массу гидрида лития нужно растворить в 200 мл воды, чтобы
получить раствор с массовой долей гидроксида 10%? Какой цвет приобретет метилоранж при добавлении его в полученный раствор? Запишите уравнения реакций и результаты промежуточных вычислений.
Слайд 141) Уравнение реакции:
LiH + H2O = LiOH +H2↑
(1)
Так как образуется раствор щелочи LiOH, то индикатор метилоранж окрасится в желтый цвет.
2) Формула для расчета массовой доли
W(LiOH) = = (2)
3) По уравнению реакции
n (LiH): n (H2O): n (LiOH): n (H2) =1:1:1:1;
Пусть прореагировало Х моль LiH, тогда m(LiH)= Х∙8г
n (LiOH)= n (LiH)= Х моль, m(LiОH)=Х∙24г
n (H2) = n (LiH) =Х моль, m(H2) =Х∙2г
m(H2)= ρ∙V=1∙200=200г.
4) По формуле (2)
0,1=24Х∕(8Х+200-2Х) → Х≈0,85 моль LiH
m(LiH)=0,85∙8=6,8г.
Слайд 15Литература
Серия «Готовимся к ЕГЭ», Химия. Тематические тесты для
подготовки к ЕГЭ. Задания высокого уровня сложности (С1-С5).
В.Н. Доронькин, А.Г. Бережная,
Т.В. Сажнева, В.А. Февралева;
Легион, Ростов-на-Дону, 2011г.
Слайд 16Спасибо за внимание!
Удачи на ЕГЭ!!!