Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Занятие 3: 1. Филогенез эукариотической клетки. 2. Обмен веществ, роль мембран
Содержание
- 1. Занятие 3: 1. Филогенез эукариотической клетки. 2. Обмен веществ, роль мембран
- 2. Филогенез эукариотической клетки
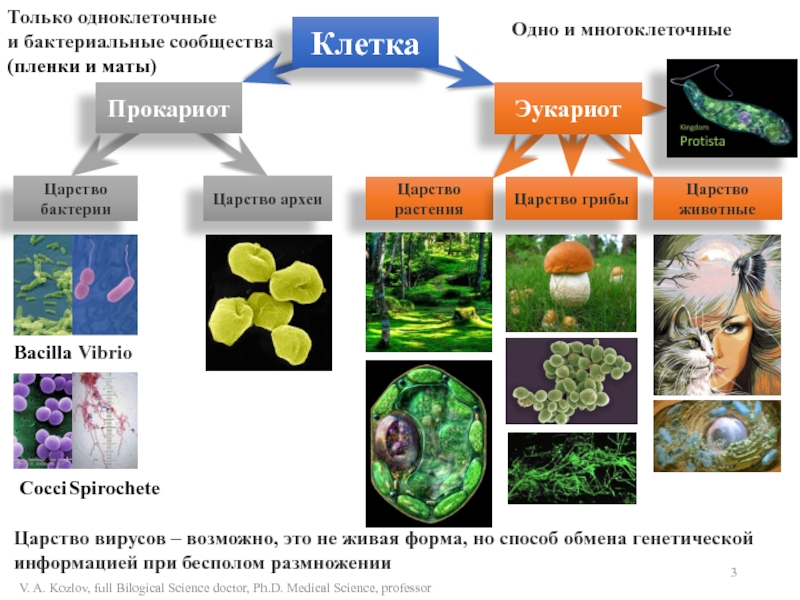
- 3. КлеткаПрокариотЭукариотЦарство бактерииЦарство археиBacillaCocciТолько одноклеточныеи бактериальные сообщества(пленки и
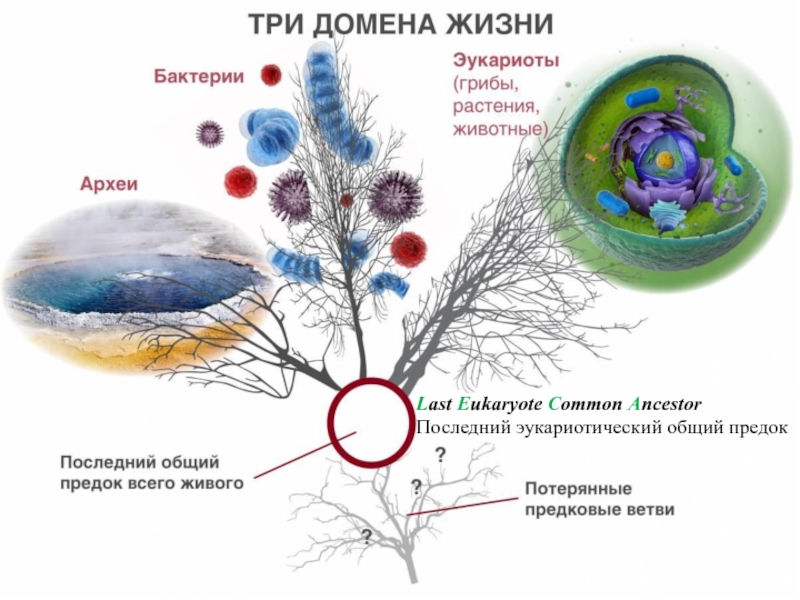
- 4. Last Eukaryote Common AncestorПоследний эукариотический общий предок
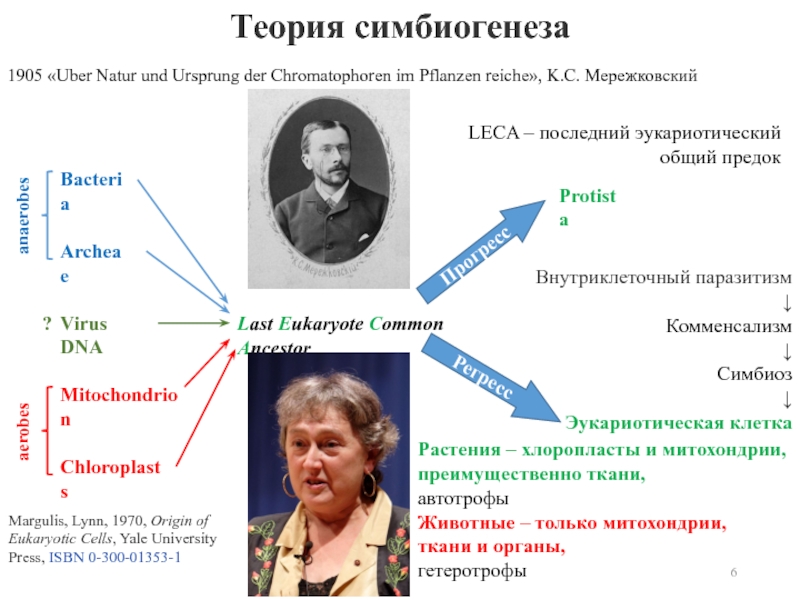
- 5. В 1905 K.С. Мережковский предположил, что эукариотическая
- 6. Теория симбиогенезаanaerobesaerobes1905 «Uber Natur und Ursprung der
- 7. V. A. Kozlov, full Bilogical Science doctor,
- 8. Последний эукариотический общий предок имел значительно более
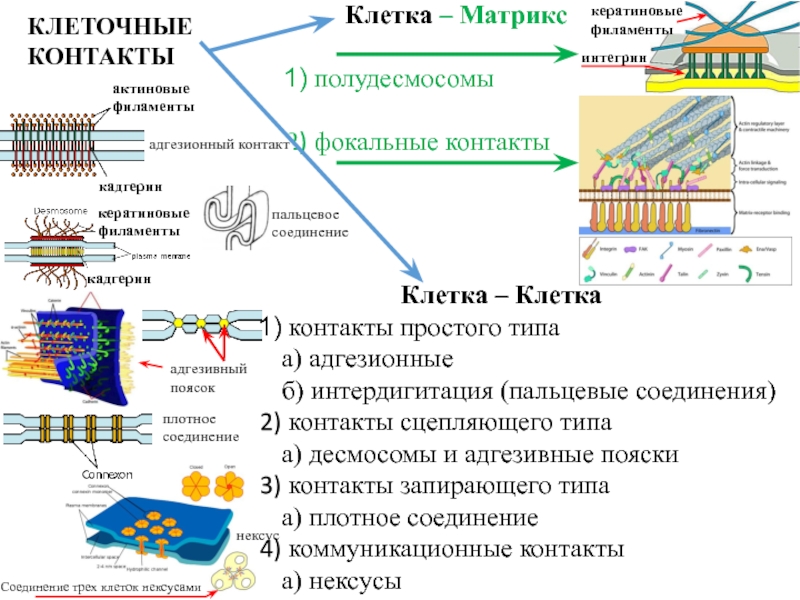
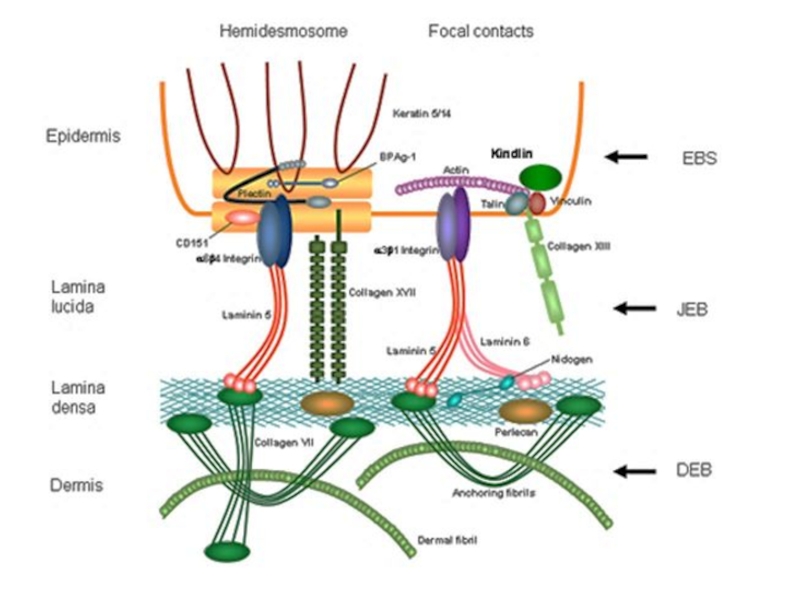
- 9. Типы соединения клеток
- 10. нексусКлетка – Клетка контакты простого типаа) адгезионныеб)
- 11. Слайд 11
- 12. Слайд 12
- 13. Межклеточные контакты необходимы длясоединения клетокинформационного обменаа) межклеточного б) с внешней средойДля этого клетка создает ионные каналы
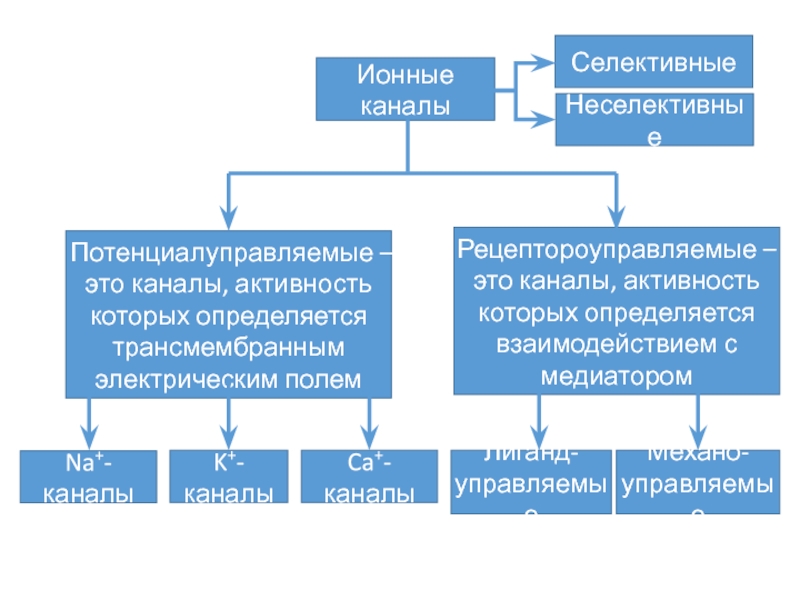
- 14. Ионные каналы
- 15. Слайд 15
- 16. Общее представление о структуре и функциях ионных
- 17. Трехмерная пространственная структураканалообразующей молекулы белка
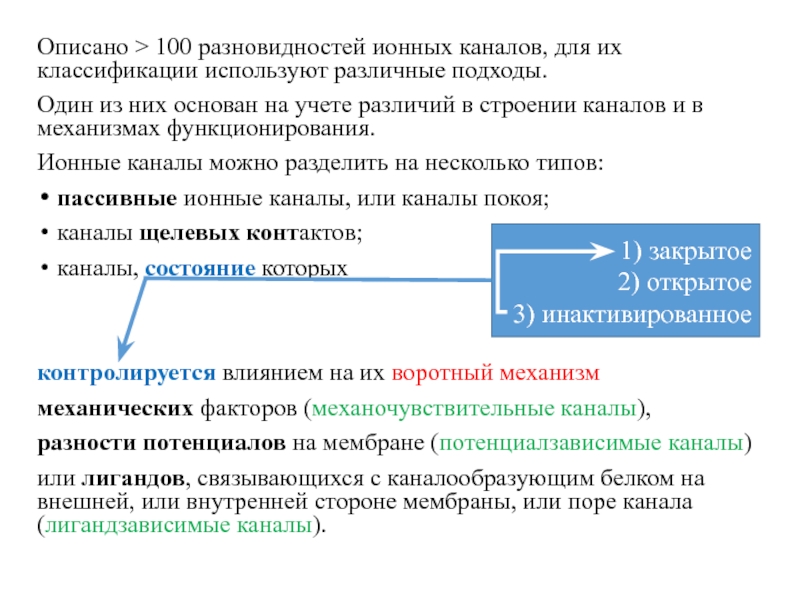
- 18. Описано > 100 разновидностей ионных каналов, для
- 19. Пассивные каналымогут быть открытыми (активными) в покоящихся
- 20. Каналы щелевых (плотных) контактов клетокКаналы щелевых контактов
- 21. Мембраны двух соседних клетокКаналЩелевой контакт3,5 нмКоннексин –
- 22. Ионные каналы
- 23. Потенциалзависимые каналыСостояние этих каналов управляется силами электрического
- 24. Потенциал-зависимый канал может находиться в трех последовательных
- 25. Скорость открытия активационных ворот может быть
- 26. Активационные ворота – последовательность аминокислот в виде
- 27. Существуют вещества, блокирующие работу потенциалзависимых ионных каналов.
- 28. Все блокаторы ионных каналов действуют одинаково –
- 29. Порообразующая часть ионного канала может представлять собой1)
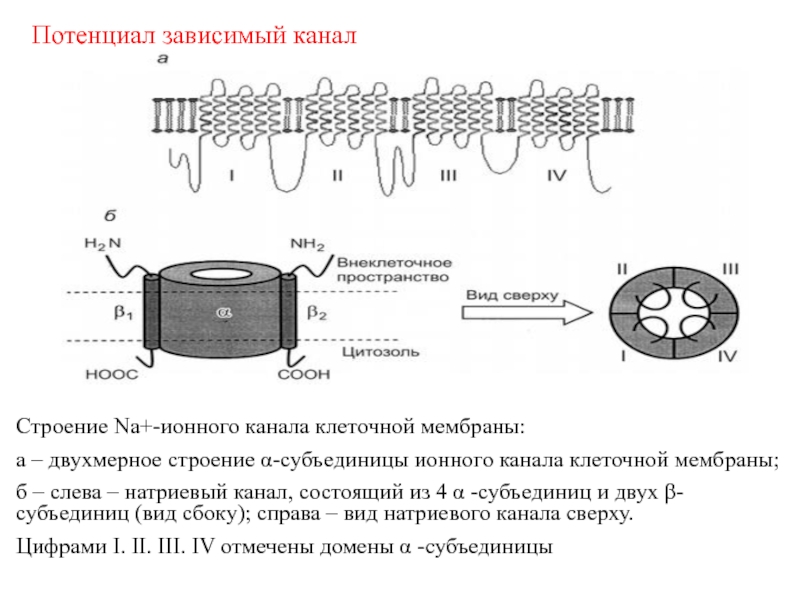
- 30. Строение Na+-ионного канала клеточной мембраны: а –
- 31. Нарушение работы ионных каналов часто приводят к
- 32. Работа ионного канала (разным цветом выделены разные
- 33. Лигандзависимые ионные каналыФормируются белковыми макромолекулами, одновременно выполняющими
- 34. Лиганд-зависимый каналЦентр связывания лиганда (трансмиттера)Клеточная мембрана2, ,
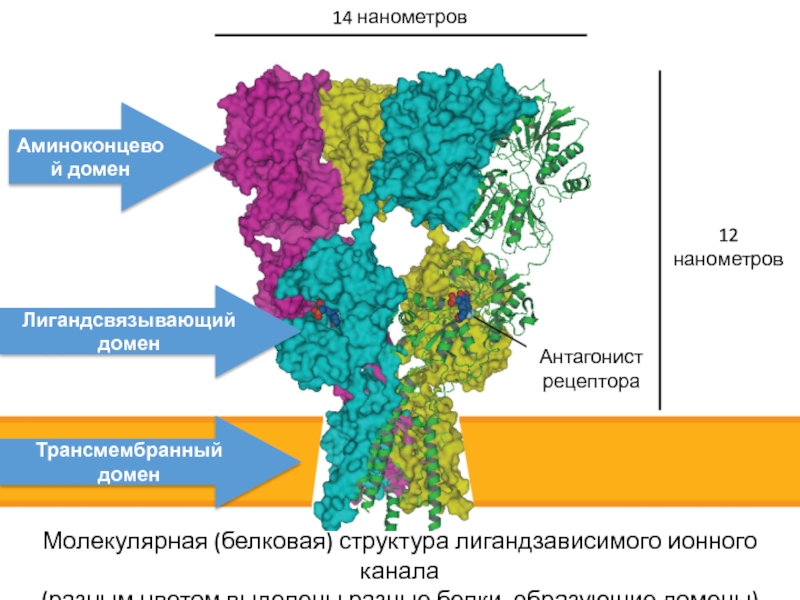
- 35. 14 нанометров12 нанометровАнтагонист рецептораТрансмембранный доменЛигандсвязывающий доменАминоконцевой доменМолекулярная
- 36. Лигандзависимые ионные каналы обычно локализованы в постсинаптических
- 37. Лигандзависимые каналы могут изменять проницаемость для катионов
- 38. Существуют медленные лигандзависимые ионные каналы. Их открытие
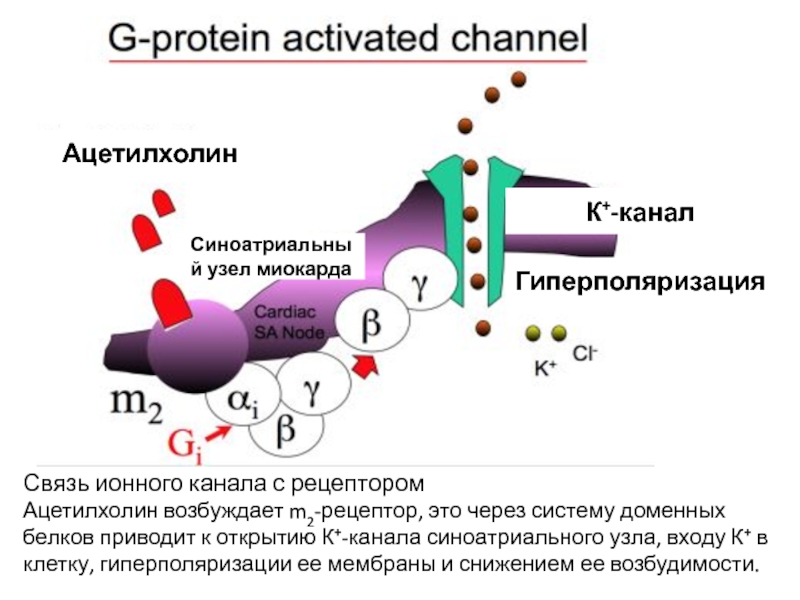
- 39. АцетилхолинК+-каналГиперполяризацияСиноатриальный узел миокардаСвязь ионного канала с рецепторомАцетилхолин
- 40. Особым типом лигандзависимых каналов являются каналы, локализованные
- 41. РецепторыРЕЦЕПЦИЯ – процесс восприятия и трансформации (преобразования)
- 42. СенсорныеМембранныеВнутриклеточныеСпециализированные клетки:1) механорецепторы, реагируют на механическое сжатие
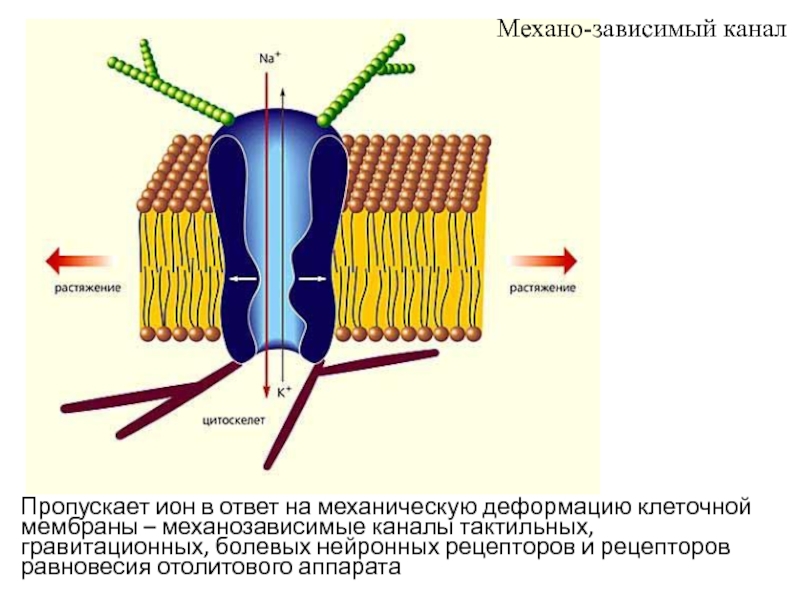
- 43. Пропускает ион в ответ на механическую деформацию
- 44. Сенсорные рецепторы
- 45. механорецепторы кожи, мышц, сердечно-сосудистой системы, внутренних органовмеханорецепторы
- 46. Кортиев органОрган равновесия
- 47. Периферическиенеинкапсулированные нервные окончания:кожа, подкожные ткани, кожные и
- 48. НоцицепторыСвободные нервные окончания безмиелиновые (медленные нервные волокна)и
- 49. Электромагнитные рецепторыПод действием фотона родопсин разрушается на
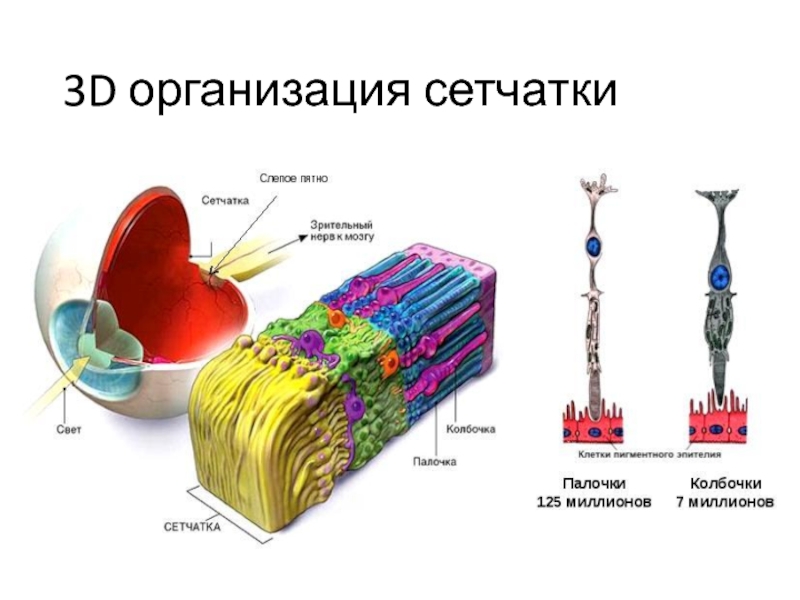
- 50. 3D организация сетчатки
- 51. Центральные (медуллярные) хеморецепторы расположены непосредственно в ростральных
- 52. ОсморецепторыРасположены в гипоталамусе и печени.Реагируют на изменение
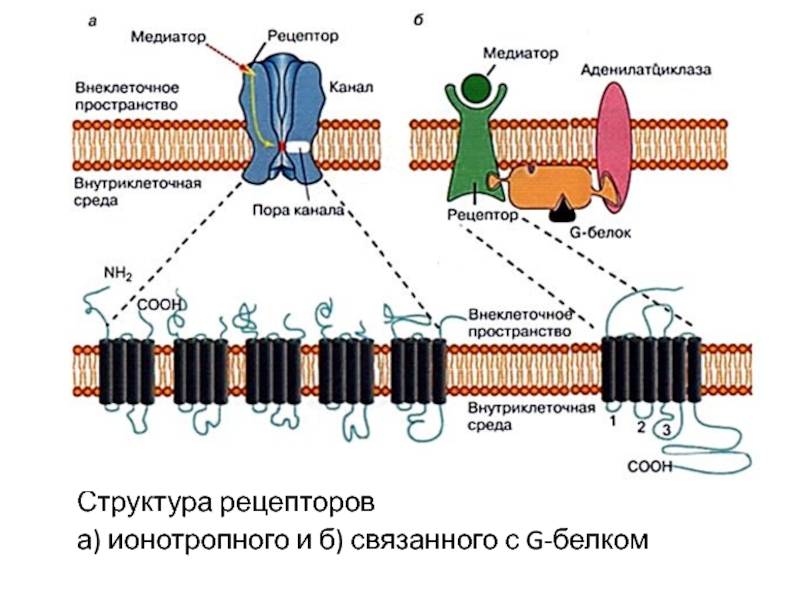
- 53. Молекулярные рецепторы
- 54. Слайд 54
- 55. Структура рецепторов а) ионотропного и б) связанного с G-белком
- 56. Мембранные рецепторы сопряженные с ионными каналамиМеханизм работы:
- 57. NMDA-рецептор представляет из себя рецепторно-ионофорный комплекс, включающий
- 58. Мембранные рецепторы сопряженные с G-белкамиМеханизм работы: Активация
- 59. Лиганд связывается с участком узнавания политопного рецептора,
- 60. Молекулярная организация рецепторов, связанных с G-белкомФОСФОИНОЗИТИДНАЯ СИСТЕМА
- 61. G-белки двух типов:GS – стимулирующие клеточный ответGI
- 62. Слайд 62
- 63. Молекулярная организация монотопных рецепторов с собственной ферментативной активностьюЛиганды:факторы роста нервов, тромбоцитов, инсулин и др.,
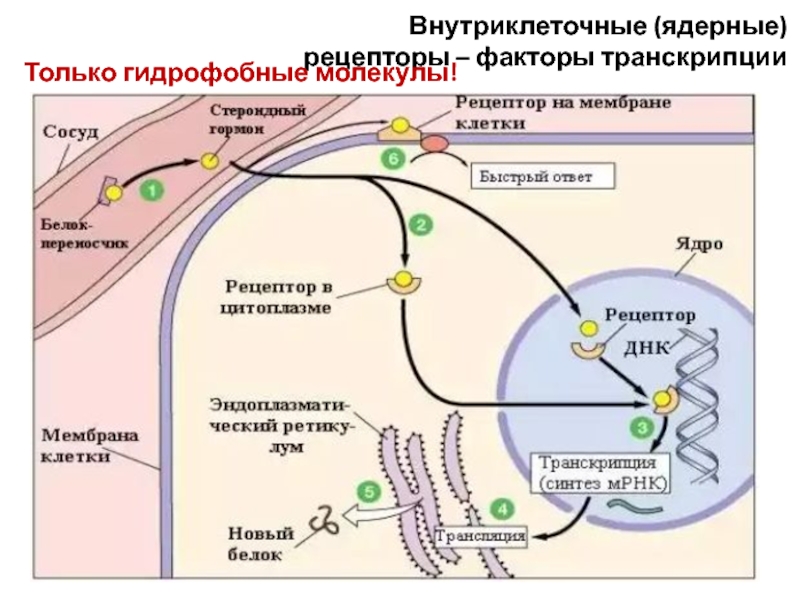
- 64. Внутриклеточные (ядерные) рецепторы – факторы транскрипцииТолько гидрофобные молекулы!
- 65. Лиганды ядерных рецепторов (жирорастворимые вещества):дийодтирозин, трийодтирозин, ретиноиды, стероидные гормоны (холекальциферолы, глюкокортикоиды, минералокортикоиды, дигидротестостерон, прогестины, эстрогены)
- 66. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1
Занятие 3:
1. Филогенез эукариотической клетки.
2. Обмен веществ, роль мембран
(ионные каналы).
СИСТЕМАСлайд 3Клетка
Прокариот
Эукариот
Царство бактерии
Царство археи
Bacilla
Cocci
Только одноклеточные
и бактериальные сообщества
(пленки и маты)
Одно и
многоклеточные
Царство растения
Царство грибы
Царство животные
Царство вирусов – возможно, это не живая
форма, но способ обмена генетической информацией при бесполом размноженииVibrio
Spirochete
V. A. Kozlov, full Bilogical Science doctor, Ph.D. Medical Science, professor
Слайд 5В 1905 K.С. Мережковский предположил, что эукариотическая клетка образовалась в
результате симбиогенеза – слияния бактериальных клеток и митохондрий - у
животных и хлоропластов и митохондрий - у грибов и растений.Возможно, что клеточное ядро образовалось из когда-то поглощенного такой симбиотической клеткой ДНК содержащего вируса.
Слайд 6Теория симбиогенеза
anaerobes
aerobes
1905 «Uber Natur und Ursprung der Chromatophoren im Pflanzen
reiche», K.С. Мережковский
Margulis, Lynn, 1970, Origin of Eukaryotic Cells, Yale University
Press, ISBN 0-300-01353-1 Внутриклеточный паразитизм
↓
Комменсализм
↓
Симбиоз
↓
Эукариотическая клетка
LECA – последний эукариотический общий предок
Слайд 7V. A. Kozlov, full Bilogical Science doctor, Ph.D. Medical Science,
professor
Р. Гупта предположил, что эукариотическая клетка возникла в результате симбиоза
грамотрицательной бактерии, относящейся к протеобактериям, и археи. Этот симбиоз был создан в кислородной среде, богатой антибиотиками, секретируемые другими микроорганизмами. Партнеры, вступили в симбиоз, при условии, что:археи – устойчивы к антибиотикам,
протеобактерии – толерантны к кислороду.
Внутриклеточный симбионт архея впоследствии был окружен клеточной мембраной бактерий, защищающей его от действия кислорода, что породило эндоплазматический ретикулум и ядерную мембрану (R.S. Gupta, 2005) . Gupta R.S. Molecular sequences and the early history of life // Microbial Phylogeny and Evolution / Ed. J. Sapp. Oxford Univ. Press, 2005. Р. 160–183.
Возможно, что основой клеточного ядра стал ДНК содержащий вирус, в который постепенно полностью мигрировали геномы протеобактерии и археи. На заключительном этапе в симбиоз вошли митохондрии и хлоропласты.
Radhey S. Gupta (Professor) Department of Biochemistry and Biomedical Sciences (HSC- 4H2) 1200 Main Street West, Hamilton, Ontario, Canada L8N 3Z5
Слайд 8Последний эукариотический общий предок имел значительно более сложный геном, чем
у современных многоклеточных.
Многоклеточность осуществлялась через потерю ненужных участков генома.
В
процессе совмещения геномов произошло размыкание кольцевой ДНК с преобразованием ее в линейную, возможно это послужило причиной формирования так называемых интронных участков ДНК, которых практически нет у прокариот и которые на ранних этапах симбиогенеза были нужны для «подгонки» геномов разных организмов друг к другу. Слайд 10нексус
Клетка – Клетка
контакты простого типа
а) адгезионные
б) интердигитация (пальцевые соединения)
контакты сцепляющего типа
а) десмосомы и адгезивные пояски
контакты запирающего
типаа) плотное соединение
коммуникационные контакты
а) нексусы
КЛЕТОЧНЫЕ
КОНТАКТЫ
Клетка – Матрикс
полудесмосомы
фокальные контакты
интегрин
кератиновые филаменты
адгезивный
поясок
плотное соединение
Слайд 13Межклеточные контакты необходимы для
соединения клеток
информационного обмена
а) межклеточного
б) с внешней
средой
Для этого клетка создает
ионные каналы
Слайд 16Общее представление о структуре и функциях ионных каналов
Каналообразующие белковые молекулы
всех ионных каналов имеют некоторые общие признаки строения и обычно представлены
большими трансмембранными белками с молекулярнымимассами выше 250 кД.
Состоят из нескольких субъединиц.
Обычно важнейшие свойства каналов определяются их α-субъединицей.
Другие субъединицы, входящие в структуру ионных каналов, играют вспомогательную роль, модулирующую свойства каналов.
Она принимает участие в формировании ионоселективной норы, сенсорного механизма трансмембранной разности потенциалов (ворот канала) и имеет места связывания для экзогенных и эндогенных лигандов.
Слайд 17Трехмерная пространственная структура
каналообразующей молекулы белка
располагается
в цитоплазматической
мембране
устья канала, обращенные
к наружной и внутренней сторонам мембраны, пору, заполненную водой
«ворота» канала
образуются участком пептидной цепи, который может легко изменять свою конформацию и определять открытое или закрытое состояние канала.
от ее размеров и заряда зависят
селективность и проницаемость ионного канала.
Проницаемость канала для данного иона определяется 1) размерами,
2) величиной заряда и
3) гидратной оболочкой.
формирует
Слайд 18Описано > 100 разновидностей ионных каналов, для их классификации используют
различные подходы.
Один из них основан на учете различий в
строении каналов и в механизмах функционирования. Ионные каналы можно разделить на несколько типов:
пассивные ионные каналы, или каналы покоя;
каналы щелевых контактов;
каналы, состояние которых
контролируется влиянием на их воротный механизм
механических факторов (механочувствительные каналы),
разности потенциалов на мембране (потенциалзависимые каналы)
или лигандов, связывающихся с каналообразующим белком на внешней, или внутренней стороне мембраны, или поре канала (лигандзависимые каналы).
1) закрытое
2) открытое
3) инактивированное
Слайд 19Пассивные каналы
могут быть открытыми (активными) в покоящихся клетках,
т.е. в отсутствие каких-либо воздействий
не являются строго селективными,
через них
мембрана клетки может «протекать» для нескольких ионов, например К+ и CI–; К+ и Na+; Ca2+. Поэтому второе название этих каналов – каналы утечки.
каналы цитоплазматических мембран нервных волокон и их окончаний, клеток поперечно-полосатой, гладкой мускулатуры, миокарда и др. тканей
Формируют и поддерживают потенциал покоя цитоплазматической мембраны клетки
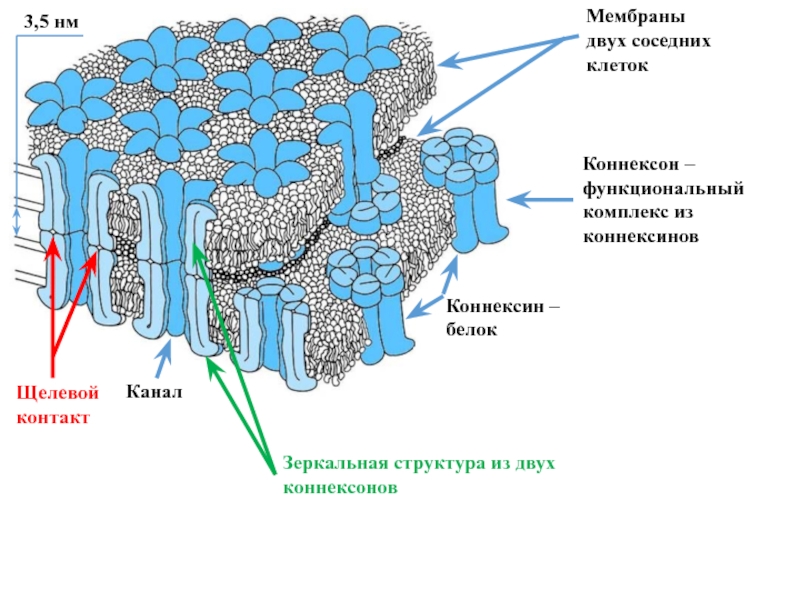
Слайд 20Каналы щелевых (плотных) контактов клеток
Каналы щелевых контактов формируются в области
контакта двух соседних клеток, очень близко (3,5 нм) прилежащих друг
к другу.В мембране каждой контактирующей клетки шесть субъединиц белков коннексинов формируют гексагональную структуру – коннексон, в центре которой образуется пора или ионный канал (следующий слайд).
В точке контакта в мембранах обеих клеток образуется зеркальная структура из двух коннексонов, и ионный канал между ними становится общим.
Через такие ионные каналы из клетки в клетку могут перемещаться
1) различные минеральные ионы, в том числе Са2+,
2) низкомолекулярные органические вещества.
Каналы щелевых контактов клеток обеспечивают передачу информации между клетками миокарда, гладких мышц, сетчатки глаза, нервной системы.
Слайд 21Мембраны
двух соседних
клеток
Канал
Щелевой
контакт
3,5 нм
Коннексин – белок
Коннексон – функциональный
комплекс из коннексинов
Зеркальная структура из двух коннексонов
Слайд 22Ионные каналы
открываются и закрываются
бывают в ответ на
механозависимые
потенциалзависимые
лигандзависимые
взаимодействие низкомолекулярного медиатора с рецепторным участком канала
механическую деформацию
изменение потенциала покоя мембраны
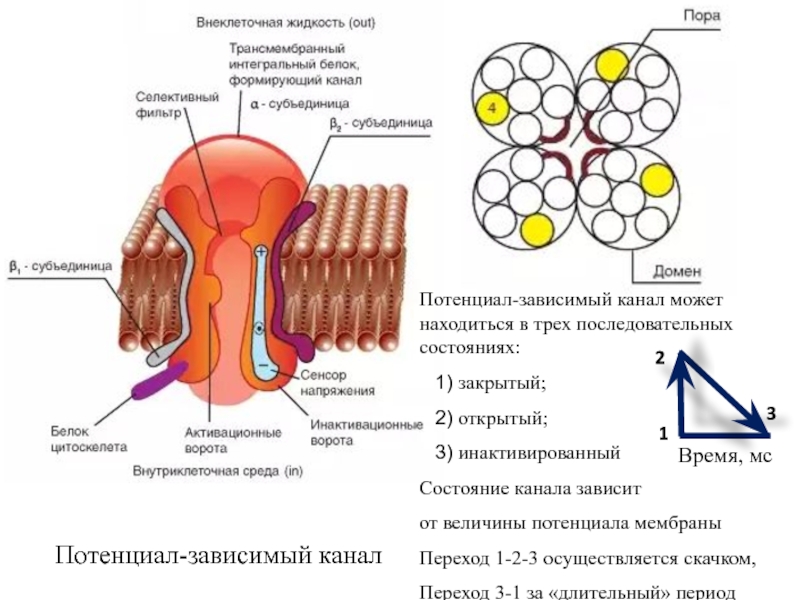
Слайд 23Потенциалзависимые каналы
Состояние этих каналов управляется силами электрического поля, создаваемого величиной
разности потенциалов () на мембране.
Они могут находиться в неактивном
(закрытом), активном (открытом) и инактивированном состояниях, которые контролируются состоянием активационных и инактивационных ворот, зависящим от на мембране.В покоящейся клетке потенциал зависимый канал находится обычно в закрытом состоянии, из которого он может быть открыт или активирован.
Вероятность его самостоятельного открытия невысока, в состоянии покоя в мембране открыто небольшое количество этих каналов.
Деполяризация мембраны (уменьшение ) активирует канал, повышая вероятность его открытия. Для открытия канала необходимо достижение критического уровня деполяризации.
Функцию активационных ворот выполняет электрически заряженная аминокислота (лизин или аргинин, расположенные в каждой третьей позиции на данном участке молекулы), закрывающая вход в устье канала.
Лизин и аргинин, как полярные аминокислоты, являются сенсором на мембране; при достижении критического уровня деполяризации мембраны заряженная часть молекулы сенсора смещается в сторону липидного микроокружения каналообразующей молекулы и ворота открывают вход в устье канала (см. следующий слайд) .
Слайд 24Потенциал-зависимый канал может находиться в трех последовательных состояниях:
закрытый;
открытый;
инактивированный
Состояние канала зависит
от величины потенциала мембраны
Переход 1-2-3 осуществляется скачком,
Переход 3-1 за «длительный» период времени
Потенциал-зависимый канал
Слайд 25Скорость открытия активационных ворот может быть
очень высокой
и низкой.
По этому показателю потенциалзависимые ионные каналы делят на
быстрые (например, быстрые потенциалзависимые Na+ каналы) и медленные (например, медленные потенциалзависимые Ca2+ каналы).
Скорость срабатывания канала зависит от подвижности активационных ворот.
Быстрые каналы открываются мгновенно (мкс) и остаются открытыми в среднем в течение 1 мс. Их активация сопровождается быстрым лавинообразным возрастанием проницаемости канала для определенных ионов – пропускная способность открытого канала поразительна: ток ионов происходит со скоростью до 100 000 000 ионов/с.
Медленные каналы открываются вместе с быстрыми, но скорость движения активационных ворот в них значительно меньше, поэтому и движение ионов через них начинается позднее.
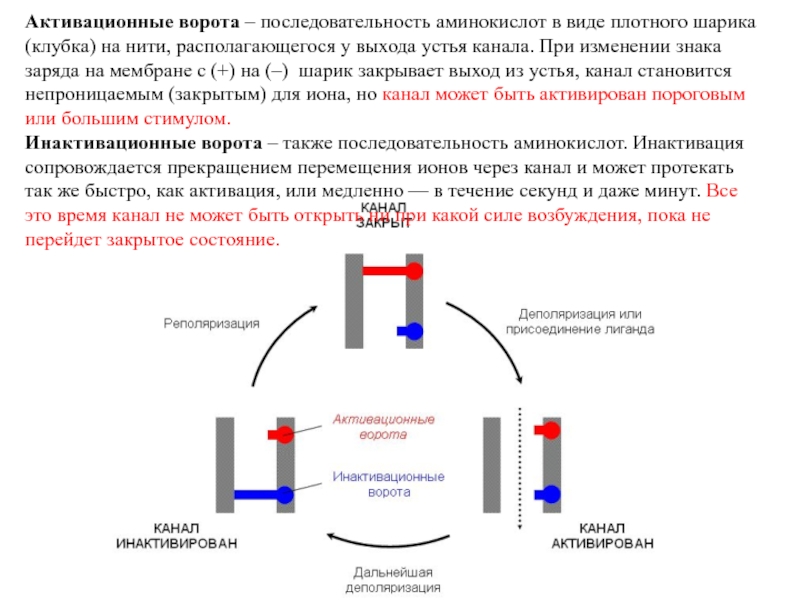
Слайд 26Активационные ворота – последовательность аминокислот в виде плотного шарика (клубка)
на нити, располагающегося у выхода устья канала. При изменении знака
заряда на мембране с (+) на (–) шарик закрывает выход из устья, канал становится непроницаемым (закрытым) для иона, но канал может быть активирован пороговым или большим стимулом.Инактивационные ворота – также последовательность аминокислот. Инактивация сопровождается прекращением перемещения ионов через канал и может протекать так же быстро, как активация, или медленно — в течение секунд и даже минут. Все это время канал не может быть открыть ни при какой силе возбуждения, пока не перейдет закрытое состояние.
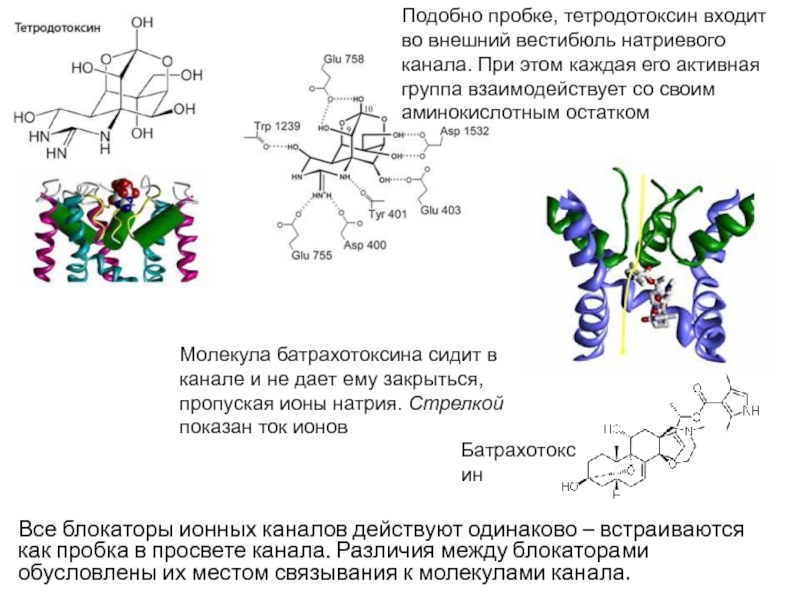
Слайд 27Существуют вещества, блокирующие работу потенциалзависимых ионных каналов. Таким образом, возможно
еще одно состояние ионного канала – блокированное. Такие вещества получили
название блокаторов ионных каналов.Одним из первых блокаторов было описано вещество тетродотоксин (образуется в организме рыбы фугу), блокатор потенциалзависимых натриевых каналов. В эксперименте при его введении в организм животных отмечались потеря чувствительности, расслабление мышц, обездвиженность, остановка дыхания и смерть.
В клинике используют лидокаин, новокаин, прокаин — вещества, при введении которых в организм в небольших дозах развивается блокада потенциалзависимых натриевых каналов нервных волокон и блокируется передача в ЦНС сигналов от болевых рецепторов, это местные обезболивающие средства.
Слайд 28Все блокаторы ионных каналов действуют одинаково – встраиваются как пробка
в просвете канала. Различия между блокаторами обусловлены их местом связывания
к молекулами канала.Подобно пробке, тетродотоксин входит во внешний вестибюль натриевого канала. При этом каждая его активная группа взаимодействует со своим аминокислотным остатком
Молекула батрахотоксина сидит в канале и не дает ему закрыться, пропуская ионы натрия. Стрелкой показан ток ионов
Батрахотоксин
Слайд 29Порообразующая часть ионного канала может представлять собой
1) единый полипептид, организованный
в виде нескольких идентичных трансмембранных доменов,
2) нескольких белковых субъединиц,
которые могут быть как одинаковы (гомоолигомер), так и неодинаковы (гетероолигомер) по своей структуре. Каждая порообразующая субъединица или домен образована несколькими трансмембранными α-спиральными сегментами с N- и С-терминальными доменами белка, направленными внутриклеточно или внеклеточно.
Один из трансмембранных сегментов субъединицы потенциал-активируемых каналов содержит уникальный набор положительных зарядов и функционирует как сенсор потенциала (Armstrong, Hille, 1998, Hille, 2001).
Практически все каналы в составе образующих пору канала субъединиц имеют регуляторные домены, связывающиеся с различными регуляторными молекулами.
Каналы обладают свойством селективно пропускать ионы, которое реализуется в самом узком месте канала – селективном фильтре.
Слайд 30Строение Na+-ионного канала клеточной мембраны:
а – двухмерное строение α-субъединицы
ионного канала клеточной мембраны;
б – слева – натриевый канал,
состоящий из 4 α -субъединиц и двух -субъединиц (вид сбоку); справа – вид натриевого канала сверху. Цифрами I. II. III. IV отмечены домены α -субъединицы
Потенциал зависимый канал
Слайд 31Нарушение работы ионных каналов часто приводят к заболеваниям — каналопатиям.
Основная причина таких нарушений — наследственные мутации, влияющие на структуру
канала.Примеры каналопатий:
- муковисцидоз
- сердечные аритмии
- синдром Бругада (натриевый канал кардиомиоцитов)
синдром Тимоти (аномалии кальциевых каналов)
генерализованная эпилепсия
Слайд 32Работа ионного канала
(разным цветом выделены разные белки, образующие домены)
пропускная
способность открытого канала поразительна:
ток ионов происходит со скоростью до
100 000 000 ионов/сСлайд 33Лигандзависимые ионные каналы
Формируются белковыми макромолекулами, одновременно выполняющими функцию
ионных каналов
и селективных рецепторов лигандов.
Поэтому за ними закрепились разные синонимические названия, например: синаптический рецептор, лигандзависимый канал.
В отличие от потенциалзависимых ионных каналов, открытие которых осуществляется в ответ на уменьшение , лигандзависимые ионные каналы открываются (активируются) при взаимодействии участка узнавания лиганда белка рецептора молекулы с лигандом — веществом, к которому рецепторный участок узнавания имеет высокое сродство.
Слайд 34Лиганд-зависимый канал
Центр связывания лиганда (трансмиттера)
Клеточная мембрана
2, , , белковые
субъединицы, образующие систему распознавания ионов
Гидрофобная поверхность
Гидрофильная полость
Слайд 3514 нанометров
12 нанометров
Антагонист рецептора
Трансмембранный домен
Лигандсвязывающий домен
Аминоконцевой домен
Молекулярная (белковая) структура лигандзависимого
ионного канала
(разным цветом выделены разные белки, образующие домены)
Слайд 36Лигандзависимые ионные каналы обычно локализованы в постсинаптических мембранах нервных клеток
и их отростков, а также мышечных волокон.
Типичными примерами лигандзависимых
ионных каналов являются каналы пре- и постсинаптических мембран, активируемые ацетилхолином, глутаматом, аспартатом, -аминомасляной кислотой, катехоламинами, глицином и др. синаптическими нейромедиаторами. Обычно название канала (рецептора) отражает тип нейромедиатора, который в естественных условиях является его лигандом. Так, если это каналы нервно-мышечного синапса, в котором используется нейромедиатор ацетилхолин, то используется термин «ацетилхолиновый рецептор», если он является к тому же чувствительным к никотину, то его называют никотинчувствительным, или просто н-ацетилхолиновым, рецептором (н-холинорецептор, N-АЦХ).
Слайд 37Лигандзависимые каналы могут изменять проницаемость для катионов Na+ и К+
или для К+ и анионов СI–. Такая избирательность связывания лиганда
и изменения ионной проницаемости генетически закреплена в пространственной структуре макромолекулы.Если взаимодействие медиатора и рецепторной части макромолекулы, формирующей ионный канал, непосредственно изменяет проницаемость канала, то в течение нескольких миллисекунд это меняет проницаемости постсинаптической мембраны для минеральных ионов и величину постсинаптического потенциала, например, ацетилхолиновые и глутаматные каналы.
Такие каналы названы быстрыми и локализуются, например, в постсинаптической мембране аксо-дендритных возбуждающих синапсов и аксосоматических тормозных синапсов.
Слайд 38Существуют медленные лигандзависимые ионные каналы.
Их открытие реализуется через цепь
последовательных событий:
первичный медиатор (лиганд, нейромедиатор) активирует G-белок → он
взаимодействует с GTP → который запускает синтез вторичных медиаторов (посредников) во внутриклеточной передаче сигнала → которые фосфорилируют ионный канал → это меняет его проницаемость для минеральных ионов → и, как следствие, величину постсинаптической . Эта цепь событий осуществляется уже за сотни миллисекунд.
С такими медленными лигандзависимыми ионными каналами мы встретимся при изучении механизмов регуляции работы сердца, гладких мышц.
Слайд 39Ацетилхолин
К+-канал
Гиперполяризация
Синоатриальный узел миокарда
Связь ионного канала с рецептором
Ацетилхолин возбуждает m2-рецептор, это
через систему доменных белков приводит к открытию К+-канала синоатриального узла,
входу К+ в клетку, гиперполяризации ее мембраны и снижением ее возбудимости.Слайд 40Особым типом лигандзависимых каналов являются каналы, локализованные в мембранах эндоплазматического
ретикулума гладкомышечной клетки.
Их лигандом является вторичный посредник внутриклеточной передачи
сигнала инозитолтрифосфат – ИФ3. Описаны ионные каналы, характеризующиеся некоторыми структурными и функциональными свойствами, присущими как потенциалзависимым, так и лигандзависимым ионным каналам. Они являются потенциалНЕчувствительными ионными каналами, состояние воротного механизма которых контролируется циклическими нуклеотидами (цАМФ и цГМФ).
Циклические нуклеотиды связываются с внутриклеточной СООН-терминалью каналообразующей молекулы белка и активируют канал. Эти каналы менее избирательны для катионов и регулируют проницаемость для других ионов.
Так, Са2+, поступая через активированные каналы из внеклеточной среды, блокируют проницаемость каналов для Na+.
Такие каналы встречаются в палочках сетчатки глаза, их проницаемость для Са2+ и Na+ определяется уровнем цГМФ.
Лигандзависимые ионные каналы широко представлены в мембранных структурах, обеспечивающих синаптическую передачу сигналов от ряда сенсорных рецепторов в ЦНС; передачу сигналов в синапсах нервной системы и от нейронов к эффекторным клеткам.
Слайд 41Рецепторы
РЕЦЕПЦИЯ – процесс восприятия и трансформации (преобразования) энергии внешнего раздражителя
в нервный импульс или сложную последовательность внутриклеточных процессов, посредством мембранных
и/или цитоплазматических процессов. Функцию рецепции выполняют специальные образования – рецепторы.Слайд 42Сенсорные
Мембранные
Внутриклеточные
Специализированные клетки:
1) механорецепторы, реагируют на механическое сжатие или рас-тяжение рецептора
или смежных с ним тканей (тактильные, слухо-вые, гравитационные, равнове-сия, суставно-мышечного
чувства);2) терморецепторы (тепловые и холодовые), воспринимают изменения температуры;
3) ноцицепторы (болевые рецепторы);
4) электромагнитные, восприни-мают свет на сетчатке глаза;
5) хеморецепторы (вкус, запах, [Na+], осмос)
С собственной ферментативной активностью
Сопряженные с ферментами
Сопряженные с G-белками
Рецепторы
Молекулярные
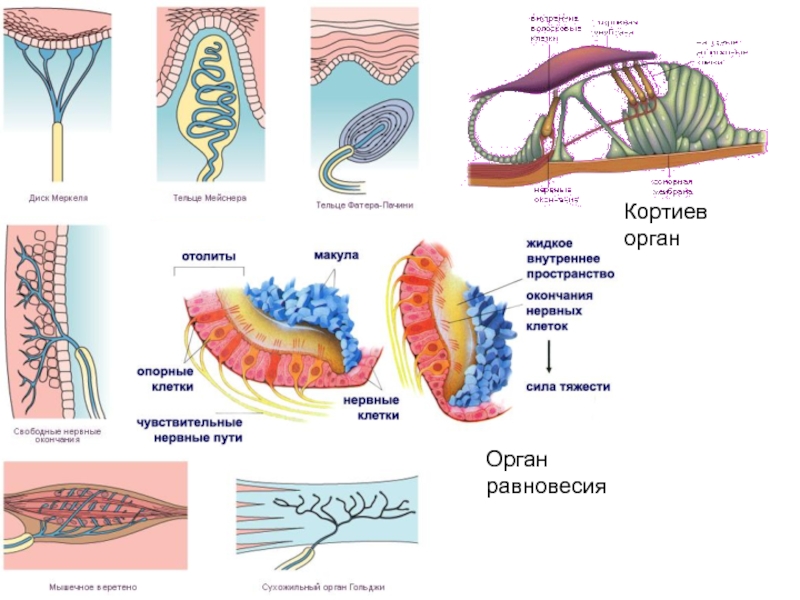
Слайд 43Пропускает ион в ответ на механическую деформацию клеточной мембраны –
механозависимые каналы тактильных, гравитационных, болевых нейронных рецепторов и рецепторов равновесия
отолитового аппаратаМехано-зависимый канал
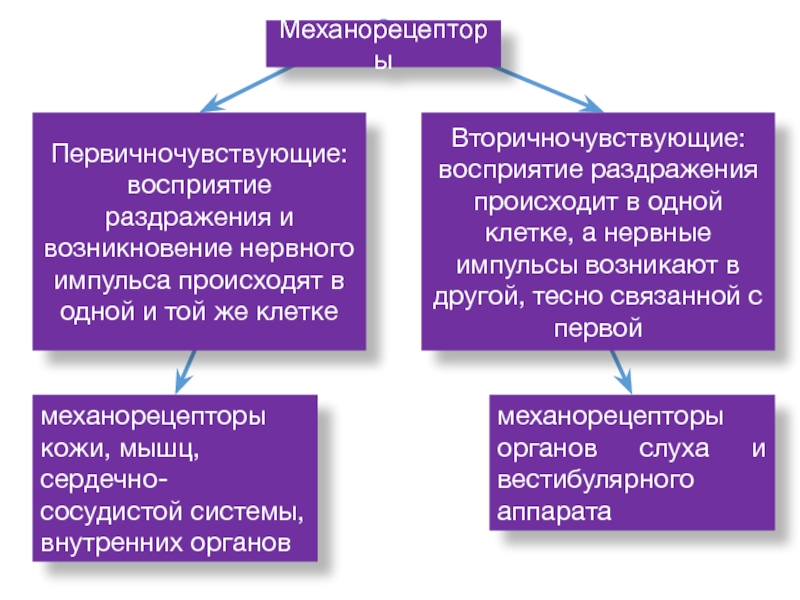
Слайд 45механорецепторы кожи, мышц,
сердечно-сосудистой системы,
внутренних органов
механорецепторы органов слуха и
вестибулярного аппарата
Механорецепторы
Вторичночувствующие:
восприятие раздражения происходит в одной клетке, а нервные импульсы
возникают в другой, тесно связанной с первойПервичночувствующие:
восприятие раздражения и возникновение нервного импульса происходят в одной и той же клетке
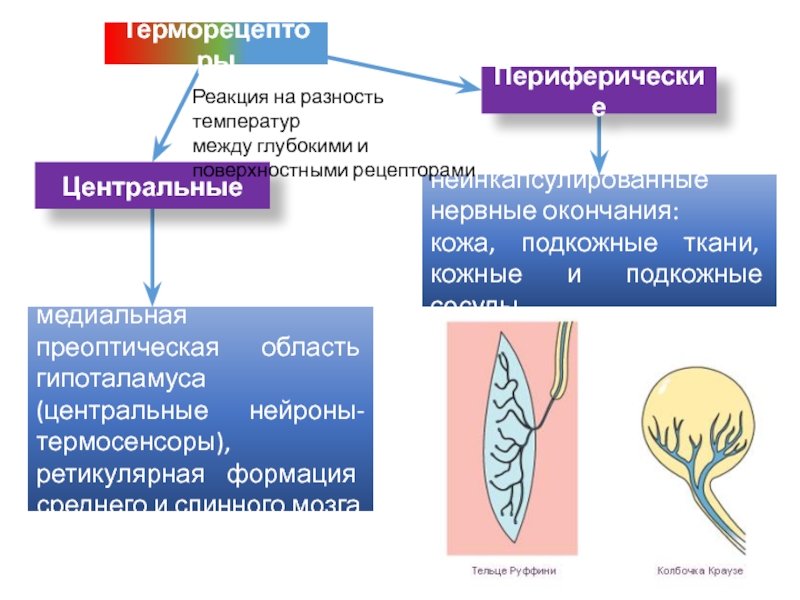
Слайд 47Периферические
неинкапсулированные нервные окончания:
кожа, подкожные ткани, кожные и подкожные сосуды
медиальная преоптическая
область гипоталамуса (центральные нейроны-термосенсоры), ретикулярная формация среднего и спинного мозга
Терморецепторы
Центральные
Реакция
на разность температур между глубокими и
поверхностными рецепторами
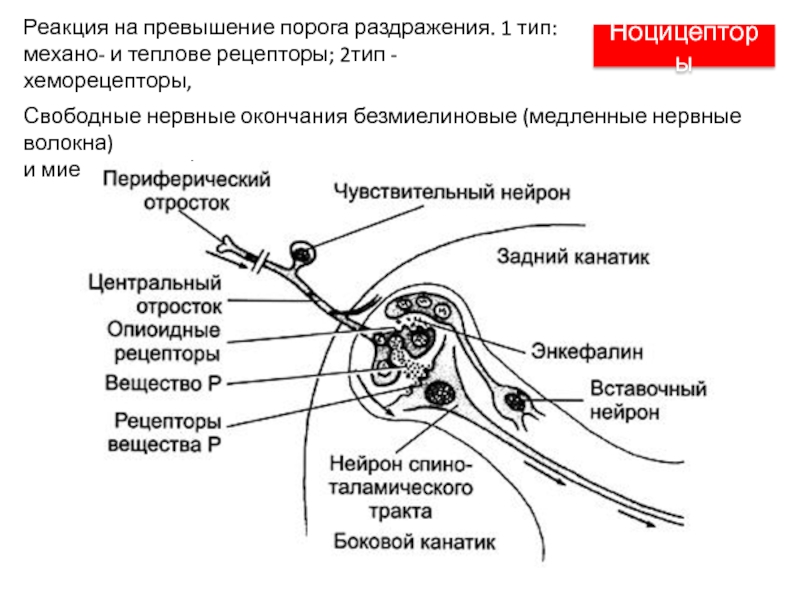
Слайд 48Ноцицепторы
Свободные нервные окончания безмиелиновые (медленные нервные волокна)
и миелиновые (быстрые нервные
волокна)
Реакция на превышение порога раздражения. 1 тип: механо- и теплове
рецепторы; 2тип - хеморецепторы, Слайд 49Электромагнитные рецепторы
Под действием фотона родопсин разрушается на люмиродопсин и метародопсин,
который гидролизуется с водой с образованием 11-транс-ретиналя и опсина. Выделяемая
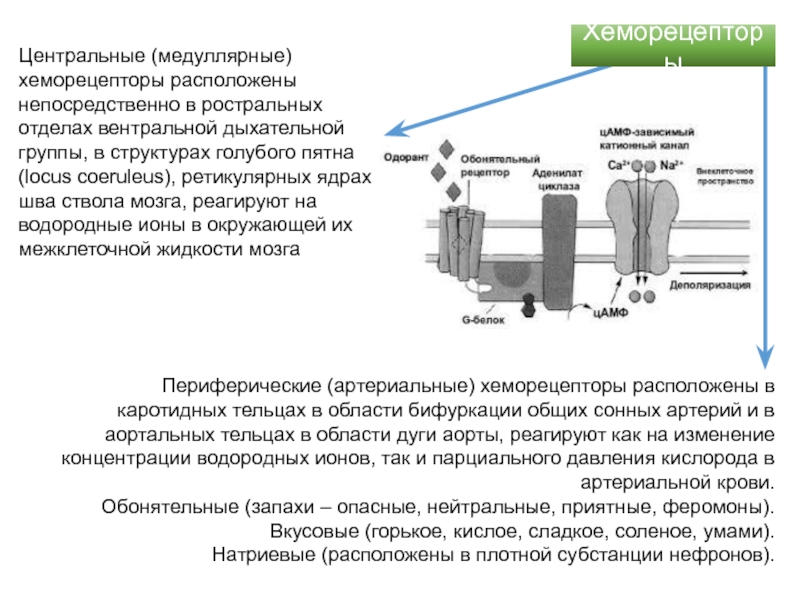
за 200 фемтосекунд! в этом процессе энергия возбуждает потенциал действия в нейронах сетчатки.Слайд 51Центральные (медуллярные) хеморецепторы расположены непосредственно в ростральных отделах вентральной дыхательной
группы, в структурах голубого пятна (locus coeruleus), ретикулярных ядрах шва
ствола мозга, реагируют на водородные ионы в окружающей их межклеточной жидкости мозгаПериферические (артериальные) хеморецепторы расположены в каротидных тельцах в области бифуркации общих сонных артерий и в аортальных тельцах в области дуги аорты, реагируют как на изменение концентрации водородных ионов, так и парциального давления кислорода в артериальной крови.
Обонятельные (запахи – опасные, нейтральные, приятные, феромоны).
Вкусовые (горькое, кислое, сладкое, соленое, умами).
Натриевые (расположены в плотной субстанции нефронов).
Хеморецепторы
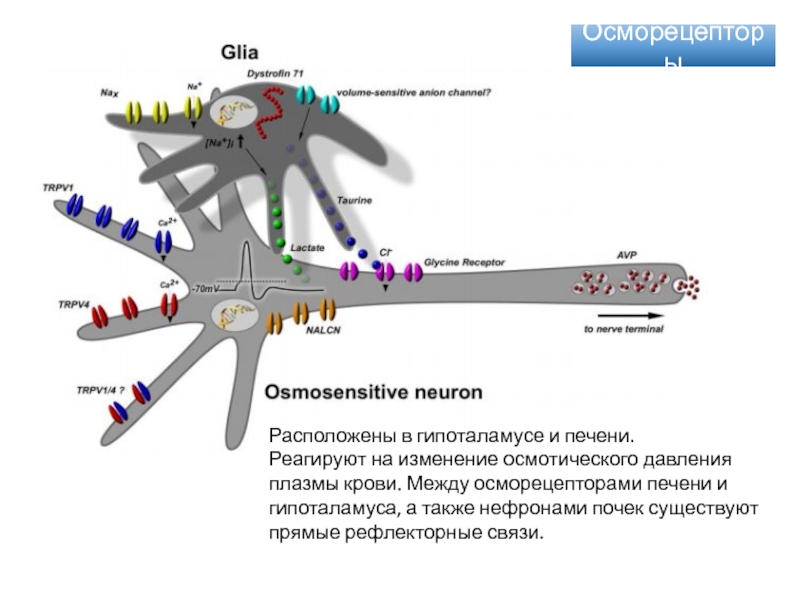
Слайд 52Осморецепторы
Расположены в гипоталамусе и печени.
Реагируют на изменение осмотического давления плазмы
крови. Между осморецепторами печени и гипоталамуса, а также нефронами почек
существуют прямые рефлекторные связи.Слайд 56Мембранные рецепторы сопряженные с ионными каналами
Механизм работы:
Активация рецептора
Открытие ионного канала
Изменение электрического потенциала клеточной мембраны
Изменение функционального состояния клетки
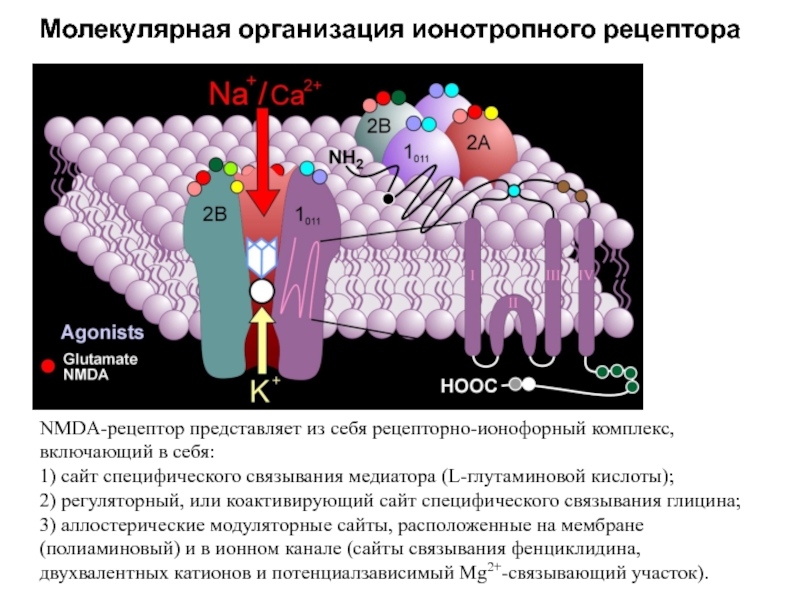
Слайд 57NMDA-рецептор представляет из себя рецепторно-ионофорный комплекс, включающий в себя:
1) сайт
специфического связывания медиатора (L-глутаминовой кислоты);
2) регуляторный, или коактивирующий сайт специфического
связывания глицина;3) аллостерические модуляторные сайты, расположенные на мембране (полиаминовый) и в ионном канале (сайты связывания фенциклидина, двухвалентных катионов и потенциалзависимый Mg2+-связывающий участок).
Молекулярная организация ионотропного рецептора
Слайд 58Мембранные рецепторы сопряженные с G-белками
Механизм работы:
Активация рецептора
Активация G–белка
Активация фермента, катализирующего образование второго посредника
Образование второго посредника Активация протеинкиназы
Фосфорелирование эффекторного белка
Изменение функционального состояния клетки
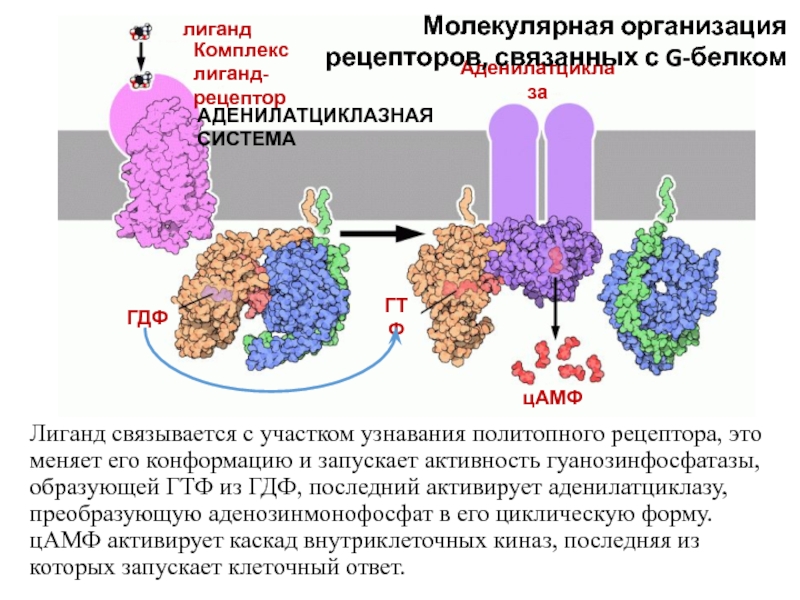
Слайд 59Лиганд связывается с участком узнавания политопного рецептора, это меняет его
конформацию и запускает активность гуанозинфосфатазы, образующей ГТФ из ГДФ, последний
активирует аденилатциклазу, преобразующую аденозинмонофосфат в его циклическую форму. цАМФ активирует каскад внутриклеточных киназ, последняя из которых запускает клеточный ответ.лиганд
Комплекс лиганд-рецептор
Аденилатциклаза
ГДФ
ГТФ
цАМФ
Молекулярная организация рецепторов, связанных с G-белком
АДЕНИЛАТЦИКЛАЗНАЯ СИСТЕМА
Слайд 61G-белки двух типов:
GS – стимулирующие клеточный ответ
GI – ингибирующие клеточный
ответ
Лиганды (первичные посредники) – гидрофильные амины, аминоподобные вещества, пептиды:
ацетилхолин, гистамин,
катехоламины (дофамин, норадреналин, адреналин), серотонин, гормоны гипофизаВторичные посредники (мессенджеры):
циклические нуклеотиды (цАМФ, цГМФ – гуанилатциклазная система),
диацилглицерол (ДАГ)
инозитолдифосфат (ИТФ2)
инозитолтрифосфат (ИТФ3)